过表达髓样分化蛋白1对高脂饮食诱导的肥胖小鼠心电的影响*
2020-03-11付辉帅维孔彬沈才杰蒋小波黄鹤
付辉 帅维 孔彬 沈才杰 蒋小波 黄鹤
肥胖是世界范围内共同的健康问题之一,它与心血管疾病的发病率与死亡率密切相关[1]。肥胖引起心律失常发生的主要机制是氧化应激和炎症反应介导的心室电重构[2-3]。机体内的炎症反应通路主要是通过Toll样受体4(TLR4)介导的反应通路。研究已证实 TLR4是心脏钙调蛋白相关蛋白激酶Ⅱ(CaMKⅡ)的上游信号,CaMKⅡ在肥胖相关的心脏重构中起重要作用[4-6]。髓样分化蛋白1(MD1)是一种分泌糖蛋白,通过与TLR4同源分子抗辐射蛋白105(radioprotective protein 105,RP105)形成复合物,可负性调节TLR4信号转导通路[7-8]。本中心前期研究已证实,MD1基因敲除可激活TLR4信号转导通路恶化压力负荷诱导的心力衰竭小鼠左心室电重构[9]。本实验采用MD1转基因小鼠,给予高脂饮食诱导小鼠肥胖,旨在探究MD1对肥胖小鼠心电生理指标的影响。
1 材料与方法
1.1实验动物的来源分组和鉴定 MD1转基因小鼠(C57BL/6背景)购自日本理化学研究所RIKEN(RBRC02386),通过MD1转基因雌雄小鼠配种繁殖,经过鉴定获得MD1转基因小鼠。MD1转基因小鼠鉴定方法:剪取小鼠脚趾标本后,用碧云天的基因组DNA小量抽提试剂盒(离心柱式)抽提小鼠脚趾组织的基因组DNA。将提取好的DNA溶液稀释一定的倍数,用酶标仪检测DNA溶液的纯度,取A260/A280值≥1.8的DNA溶液进行PCR反应。然后通过凝胶电泳后,出现分子量大小为673bp目的条带是MD1转基因小鼠(图1),可用于实验,未出现目的条带的小鼠,不予使用。最终鉴定共获得24只MD1转基因小鼠。将24只MD1转基因小鼠先普通饮食喂养至6周龄后随机分普通饮食的MD1转基因小鼠组(TG-ND)和高脂饮食的MD1转基因小鼠组(TG-HFD),每组12只,分别给予普通饮食(ND)和高脂饮食(HFD)继续喂养20周。24只6周龄野生型小鼠(C57BL/6)购自武汉大学动物实验中心[许可证号:SCXK(鄂)2014-0004]。将野生型小鼠随机分普通饮食的野生型小鼠组(WT-ND)和高脂饮食的野生型小鼠组(WT-HFD),每组12只,分别给予普通饮食(ND)和高脂饮食(HFD),WT-HFD组小鼠给予高脂饲料,进行高脂饮食喂养20周[10],WT-ND组给予普通饲料喂养20周。高脂饲料脂肪含量60%,普通饲料脂肪含量10%。每周称量1次体重,并做好记录。实验动物饲养和繁殖在武汉大学心血管病研究所SPF级实验动物中心[许可证号:SYXK(鄂)2009-0053]。
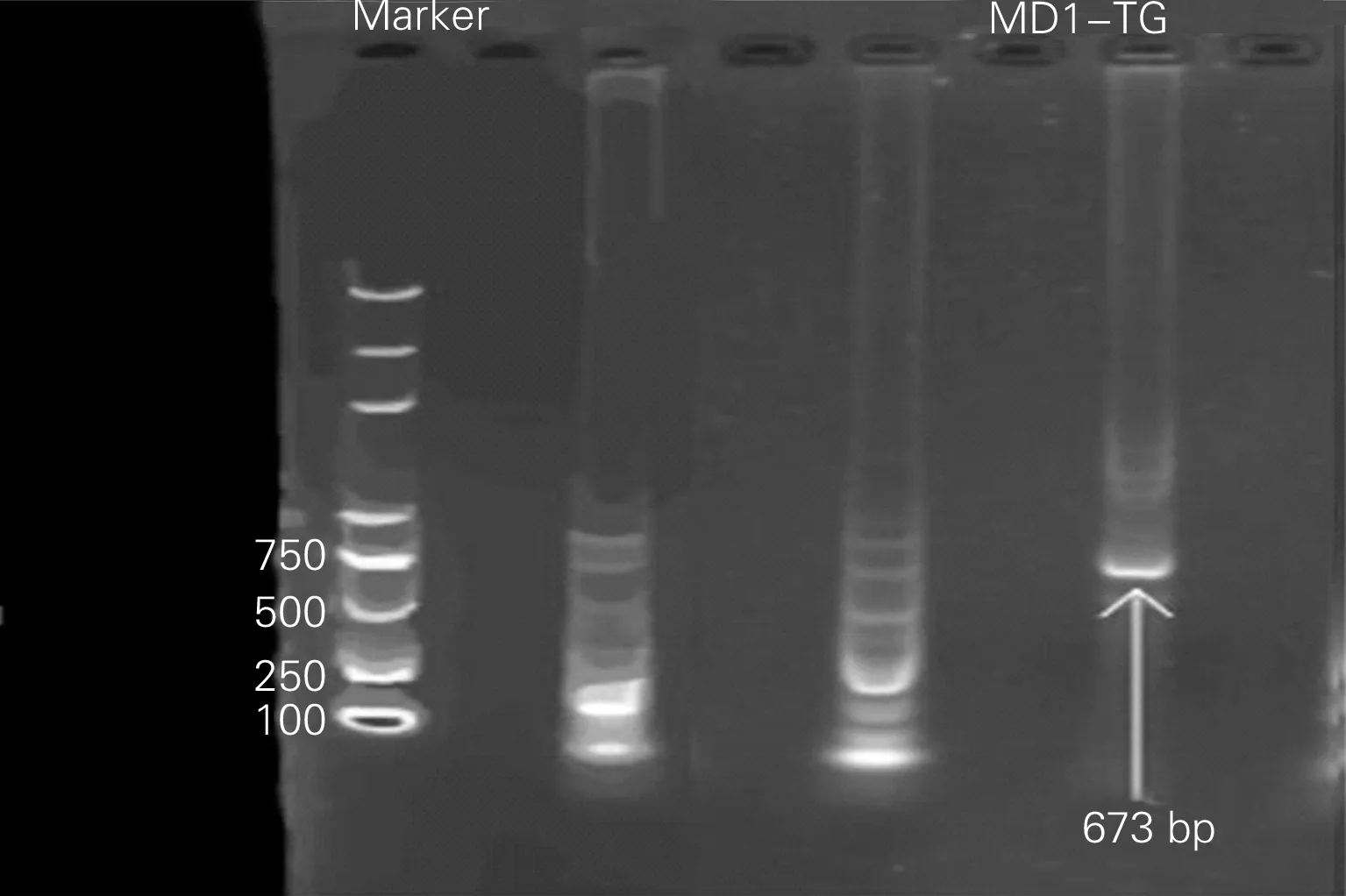
出现分子量大小为673 bp目的条带是MD1转基因小鼠
1.2糖耐量试验 入组喂养20周后,小鼠禁食不禁水12 h,每组随机选取8只小鼠,采用尾静脉取血方式测定小鼠血糖浓度,首先测量小鼠基础血糖值,然后腹腔注射葡萄糖溶液剂量为2 g/kg,于注射葡萄糖后15,60和120 min分别测定小鼠的血糖值。
1.3血脂测量 入组喂养20周后,每组随机选取8~9只小鼠,采用眼球取血,3 000 rpm离心15 min,然后取定量血清,使用Advia2400自动生化分析仪(西门子,柏林,德国)和试剂盒测定血清总胆固醇(TC)、甘油三脂(TG)和低密度脂蛋白(LDL)。
1.4心脏超声测量 入组喂养20周后行心脏超声测量小鼠心功能。异氟烷气体麻醉小鼠后,以温控小电热毯保持体温在36~37℃,采用Vevo 2100高分辨小动物超声成像系统进行超声检测。每组随机选取8~9只小鼠进行超声心动图测量左室收缩末内径(LVESD)、左室舒张末内径(LVEDD)、左室缩短分数(LVFS)。
1.5体表心电图 入组喂养20周后行体表心电图记录。给予3%戊巴比妥钠(90 mg/kg,腹腔注射)麻醉小鼠后,以温控小电热毯保持体温在36~37℃,利用PowerLab数据采集系统(澳大利亚AD Instruments公司)进行Ⅱ导联体表心电图记录。每组随机选取8~9只小鼠记录体表心电图,持续记录基础状态下小鼠心电图5~10 min,并监测心律失常发生情况。待心电图记录完成后,利用PowerLab数据分析系统,自动分析和测量RR间期、QT间期和QTc间期(采用Bazett算法计算QTc)。
1.6心脏离体灌流及电生理测定 完成体表心电图记录后进行心脏离体灌流及电生理测量。小鼠经腹腔注射肝素钠2 000 U,10 min后腹腔注射3%戊巴比妥钠(90 mg/kg)麻醉小鼠,然后迅速取下心脏,置于经4℃预冷的台式液中。在显微镜下迅速将22号针头经主动脉逆行穿入并固定。然后将离体心脏与灌流针一同连接Langendorff心脏灌流装置上经主动脉逆行灌流100%氧饱和的HEPES缓冲Troyde液,系统保持37℃恒温,灌流速度约2~3 ml/min,灌注压稳定在60~80 mmHg。稳定后用手术缝线将主动脉根部系于针头上。心电图记录电极阳极的盘状铂金电极固定于心底部托盘装置上方,连同托盘一起紧贴心脏,阴极钩挂于主动脉根部,模拟肢体Ⅱ导联,观察并记录心脏电活动。固定铂电极与右室的基底表面相接触以提供起搏刺激,同时用两个定制的直径0.25 mm的Ag-AgCl电极记录左室单相动作电位(MAP)。待灌流心脏稳定后,先进行S1S1刺激,S1S1起搏周长(PCL)从150 ms到30 ms,以10 ms连续递减,直到出现MAP电交替(ALT)。每个PCL持续30 s,然后休息30 s再进行下一次刺激。ALT定义为在连续10次搏动中MAP的振幅至少相差5%。90%动作电位持续时间(APD90)定义为至少6次连续MAP的平均90%复极化的时间。然后进行S1S2刺激,8个基础刺激(S1)后追加单个早搏刺激(S2),首先从S1S1150 ms,S1S2120 ms开始,S1S2从120 ms到60 ms,以10 ms连续递减,然后从60 ms到30 ms,以2ms连续递减。以S2脱落前S1S2最大时长记录为心室有效不应期(VERP)。最后,Burst刺激(50 Hz,脉冲2 ms,持续时间2 s),重复20次,每次间隔2 s,用于诱发心律失常。室性心律失常定义为持续2 s或更长时间的连续快速的心室收缩。每组随机选取8~9只小鼠进行电生理测定,每次进行电生理测定前,稳定灌流10 min,待心脏恢复到正常自发节律后开始进行电生理刺激,并用PowerLab分析系统分析测定APD90,以及记录电生理刺激后ALT、VERP、室性心律失常诱发情况。计算室性心律失常诱发率[Burst刺激诱发室性心动过速(简称室速)、心室颤动(简称室颤)持续时间≥2 s][11]。
2 结果
2.1四组体重、血脂、糖耐量、心功能的比较 四组小鼠基础体重(0周体重)无差异。WT-HFD组与WT-ND组相比和TG-HFD组与TG-ND组相比,WT-HFD组和TG-HFD组体重增长较快,从第12周开始体重明显增大。20周后,与WT-HFD组比较,TG-HFD组体重更大。TG-ND组与WT-ND组体重增长无差异,见表1。
WT-HFD组与WT-ND组相比和TG-HFD组与TG-ND组相比,WT-HFD组和TG-HFD组血清TC、TG、LDL较高。TG-ND组与WT-ND组相比,血脂指标无差异。但是TG-HFD与WT-HFD相比,血脂指标也无差异,见表2。
四组基础血糖值(0 min)无差异。WT-HFD组与WT-ND组相比和TG-HFD组和TG-ND组相比,WT-HFD组和TG-HFD组腹腔注射葡萄糖后15 min血糖值明显增高,与WT-HFD组相比,TG-HFD组腹腔注射葡萄糖后15 min血糖值明显降低。WT-ND组与TG-ND组相比,血糖值无差异,见表3。

表1 四组喂养期间体重变化/g
注:与WT-ND组比较,*P<0.05;与WT-HFD组比较,#P<0.05;与TG-ND组比较,△P<0.05
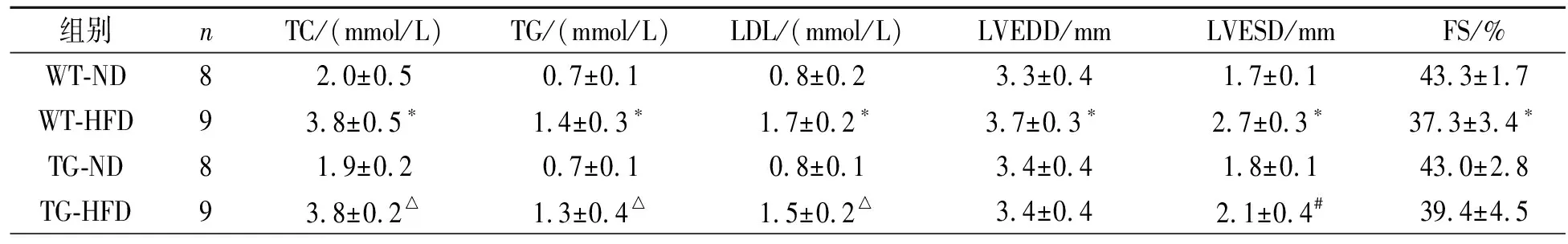
表2 四组血脂与心脏超声指标的比较
注:与WT-ND组比较,*P<0.05;与WT-HFD组比较,#P<0.05;与TG-ND组比较,△P<0.05

表3 四组血糖比较/(mg/dL)
注:与WT-ND组比较,*P<0.05;与WT-HFD组比较,#P<0.05;与TG-ND组比较,△P<0.05
与WT-ND组相比,WT-HFD组LVESD和LVEDD增大,以及LVFS减少。而TG-HFD组与WT-HFD组相比,TG-HFD组LVESD减小,LVEDD和LVFS无差异。WT-ND组与TG-ND组相比和TG-HFD组与TG-ND组相比,心脏超声指标均无差异,见表2。
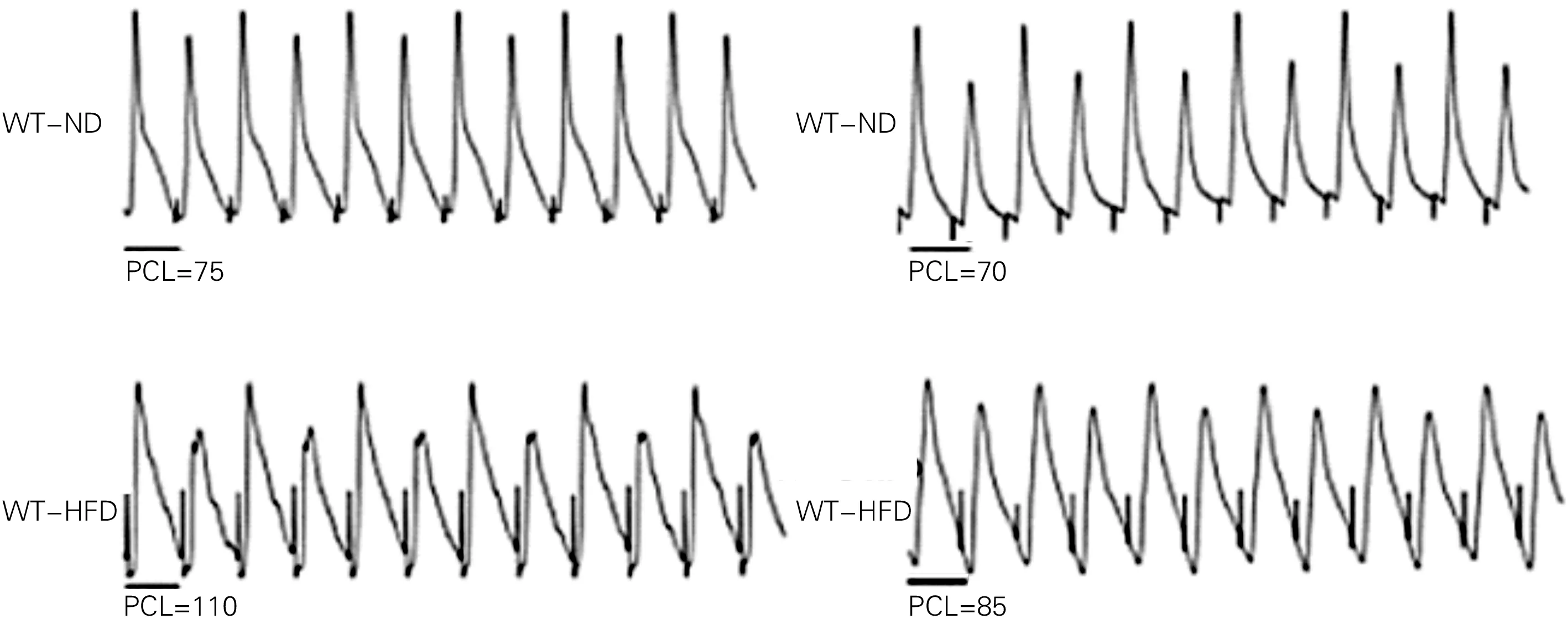
2.2四组心电图的比较 四组体表心电图RR间期、QT间期无差异。WT-HFD组与WT-ND组相比和TG-HFD组与TG-ND组相比,WT-HFD组和TG-HFD组的QTc间期明显延长,TG-ND组和WT-ND组的QTc间期无差异,而TG-HFD组与WT-HFD组相比较,QTc间期缩短,见表4、图2。
2.3四组MAP的比较 与WT-ND组相比较,WT-HFD组APD90明显延长,TG-HFD组与WT-HFD组相比较,APD90缩短。与WT-ND组相比较,WT-HFD组VERP缩短,TG-HFD组与WT-HFD组相比较,VERP有所延长。与WT-ND组相比较,WT-HFD组诱发电交替刺激的最大起搏周长延长,TG-HFD组与WT-HFD组相比较,诱发电交替刺激的最大起搏周长缩短。TG-ND组与WT-ND组相比和TG-HFD组与TG-ND组相比,心电指标无差异,见表4,图3、4。

四组体表心电图RR间期、QT间期无差异。WT-HFD组与WT-ND组相比和TG-HFD组与TG-ND组相比,WT-HFD组和TG-HFD组的QTc间期明显延长,TG-ND组和WT-ND组的QTc间期无差异,而TG-HFD组与WT-HFD组相比较,QTc间期缩短
图2四组Ⅱ导联体表心电图典型图
2.4四组Burst刺激诱发室性心律失常的比较 WT-ND组8只小鼠中,1只小鼠Burst刺激成功诱发室性心律失常; 而WT-HFD组9只小鼠中,6只小鼠Burst刺激成功诱发室性心律失常。TG-ND组8只小鼠中,1只小鼠Burst刺激成功诱发室性心律失常;TG-HFD组9只小鼠中,4只小鼠Burst刺激成功诱发室性心律失常。与WT-ND组相比,WT-HFD组室性心律失常的诱发率明显增加(6/9 vs 1/8,P<0.05),TG-HFD组与WT-HFD组相比,室性心律失常诱发率无明显差异(4/9 vs 6/9,P>0.05)。

表4 四组心电指标的比较/ms
注:与WT-ND组比较,*P<0.05;与WT-HFD组比较,#P<0.05;与TG-ND组比较,△P<0.05
与WT-ND组相比较,WT-HFD组诱发电交替刺激的最大起搏周长延长,TG-HFD组与WT-HFD组相比较,诱发电交替刺激的最大起搏周长缩短。TG-ND组与WT-ND组相比和TG-HFD组与TG-ND组相比,诱发电交替刺激的最大起搏周长无差异
图3四组MAP诱发电交替典型图

与WT-ND组相比较,WT-HFD组APD90明显延长,TG-HFD组与WT-HFD组相比较,APD90缩短。TG-ND组与WT-ND组相比和TG-HFD组与TG-ND组相比,APD90无差异
图4四组MAP典型图

WT-ND组和TG-ND组Burst刺激未诱发出室速、室颤, WT-HFD组和TG-HFD组Burst刺激诱发出室速、室颤
图5四组Burst刺激诱发室性心律失常典型图
3 讨论
高脂饮食诱导的代谢综合征是心血管疾病发展的重要危险因素[12]。通过给与60%脂肪含量的高脂饲料建立和模拟肥胖的实验模型,已经用于研究与肥胖相关的心血管疾病的发病机制[13]。本实验通过高脂饮食诱导小鼠肥胖模型,测定小鼠体重增长状况,以及糖耐量和血脂相关指标。结果显示四组小鼠基础体重无差异,通过高脂饮食喂养第12周后,WT-HFD组比WT-ND组体重增加明显,以及TG-HFD组比TG-ND组体重增加明显。而TG-ND组与WT-ND组体重增长无明显差异,说明MD1转基因对普通饮食小鼠体重变化无影响。有趣的是,在高脂喂养20周时,TG-HFD组体重高于WT-HFD组,可能与MD1过表达影响甘丙肽样肽(GALP)对炎症反应的调节功能[14],影响GALP对小鼠能量代谢的平衡[15],而引起小鼠体重增加。也可能由于高脂饮食时间过长而使WT-HFD组小鼠出现病态体重增长变缓,这些有待于我们后期深入探索。高脂饮食组小鼠血糖浓度较普食组高,糖耐量受损严重。WT-HFD组腹腔注射葡萄糖后15、60和120 min血糖值较WT-ND组和TG-HFD组高,说明高脂饮食导致小鼠糖代谢紊乱,而过表达MD1可以缓解高脂饮食诱导小鼠糖代谢紊乱。血清TC、TG、LDL等指标在高脂组中明显升高,但是WT-HFD组和TG-HFD组无差异,说明高脂饮食导致小鼠脂代谢的紊乱,而过表达MD1对高脂饮食诱导小鼠脂代谢紊乱没有影响。
众所周知,肥胖伴随着慢性低度炎症[16]。持续性的慢性炎症反应最终会导致体内平衡机制失调,导致有害组织重塑,从而引起整个身体器官永久性损伤。心肌组织慢性炎症反应可以引起心脏结构重塑,导致心肌细胞间的传导速度减慢,心肌细胞离子通道功能失调,表达降低而引起心脏电活动异常,增加发生心律失常的风险。本研究通过心脏特异性MD1转基因来阻滞心肌细胞TLR4炎症反应通路,降低高脂饮食诱导的肥胖引起的心脏慢性炎症反应,从而减缓心室肌的组织重构。研究已证实 TLR4介导的信号通路在肥胖诱发的心律失常中起重要作用。Zhong等[6]的研究表明高脂饮食诱导肥胖,引起心律失常的通路主要是通过炎症反应通路,激活TLR4/CAMKⅡ介导的一系列细胞信号转导通路,引起心肌细胞氧化应激反应,心肌细胞凋亡,以及心肌细胞功能失调。四组小鼠心脏超声指标LVEDD、LVFS无明显差异,说明高脂饮食对小鼠的心脏功能和心室结构重构影响不明显。然而通过心电生理指标,可以看出高脂饮食对心室电重构有影响,并且过表达MD1可以缓解高脂饮食对心室电重构的影响。在野生型小鼠中,我们观察到高脂饮食组比普通饮食组发生室性心律失常的风险增高。WT-HFD组与WT-ND组比较,VERP缩短,而单相动作电位APD90延长,增加发生室性心律失常的风险。同时WT-HFD组比WT-ND组诱发电交替的刺激频率更低,以及Burst刺激诱发室性心律失常的诱发率更高,说明高脂饮食增加了小鼠室性心律失常的发生风险。过表达MD1可以改善高脂饮食对心室电重构的影响, TG-HFD组与WT-HFD组相比,过表达MD1可以改善高脂饮食对VERP的缩短和APD90的延长,增加诱发电交替的刺激频率,说明MD1转基因组小鼠发生室性心律失常的风险降低。而在普通饮食状态下,MD1过表达的小鼠与野生型小鼠的体表心电图和MAP分析没有差异。高脂饮食诱导的肥胖增加发生室性心律失常的风险的机制,可能是通过体内发生的慢性炎症反应对心脏结构和心肌细胞电活动有影响,使小鼠发生室性心律失常的风险增高。通过心脏特异性MD1转基因,负性调节高脂饮食诱导肥胖小鼠心肌组织慢性炎症反应可以改善心室重构,对室性心律失常的发生有一定的保护作用。本研究为进一步研究肥胖和代谢综合引起心血管疾病提供了一条思路,并且有待进一步研究肥胖和代谢综合征导致心脏慢性炎症反应对心肌重构影响的机制。
