脂联素对心脏神经节丛的影响*
2020-03-11周振刘志豪杨晓萌赖燕秋王振亚周丽平孟冠南江洪
周振 刘志豪 杨晓萌 赖燕秋 王振亚 周丽平 孟冠南 江洪
心脏自主神经系统在心房颤动(简称房颤)的发生和发展中扮演重要角色[1-2],心脏神经节丛(GP)为内源性心脏自主神经系统的重要组成部分,由心房表面丰富的脂肪垫所包绕。临床研究显示心外膜脂肪体积与房颤的发生呈正相关[3],提示脂肪组织可能在房颤的发生发展过程中发挥重要作用。脂肪组织不仅能调节能量代谢,还能作为内分泌器官分泌多种脂肪因子[4]。近期研究发现,脂肪组织分泌的脂肪因子瘦素可激活心脏交感神经系统[5]。脂联素作为另外一种重要的脂肪因子,不仅能调节糖脂代谢水平,还可拮抗瘦素所致的交感神经激活[6]。已有研究表明,中枢脑室内注射脂联素能降低外周肾交感神经活性[7],但脂联素对心脏自主神经系统的作用尚不明确。笔者拟通过心脏神经节局部注射脂联素探究其对心脏自主神经节丛功能和活性的影响。
1 材料与方法
1.1实验动物准备及实验流程 本研究由武汉大学人民医院伦理委员会审核并批准,12只成年雄性比格犬(体重8~12 kg)由武汉大学人民医院实验动物中心提供。所有实验动物使用3%的戊巴比妥钠静脉全身麻醉后置于实验动物手术台,行气管插管,连接动物呼吸机(型号MAO01746,哈佛仪器,美国),麻醉初始剂量为30 mg/kg ,维持剂量为2 mg/kg。连接体表心电图,行股动脉、股静脉置管并进行心电、血压监测(Lead 7000系统,四川锦江电子科技有限公司),通过静脉途径以50~100 ml/L速度静脉滴注生理盐水以补充体液丢失。实验台使用加热垫,使比格犬体温维持在(36.5±1.5)℃。
12只成年雄性比格犬随机分为实验组(n=6)和对照组(n=6)。比格犬全身麻醉状态下,取左侧卧位经右侧第五肋间开胸暴露心脏右前神经节丛(ARGP),测定基础状态下ARGP功能和神经活性。其中,电压递增式高频电刺激ARGP引起心率下降的程度代表ARGP功能状态。使用微电极记录ARGP神经元放电频率和振幅以反映ARGP神经活性。测定完毕后,实验组将10μg脂联素溶于0.1 mL生理盐水后注射至ARGP,对照组注入等体积生理盐水。20 min后再次测量ARGP功能和神经活性。实验结束后留取ARGP组织行免疫荧光染色,观察ARGP神经元上脂联素受体1和脂联素受体2的表达情况。
1.2脂联素微注射 右侧开胸后,剪开心包,于右上肺静脉与右心房连接处确定ARGP脂肪垫位置(如图1所示)。取10 μg脂联素(Enzo Life Sciences公司,美国)溶于0.1 mL生理盐水,使用微量注射器(Hamilton公司,瑞士)将脂联素缓慢多点注射至ARGP。注射完成后,保持针头固定1 min,以避免脂联素溢出。既往文献[7]报道脑室内局部给予脂联素(最佳有效浓度为0.1 mg/mL)可降低肾交感神经活性,据此,脂联素的浓度选择为0.1 mg/mL。
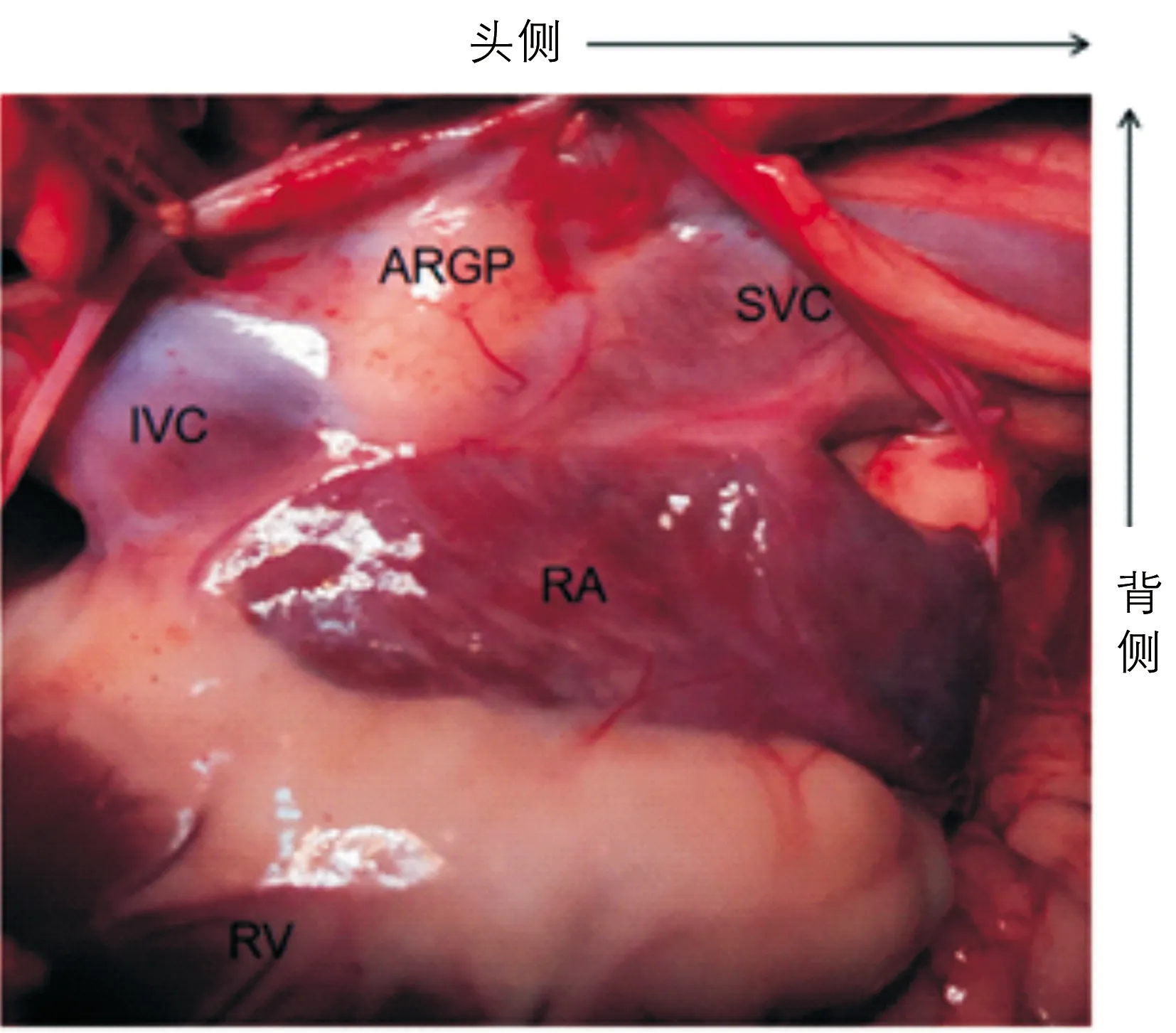
ARGP=右前神经节丛;RA=右房;RV=右室;SVC=上腔静脉;IVC=下腔静脉
图1比格犬心脏右前神经节丛(ARGP)解剖学位置
1.3ARGP功能测定 ARGP功能定义为递增式电压高频电刺激(HFS,20 Hz,脉宽0.1 ms)ARGP时引起窦性心率(SR)下降的程度[8]。经右侧第五肋间开胸暴露ARGP后,将直径0.1 mm的银丝电极插入ARGP脂肪垫,连接Grass刺激仪(AstroMed, West Warwick,美国)给予高频电刺激,刺激电压依次分别为2 V、3 V、4 V,通过电刺激确定ARGP最敏感部位,记录相同部位下不同电压刺激前后SR数值,并计算不同电压下ARGP刺激引起SR下降的百分比,绘制SR-电压反应曲线以反映ARGP功能。
1.4ARGP活性记录与测定 将2根直径0.1 mm的钨丝微电极用微型固定器并列固定,尖端插入ARGP脂肪垫以记录ARGP神经元放电。电极连接PowerLab神经活性记录仪(AD Instruments,澳大利亚),调整参数后记录稳定的神经元放电信号。神经活性信号定义为高于噪音振幅3倍及以上的神经元放电信号。在基础状态和注射生理盐水或脂联素20 min后,记录1 min神经元放电信号,并用LabChart软件分析神经元放电频率和振幅。
1.5免疫荧光染色 实验结束后,留取各组的ARGP组织标本,4%多聚甲醛固定,行石蜡包埋、切片并染色。采用苏木精-伊红染色(HE染色)法观察GP组织的显微结构,并对GP神经元进一步行免疫荧光染色以明确脂联素受体的表达情况。其中,抗脂联素受体 1和抗脂联素受体2(Abcam公司,剑桥,英国)分别用于单染脂联素受体1和脂联素受体2。
1.6统计学分析 所有数据用均数±标准差表示,运用GraphPad Prism 7.0软件进行分析与作图,先对所有计量数据进行Kolmogorov-Smirnov检验以明确是否符合正态分布。同组自身前后比较用配对t检验。以P<0.05为差异有显著性。
2 结果
实验过程中12只比格犬生命体征稳定,指标测定顺利。
2.1脂联素受体在ARGP神经元上的表达情况 免疫荧光染色可见脂联素受体1和脂联素受体2在ARGP神经元上均有表达,见图2。
2.2脂联素对ARGP功能的影响 与基础状态相比,实验组给予脂联素后各电压下HFS刺激ARGP诱导的SR减慢作用降低,见表1,根据刺激前后SR变化绘制SR-电压反应曲线。实验组给予脂联素可抑制曲线中各电压刺激下的SR降低程度。以电压强度为3V为例,基础状态下SR降低(43.3±5.1)%,给予脂联素后SR降低(30.9±5.1)%(与基础状态相比,P=0.02)。对照组给予生理盐水后对SR-电压反应曲线无明显影响,见图3。

A:脂联素受体1表达在GP神经元;B:脂联素受体2表达在ARGP神经元
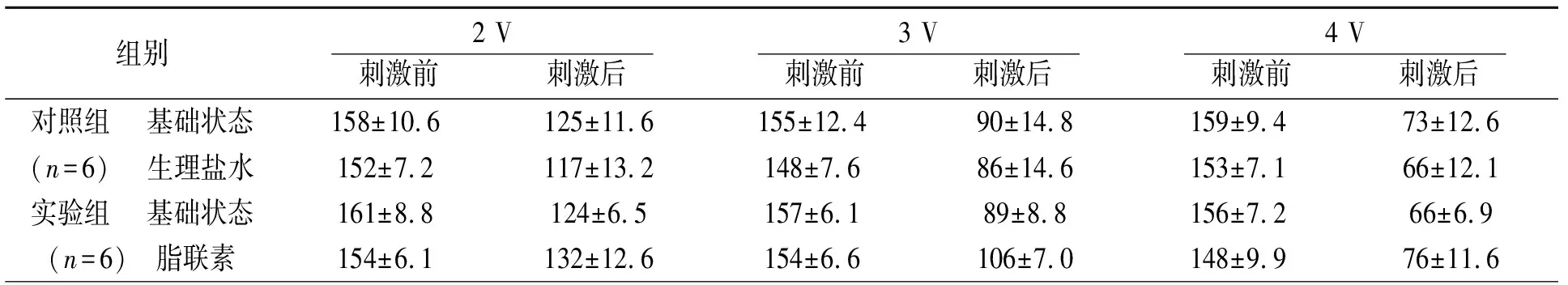
表1 两组干预前后心率变化/(次/分)

A:对照组ARGP的SR-电压反应曲线;B:实验组ARGP的SR-电压反应曲线。与基础状态相比,*P<0.05
2.3脂联素对ARGP神经活性的影响 与基础状态相比,实验组中给予脂联素后GP神经元放电频率和振幅均降低(P均<0.05),而对照组干预前后ARGP神经活性无显著差异(P均>0.05)。基础状态时,两组神经元放电频率和振幅无明显差异(P均>0.05),给予脂联素干预后,实验组神经元放电频率和振幅较对照组降低(P均<0.05),见图4、表2。

图4 两组分别给予生理盐水和脂联素干预后的典型神经元放电情况

表2 两组干预前后神经元放电频率和振幅变化
注:与同组基础状态比较,*P<0.05;与对照组生理盐水状态时比较,#P<0.05
3 讨论
Scherer等[9]于1995年首次发现脂联素,并证实其主要由脂肪细胞分泌,可参与胰岛素调节,发挥代谢调控作用;亦具有抗动脉粥样硬化、保护血管内皮,抗心肌缺血再灌注损伤、抗心肌纤维化等多种心脏保护作用[4]。临床研究显示血清脂联素水平降低与房颤的发生密切相关[10],且心外膜脂肪组织含量与房颤的发生呈正相关[3],提示脂肪组织和脂联素可能参与房颤的发生和发展过程。Hansen等[11]发现体内高脂联素水平对糖尿病患者心率变异性改变有益。本研究中,笔者发现脂联素局部注射至ARGP可降低ARGP功能和神经元放电频率及振幅,表明脂联素可在局部发挥作用,抑制心脏自主神经系统。既往研究显示心脏自主神经激活在房颤的发生发展中发挥重要作用,自主神经激活可通过缩短动作电位时程(APD)和细胞内钙(Cai)瞬变,引起早后除极(EAD)和触发活动,增加房颤的诱发率[1]。而脂联素可通过FoxO1信号降低小鼠交感神经系统活性,拮抗瘦素所致的交感激活,调节骨代谢与能量代谢[6]。在细胞水平,脂联素能通过钾电流的差异性调控进而调节大鼠自主神经中枢室旁核神经元的兴奋性[12]。本研究中,笔者通过免疫荧光证实脂联素受体在GP神经元上存在表达,因此推测脂联素发挥作用的机制可能为脂联素通过其受体及下游信号通路调控GP活性,也有可能直接作用于GP神经元上的离子通道,对神经元兴奋性进行直接调节,进而抑制心脏自主神经系统。
本研究显示了脂联素局部干预可抑制心脏自主神经,表明其可能具有抗房颤作用。既往研究显示口服脂联素受体激动剂(AdipoRon)可改善糖脂代谢水平,提示补充脂联素,如运动、噻唑烷二酮类降糖药[13]或激活脂联素受体可能降低房颤发生率,改善房颤患者预后。近年来Tanabe等[14]已研究出人类脂联素受体的晶体结构,据此结构,我们有望研发出相应的药物,为房颤治疗带来新选择。
