小鼠视神经损伤模型建立及重组人神经生长因子疗效评价
2020-03-10朱丹妮杨佳蕾吴诗坡李瑶陈旖张金龙宋小红侯利华
朱丹妮,杨佳蕾,吴诗坡,李瑶,陈旖,张金龙,宋小红,侯利华
1.军事医学研究院 生物工程研究所,北京 100071;
2.国家神经系统疾病临床医学研究中心,北京 100070
视神经源于视网膜的神经节细胞层,由视网膜神经节细胞的轴突汇集而成[1]。视神经是中枢神经系统的一部分,由于其解剖学上的特殊性,常被用于研究中枢神经的损伤和再生[2]。
视神经损伤(optic nerve crush,ONC)后,轴突难以自行再生[3],导致视功能出现不可逆的损失。ONC动物模型的建立有很多方式,包括横断损伤、牵拉损伤、挤压损伤、击打头部损伤等。视神经横断损伤模型是一种致伤量稳定的模型,但该模型将视神经完全切断,损伤严重,容易伤及眼动脉造成大出血,后续模型研究评价有一定局限性;牵拉法损伤模型手术步骤多、操作繁琐且创口较大;击打头部建立的损伤模式与临床损伤较为接近,但造模成功率低,实验动物的致死率较高。常用的视神经夹伤损伤模型有钳夹伤、球囊挤压伤和精细镊夹伤。钳夹伤可控性好,损伤明确,但不易精确定量,创口较大,适用于兔子和大鼠动物模型[4];球囊挤压伤易于操作但需要开颅,创伤较大,且致伤量不易控制[5];精细镊夹伤对实验动物的创伤较轻,神经髓鞘完整且创口较小。C57BL/6小鼠常被用做病理学的实验动物模型[6-7],选择精细镊挤压夹伤建立小鼠损伤模型,采用靠近角膜的结膜切口暴露视神经建模,可避开眼底静脉窦进行夹伤手术,减少手术出血,成本低且操作方便,易于大量开展研究工作。
神经生长因子(nerve growth factor,NGF)是第一个被发现的具有神经元营养和促轴突生长双重功能的神经营养蛋白家族成员,在中枢及周围神经系统形成、发育、正常功能维持和损伤后恢复中起至关重要的作用[8-11]。NGF对损伤中枢神经的保护作用主要包括增加自由基活性[12]、减少凋亡、促进神经元细胞和神经纤维的存活[13-14]、调节钙通道稳定细胞内Ca2+水平[15]等。与鼠源NGF不同,重组人神经生长因子(recombinant human NGF,rhNGF)利用中国仓鼠卵巢(chinese hamster ovary,CHO)细胞系统表达制备[16],生产模式不受动物原料限制,不存在异源蛋白污染[17]。用rhNGF滴眼液治疗ONC的保护效果尚有待建立动物模型予以评价。
1 材料与方法
1.1 材料
6~8周雄性C57BL/6小鼠购自斯贝福(北京)生物技术有限公司;rhNGF由本实验室制备;Triton X-100购自Sigma公司;DAPI Fluoromount-G购自Southern Biotech公司;Anti-RBPMS Antibody购自Millipore公司;Goat anti-Rabbit IgG(H+L) ALEXA FLUOR Plus 594购自Invitrogen公司;杜蒙5号镊(11251-30,F.S.T);显微器械(六六视觉);体视显微镜(Leica,M80);小动物麻醉机(瑞沃德,R540IP);荧光显微镜(BioTek,CYTATION1)。
1.2 建立ONC模型
小鼠用麻醉机诱导麻醉,固定在麻醉面罩手术板上,0.9%氯化钠注射液清洗双眼。在近眼尾侧下方眼睑位置剪开球结膜,用显微眼用镊钝性分离结膜暴露视神经。用杜蒙5号镊在眼球后2 mm处垂直视神经夹持视神经5 s,右眼不做处理。夹伤后将切开的球结膜复位,观察术后情况:左眼瞳孔散大而右眼瞳孔对光反射正常,双眼眼底无出血血供恢复正常,涂抹红霉素眼膏预防感染。
将14只雄性C57BL/6小鼠随机均分为夹伤5 s组和夹伤10 s组,观察不同夹伤时长对模型小鼠视网膜神经节细胞(retinal ganglion cells,RGCs)存活的影响。
将30只雄性C57BL/6小鼠随机均分为5组,即正常组和夹伤后第7、14、21、28 d组,观察各时间点RGCs的存活率。
整个损伤过程由同一人完成,以保证夹伤视神经的方向和力度的一致性。
1.3 rhNGF滴眼液给药
将8只雄性C57BL/6小鼠随机均分为2组,即夹伤后损伤眼滴0.9%氯化钠注射液(对照组)或90 μg/mL rhNGF(治疗组),夹伤后第14 d取视网膜计数RGCs,计算存活率。从术后第2 d开始每天早晚2次滴眼给药,连续给药13 d,所有视神经损伤小鼠麻醉机麻醉后进行左眼滴眼液给药,5 μL滴眼液给药后小鼠迅速放回笼内并观察小鼠苏醒后的状态。
1.4 取材
小鼠腹腔注射水合氯醛麻醉,暴露心脏,经左心室注射0.9%氯化钠注射液、4%多聚甲醛固定,在体视显微镜下将眼球剪下浸泡在4%多聚甲醛固定液中固定。
1.5 视网膜铺片和封片计数
眼球在4%多聚甲醛中固定后,PBS清洗,在体视显微镜下将视网膜从眼球上分离,将视网膜分成鼻侧、颞侧、腹侧、背侧4个象限。将多重剪接RNA结合蛋白(RNA binding protein with multiple splicing,RBPMS)稀释后,于4℃孵育视网膜过夜;PBS洗涤后免疫荧光二抗避光室温孵育2 h,加入DAPI Fluoromount-G封片。荧光显微镜下,沿每一象限的中线,距视盘凹陷处0.5、1、1.5 mm处各选一区域,4个象限分别采图,每张视网膜各采图12张。用Photoshop软件为每张图片画定 0.09 mm2(0.3 mm×0.3 mm)的计数区,用 Image J软件对每个计数区进行节细胞计数[18]。
1.6 统计学分析
用GraphPad Prism软件进行制图和数据分析,数据以x±s表示。2组间比较采用t检验,多组间比较采用方差分析法(One Way ANOVA),P<0.05为具有统计学差异,P<0.01为具有统计学显著差异。
2 结果
2.1 小鼠ONC模型的建立与评价
2.1.1 正常小鼠视网膜RGCs的分布 小鼠整个视网膜免疫荧光检测可观察到其整体形态。小鼠RGCs分布在整个视网膜的神经节细胞层中,RBPMS铺染结果显示RGCs分布均匀且呈放射状排列,视网膜血管呈网状分布于视网膜中,血管处无RBPMS阳性细胞分布(图1)。整个视网膜铺染结果与文献报道一致[19],荧光显微镜下可观察到视网膜视盘中心区域RBPMS阳性细胞分布密集,视网膜边缘RBPMS阳性细胞分布较稀疏。
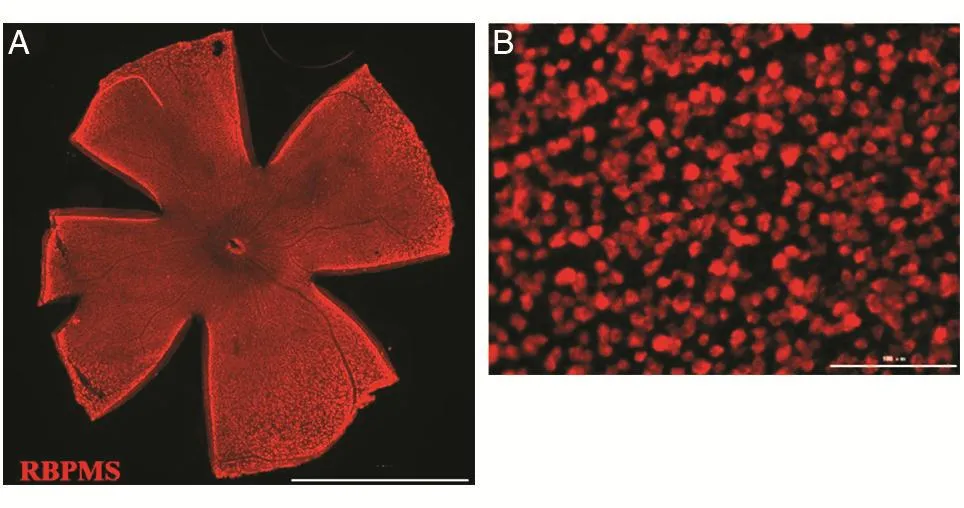
图1 正常小鼠视网膜铺染
2.1.2 ONC小鼠视网膜RGCs评价 夹伤5 s组和夹伤10 s组在损伤后第7 d的RGCs数量有统计学差异(P=0.0173),5 s组的RGCs数量显著高于10 s组(图2)。夹伤5 s组小鼠血供正常且晶体未见浑浊,夹伤10 s组有2只小鼠眼球萎缩至正常小鼠的2/3大小且晶状体浑浊,可能是夹伤时间太长导致眼动脉损伤[20],视网膜血供不足缺乏营养从而导致随后的萎缩,视网膜上出现絮状异物,RBPMS铺染无法进行。夹伤5 s组小鼠血供正常,晶体未见浑浊,故选择夹伤时间为5 s进行后续实验。

图2 不同夹伤时间组小鼠视网膜铺染及细胞计数
损伤后第7、14、21、28 d,以正常组RGCs数目作为对照,计数结果显示损伤后各时间点RGCs差异有统计学意义(F=962.5,P<0.0001)。任意2组间采用Tukey法比较,损伤后第7、14、21、28 d组小鼠视网膜中RGCs数目均明显低于正常组(图3),差异均有统计学意义(P<0.0001);损伤后第21 d组和损伤后第28 d组小鼠视网膜RGCs数目比较差异均无统计学意义(P=0.13)。视神经夹伤后第7、14、21、28 d的RGCs存活率分别为50.38%、23.12%、18.02%、14.53%(图3),提示在没有治疗干预情况下,ONC后小鼠RGCs存活率持续下降。

图3 不同观察时间点小鼠视网膜铺染及细胞计数
2.2 rhNGF滴眼液治疗ONC的初步评价
ONC模型建立后,给予小鼠患侧眼睛rhNGF滴眼液(治疗组)或0.9%氯化钠注射液滴眼液(对照组)滴眼。ONC后第14 d小鼠视网膜RGCs计数结果提示,治疗组与对照组的差异具有显著统计学意义(P=0.009),治疗组RGCs数目相较于对照组多26.8%(图4),提示rhNGF滴眼液能够对夹伤后的视神经提供一定的保护作用,提高RGCs的存活率。

图4 治疗组与对照组小鼠视网膜铺染及细胞计数
3 讨论
视神经纤维受到的机械压迫阻碍了轴浆运输,从而导致细胞代谢受损,视神经纤维失去营养及周围组织的保护而发生进一步损害,导致视神经无法修复[20]。视神经损伤后RGCs凋亡是造成视功能不可逆损害的根本原因。通过挤压夹伤法可以模拟机械压迫建立小鼠视神经损伤模型,并通过RGCs数目变化对模型进行评价。
文献中对视神经的夹伤时间有不同的选择。Li等[21]使用杜蒙5号镊选择在视盘后面大约1 mm处挤压5 s;Wang等[22]用杜蒙5号细镊在视盘后约1 mm处挤压5 s;Moore等[23]用杜蒙5号镊在眼后1 mm处压碎神经10 s。本研究中分别做了夹伤5 s和夹伤10 s的对比实验。夹伤10 s组有2只小鼠眼球萎缩且晶状体浑浊,视网膜上出现絮状异物,RBPMS铺染无法进行,夹伤5 s组小鼠血供正常晶体未见浑浊,故选择夹伤时间为5 s进行后续实验。
本研究采用RBPMS作为RGCs计数的标志。RBPMS是RNA结合蛋白家族成员,主要定位于RGCs的细胞核和细胞质中,是哺乳动物RGCs的选择性标记物[24]。研究表明,RBPMS优于其他识别RGCs的标志物,包括细胞骨架、核蛋白及神经活性肽等,主要原因是在视网膜40个RGCs亚群中RBPMS均高度表达[19]。将视神经夹伤后,轴浆运输受阻导致RGCs存活率随时间减少,损伤后第28 d仅剩14%的RGCs存活,证明损伤模型建立成功。
意大利Dompé Farmaceutici S.p.A.公司开发了在大肠杆菌中生产的rhNGF局部制剂,可用于眼部疾病[25]。Di Zazzo等[26]的研究证实该rhNGF滴眼液治疗后,神经营养性角膜病变患者的角膜敏感性得到改善,8周后实现了完全的角膜愈合。Sacchetti等[27]证实rhNGF可通过抑制凋亡来促进色素性视网膜炎大鼠视网膜总感光细胞存活。在视神经损伤方面,临床前研究的大鼠模型实验数据显示,高浓度 rhNGF(180、540 μg/mL)对视神经夹伤损伤具有一定的修复作用,损伤14 d后,给药组相较于空白对照组RGCs多50%左右,但2个浓度间RGCs没有差异[28]。同时,rhNGF治疗神经营养性角膜炎的临床研究显示,高剂量给药组临床患者的不良反应较重,主要表现为眼部疼痛及睑炎[29]。目前,较低浓度的rhNGF对小鼠模型的视神经损伤修复作用未见报道。原核系统表达的rhNGF比活性低,真核表达系统可克服错误折叠的问题,蛋白比活性和稳定性较好。因此,我们使用ONC模型初步评价了CHO细胞来源的rhNGF滴眼液对挤压损伤后的视神经损伤小鼠的治疗效果,结果显示给药13 d后,90 μg/mL rhNGF治疗组的RGCs数目显著高于对照组,提示外源性给予rhNGF可以提高小鼠RGCs存活率,发挥保护性作用。
综上所述,本实验用C57BL/6小鼠建立了视神经夹伤损伤模型,具有操作便捷、创伤较轻、重复性好的特点,并基于此初步评价了rhNGF滴眼液治疗ONC的保护作用,为进一步探讨rhNGF治疗机制及药效评价奠定了基础。
