狭叶黄芩组织培养再生体系的建立
2020-03-10范卫芳高鹏飞吴建慧
张 静 牛 喆 范卫芳 高鹏飞 吴建慧
(东北林业大学园林学院,哈尔滨 150040)
东北地区地理环境特殊,能够在东北露地越冬的植物种类较少。狭叶黄芩(Scutellariaregeliana)是唇形科(Labiatae)黄芩属(Scutellaria)多年生草本植物,自然分布在东北地区,是一种优良的野生观赏植物,可作为地被植物在园林中应用。近几年这类野生植物逐渐进入城市园林应用,是园林绿化的优良材料之一,具有很高的观赏价值。黄芩属的植物生长缓慢,在自然生长条件下远不能满足市场的需求。其虽以种子繁殖为主,但在干旱及其他不良环境下,出苗率难以控制在较高的水平;扦插繁殖易受扦插季节和插条部位等因素的影响;而分根繁殖则繁殖系数低;不利于大面积的应用[1]。
近年来,关于黄芩属植物组织培养技术的报道已有一些。日本学者最早在LS培养基上接种黄芩(Scutellariabaicalensis)节段,并得到了淡褐色的愈伤组织[2]。国内学者在进行诱导黄芩愈伤组织试验研究时,成功诱导出黄芩愈伤组织[3]。以黄芩的子叶、真叶和下胚轴为外植体,吴晓玲等[4]对黄芩组织培养诱导条件进行试验研究,并确定了褐化率为0,诱导率高达100%的培养基。李富雄等[5]利用组培技术进行黄芩同源四倍体诱导,为将来选育有用成分含量高的优良品种打下基础。以带腋芽的粘毛黄芩(Scutellariaviscidula)幼茎为外植体,王淑芳等[6]通过对植物激素配比及使用浓度的比较选择,建立出一套高效的粘毛黄芩的组培快繁体系。薛欣等[7]通过试验进行黄芩无菌材料的培养并且优化黄芩快繁技术,确定黄芩继代和快繁的最佳方法是采用单节培养。韩淑兰等[8]研究发现结果与其大致相同。近年来狭叶黄芩因其花色美丽,具有较高的观赏价值在园林中逐渐开始应用,但狭叶黄芩以种子繁殖的方法耗时较长,短时间内无法满足应用,同时也未见关于狭叶黄芩组培方向的报道,所以本研究以黄芩属中的狭叶黄芩茎段作为外植体,筛选出适合各阶段的培养基配方,建立其组培快繁体系。为有效实现黄芩属资源的开发利用和保护提供一定能够的理论基础。
1 材料与方法
1.1 试验材料
试验材料取自黑龙江省森林植物园的野生狭叶黄芩,2017年9月栽植到100 mm×90 mm的花盆中,将其放在植物培养室中进行缓苗,给予正常的水分和光照管理,待植株恢复生长后,选取其当年生带节茎段作为供试材料进行试验。所用培养基每1 L均添加蔗糖25 g、琼脂7.5~7.8 g、pH值调为5.8~6.0。培养室温度为(25±1)℃,空气相对湿度保持在50%~60%,光照强度为2 000 lx,光周期为16 h·d-1。
1.2 试验方法
1.2.1 外植体的处理与消毒
于晴朗的上午剪取健壮且无病害的当年生枝条的嫩茎,将茎段表面清洗干净,然后将茎段剪成1~2 cm的长度,使用洗洁精对茎段进行清洗,清洗3 min后流水下冲洗30 min。于超净工作台中无菌水清洗3遍,75%酒精清洗15 s后再用无菌水冲洗3~5遍,然后在0.1%的HgCl2或者1% NaClO溶液中浸泡3、5、8、11 min进行消毒,最后使用无菌水冲洗5遍。然后将茎段接种于MS培养基上。每处理接种30个茎段,每瓶接种一个,3次重复。20 d后统计不同消毒时间的污染率、褐化率和存活率。
1.2.2 茎段腋芽的诱导
1.2.3 茎段愈伤组织的诱导
将消毒处理后的狭叶黄芩的茎段接种于愈伤组织诱导培养基上,添加6-BA(0.5、1、2 mg·L-1),2-4D(0.5、1 mg·L-1)、NAA(0.05、0.1、0.2、0.5 mg·L-1)和TDZ(0.05、0.1 mg·L-1)的组合。以期筛选出茎段最适诱导愈伤的激素配比组合。每处理接种30个外植体,3次重复。30 d后统计愈伤组织诱导率并记录生长状况。
1.2.4 愈伤组织不定芽的分化
以MS为基本培养基作为狭叶黄芩愈伤组织分化培养基,添加6-BA(0.5、1、2 mg·L-1)和NAA(0.1、0.2、0.5、1 mg·L-1)诱导愈伤组织块进行分化。每种处理30个愈伤组织块,3次重复。30 d后观察统计不定芽分化率及平均不定芽数。
1.2.5 腋芽的增殖培养
腋芽增殖培养基和上述9种诱导腋芽的培养基组合相同。后期愈伤组织分化而来的不定芽增殖培养也使用此培养基。比较两种激素组合对芽增殖的差别影响。每种处理30个外植体,3次重复。30 d后统计增殖芽数,计算增殖倍数。
1.2.6 腋芽生根的诱导
根据系统需求,滤波器性能指标如表1所示,可以看到系统对滤波器的远端抑制(≥25 dB@5.95~10 GHz)要求较高。
将生长健壮,高度为2~3 cm的具有2对新叶的不定芽接种到生根培养基上,以1/2MS为基本培养基,添加不同浓度的NAA(0.1、0.2、0.3 mg·L-1)或IBA(0.1、0.2、0.3 mg·L-1)组合,以期取得最适宜的生根效果。每个处理30瓶,每瓶1株,重复3次,定期观察狭叶黄芩生根情况并记录生长状况。接种20 d后统计生根率、平均生根数、平均根长。
1.2.7 组培苗的炼苗与移栽
为提高组培苗的成活率并使其能在自然环境下正常生长,需在移栽前进行炼苗处理。将高度为4~5 cm并且根长超过2 cm的试管苗打开瓶盖,倒入清水。将开盖后的组培苗在组培架上1 d,再移到室温条件下放2 d,取出后用蒸馏水小心冲洗根上残留的培养基。然后把冲洗干净的生根组培苗移栽到基质中,放置在背阴处3d后转入植物培养室,在此期间给予正常的水分和光照管理。30 d后统计移栽成活率及幼苗生长情况。
1.3 数据统计与分析方法
采用SPSS22.0统计软件进行方差分析和显著性分析,采用Excel 2007计算测定数据和图表制作,数据均为3次重复试验的平均值。
2 结果与分析
2.1 茎段不同消毒方法的筛选
由表1可知,消毒时间分别为3、5、8、11 min时,使用两种消毒剂处理的褐化率均为0,即无论采用哪种消毒方法,外植体都没有褐化现象。1% NaClO在消毒处理时间为5 min时效果最好,污染率最低为13.05%,存活率最高为86.95%,与1% NaClO处理的其他时间差异显著(P<0.05)。0.1%的HgCl2消毒处理最佳时间也是5 min,其污染率最低为8.25%,存活率为91.75%,与0.1%的HgCl2消毒处理的3、11 min差异显著。狭叶黄芩茎段消毒最好的方法是0.1%的HgCl2消毒5 min。
2.2 茎段腋芽的诱导
将狭叶黄芩茎段接种到腋芽诱导的培养基上,一周后腋芽开始萌发。由表2可知,当6-BA浓度为0.5 mg·L-1时,腋芽诱导率和平均腋芽数随着NAA浓度的升高而逐渐降低,但变化趋势并不显著,说明此时NAA浓度的变化对于腋芽的生长变化不大。当NAA浓度分别为1、2 mg·L-1时,随着6-BA浓度的升高,腋芽诱导率和平均腋芽数也随之升高。在所有处理组中,8号处理组腋芽诱导率最高为79.12%,平均腋芽数也最高为1.49个,但此时外植体生长较慢。当6-BA浓度较低(0.5 mg·L-1)或较高(2 mg·L-1)时,植物生长状况不良,表现为叶片泛黄,生长变慢。而在6-BA浓度为1 mg·L-1时,植物生长良好(图1A)。确定最适宜狭叶黄芩茎段腋芽萌发的培养基为MS+1 mg·L-16-BA+1 mg·L-1NAA。
表1 不同消毒方法对狭叶黄芩茎段消毒效果的影响
Table 1 Effect of different disinfection methods on disinfection effect forS.regelianastem segments
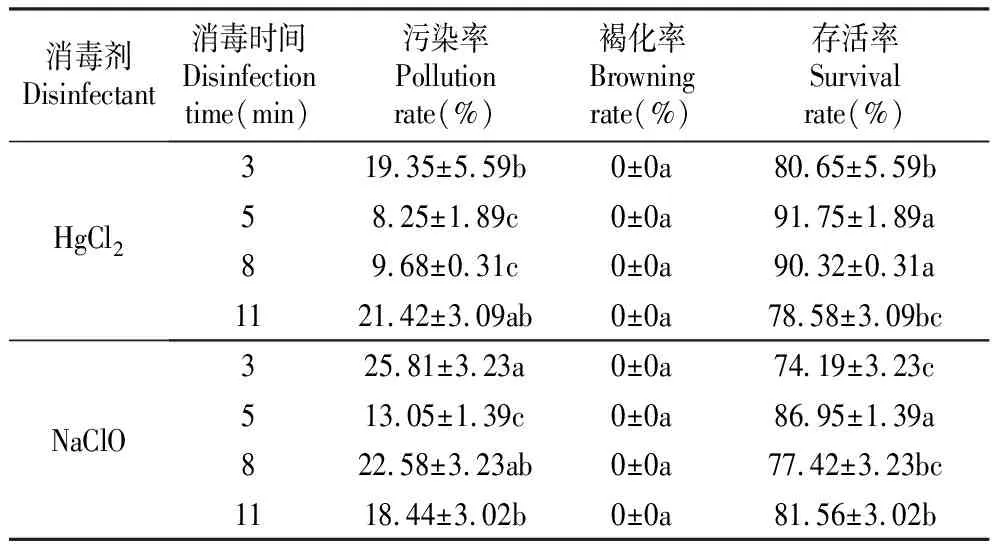
消毒剂Disinfectant消毒时间Disinfection time(min)污染率Pollution rate(%)褐化率Browning rate(%)存活率Survival rate(%)HgCl2319.35±5.59b0±0a80.65±5.59b58.25±1.89c0±0a91.75±1.89a89.68±0.31c0±0a90.32±0.31a1121.42±3.09ab0±0a78.58±3.09bcNaClO325.81±3.23a0±0a74.19±3.23c513.05±1.39c0±0a86.95±1.39a822.58±3.23ab0±0a77.42±3.23bc1118.44±3.02b0±0a81.56±3.02b
注:表中每列的值是平均值±标准差;同列数据后不同小写字母表示在0.05水平上差异显著(P<0.05);下表同。
Note:Values represent as Mean±SE;After the same column data, different lower-case letters showed significant difference at 0.05 level(P<0.05);The same as below.

表2 不同激素配比对狭叶黄芩茎段诱导腋芽的影响
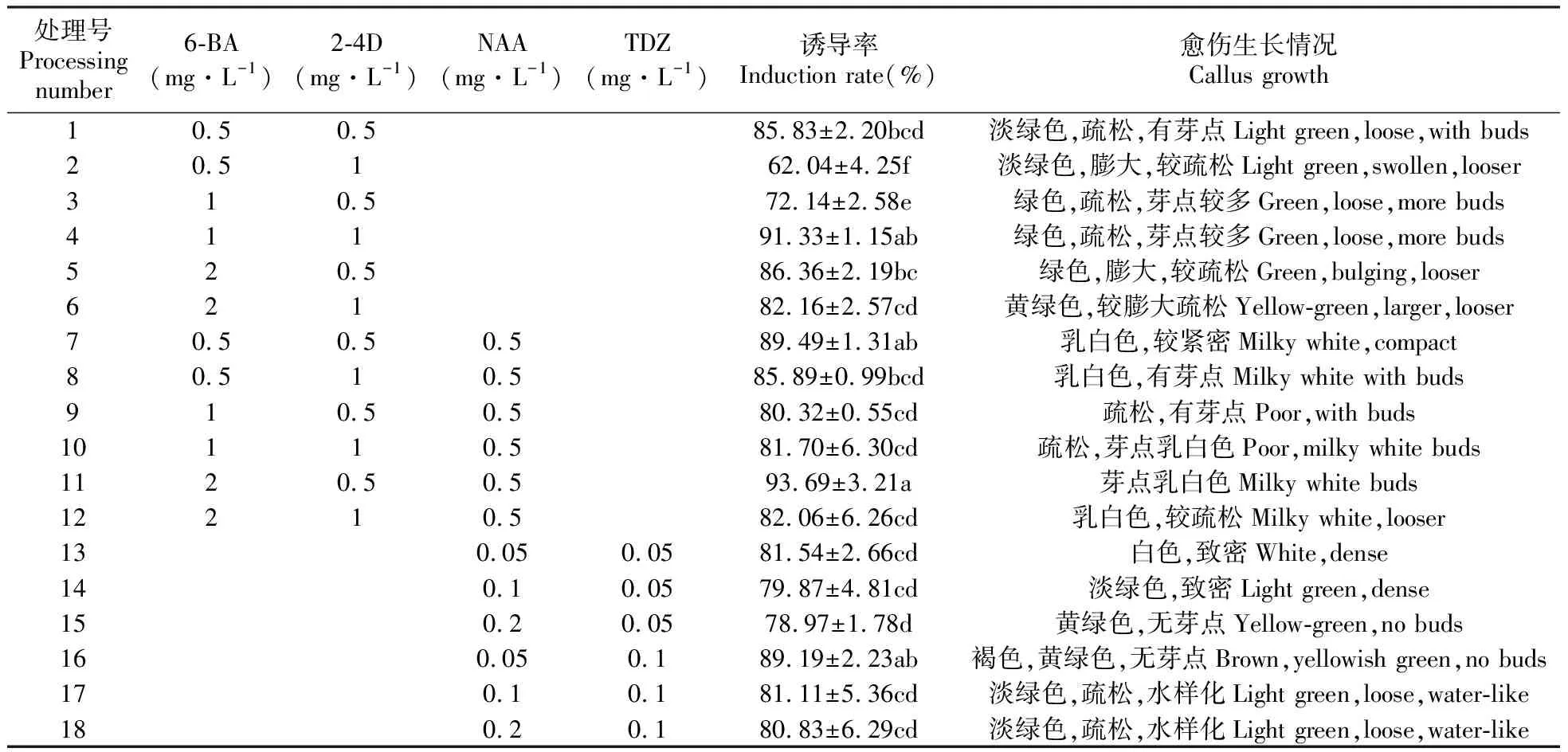
表3 不同激素配比对狭叶黄芩愈伤组织诱导率的影响
2.3 茎段愈伤组织的诱导
由表3的数据可知,在只含有6-BA和2-4D的培养基中,4号处理组的诱导率最高为91.33%,与2、3、6号均有显著差异(P<0.05),此时的愈伤绿色、疏松、芽点较多(图1B)。在添加6-BA、2-4D和NAA的各处理组中,愈伤的诱导率均在80%以上,但此时的愈伤生长表现为白色致密,不利于愈伤的后期分化。而在添加TDZ和NAA的培养基上,在TDZ浓度不变时,愈伤诱导率随着NAA浓度的升高而逐渐降低,且各处理组的愈伤生长状态不良,甚至有褐化和水样化的现象发生。确定狭叶黄芩诱导愈伤的最佳培养基为MS+1 mg·L-16-BA+1 mg·L-12-4D。
2.4 茎段愈伤组织的分化
将愈伤组织接种到分化培养基上,由表4可以看出,在6-BA浓度为0.5 mg·L-1,分化率最高的是3号处理组,其分化率为20.17%,与其他各组差异显著(P<0.05)。在6-BA浓度为1 mg·L-1,分化率最高的是7号处理组,其分化率为44.71%,与其他各组差异显著(图1C)。在NAA浓度为1 mg·L-1,愈伤组织的分化率随着6-BA浓度的升高而增加,且与其他各组差异显著。其中褐化率最低的是5号处理组为11.6%,最高的是10号处理组为28.56%,平均不定芽数最多的是6.33个,为7号处理组。确定愈伤组织分化的最佳培养基为MS+1 mg·L-16-BA+0.5 mg·L-1NAA。
2.5 腋芽的增殖培养
将狭叶黄芩茎段诱导而来的腋芽接种到增殖培养基上,10天后丛生芽开始萌发。由表5可知,不同处理组间增殖倍数差异显著(P<0.05)。1号处理组的增殖倍数最低为1.3,4号处理组的增殖倍数最高为5.859(图1D),当6-BA浓度分别为1、2 mg·L-1时,芽增殖倍数随着NAA浓度的升高而降低且差异显著。当6-BA浓度较高(2 mg·L-1)时,新芽虽然多但叶片变黄。确定芽增殖的最佳培养基为MS+1 mg·L-16-BA+0.5 mg·L-1NAA。
2.6 腋芽生根的诱导
不定芽的高度达到1~2 cm时将外植体转入生根培养基中。以1/2MS培养基为基本培养基,在培养7天后逐渐有新根产生。由表6可以看出,在只添加IBA的处理组中,随着IBA浓度的增加,其生根率整体呈下降趋势,其中IBA浓度为0.2 mg·L-1时生根率最高为74.07%,且与其他各组差异显著(0.1 mg·L-1除外)(图1E,F)。在只添加NAA的各处理组中,9号处理组生根率最高为45.98%,且与其他各处理组差异显著(P<0.05)。当IBA或NAA浓度高于0.3 mg·L-1时对生根率、平均生根数、平均根长产生了一定的不良影响,表现为抑制植物根的生长。在所有的处理组中,8号处理组的平均生根数最高为17.69个,4号处理组的平均根长最长为3.61 cm。确定茎段生根的最佳培养基为1/2MS+0.2 mg·L-1IBA。

表4 不同激素配比对狭叶黄芩愈伤组织分化影响

表5 不同激素配比对狭叶黄芩芽增殖的影响
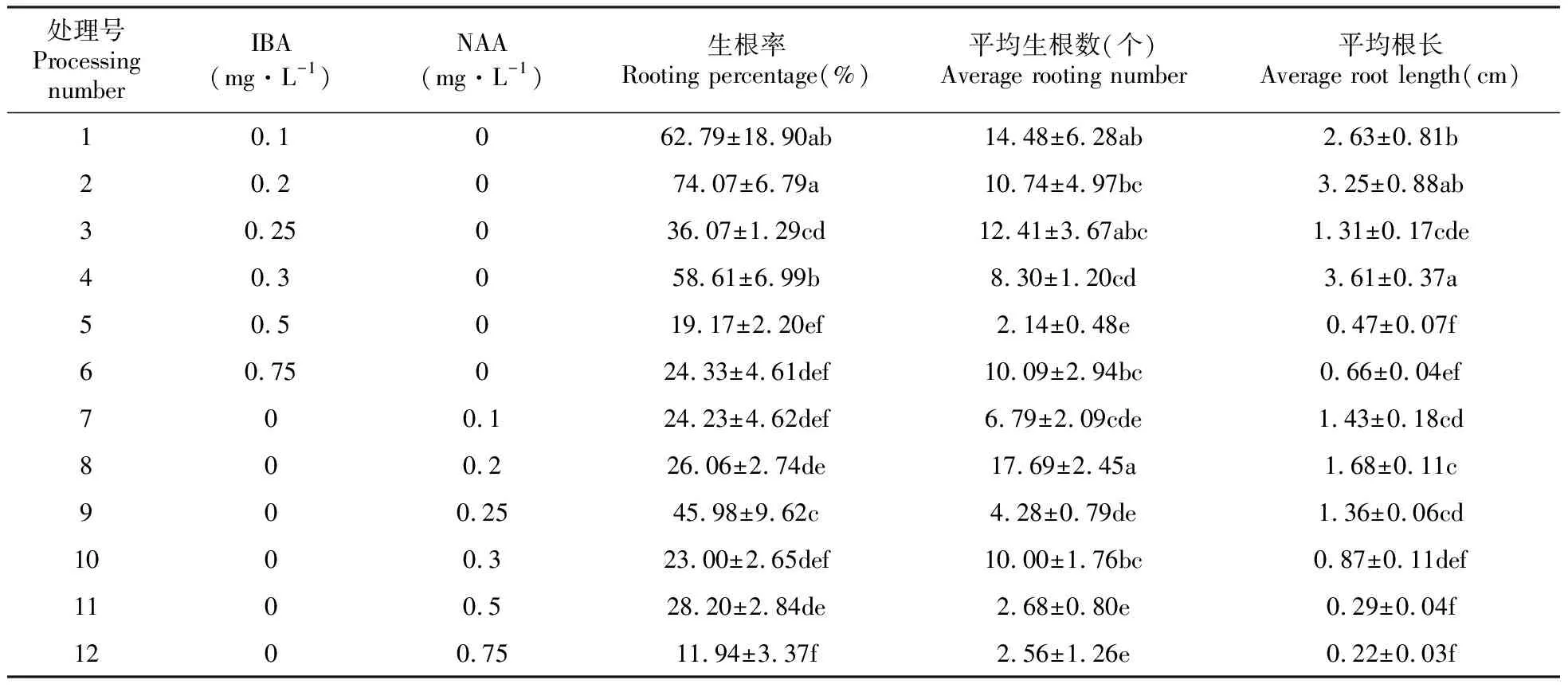
表6 不同激素配比对狭叶黄芩不定芽生根的影响

图1 狭叶黄芩带芽茎段再生体系的各培养阶段 A.茎段诱导腋芽;B.茎段诱导愈伤组织;C.愈伤组织分化不定芽;D.带芽茎段增殖;E.生根3 d;F.生根15 d;G.组培苗移栽7 d;H.组培苗移栽30 dFig.1 Different culture phases of budded stem regeneration system of S.regeliana A. Stem segment induces axillary buds; B. Callus induced by stem segments; C. Callus differentiation adventitious bud; D. Proliferation of shoot segments with buds; E. Rooting for 3 d; F. Rooting for 15 d; G. Tissue culture seedlings were transplanted for 7 d; H. Tissue culture seedlings were transplanted for 30 d
2.7 炼苗和移栽
蛭石、珍珠岩,园土的比例不同,对狭叶黄芩移栽成活率有显著的影响。由表7可知,栽植到三种基质下,植物的生长状况均为良好,但移栽成活率差异显著(P<0.05),其中3号即蛭石∶珍珠岩∶园土=1∶1∶3时,移栽成活率最高为79.24%(图1G,H)。
表7 不同移栽基质对狭叶黄芩移栽成活率的影响
Table 7 Effect of different medium on bud induction forS.regeliana

处理号Processing number移栽成活率Survival rate of transplantation(%)生长状况Growth status174.31±3.76b植株健壮,生长良好The plants are strong and grow well260.33±4.51c植株健壮,生长良好The plants are strong and grow well379.24±6.17a植株健壮,生长良好The plants are strong and grow well
3 讨论
外植体的表面灭菌是组培中防治污染至关重要的一步[9]。对消毒剂要求易冲洗、易分解,清除微生物又不影响植物材料生长。不同植物不同部位的外植体对消毒剂的敏感程度不同[10]。因此消毒剂的种类、浓度和时间的选择至关重要[11]。过长过短的消毒时间都不利于植物生长,恰当的消毒时间能提高存活率。在植物组织培养过程中,常用的消毒剂有NaClO,H2O2、HgCl2、AgNO3等。本研究选择1% NaClO和0.1% HgCl2作为消毒剂,发现狭叶黄芩茎段最适宜的消毒方法为0.1% HgCl2消毒5 min。
组织培养中,外植体直接诱导芽是较快捷的方式。本研究表明,狭叶黄芩茎段在2种激素组合上都诱导出腋芽,但平均腋芽数、腋芽诱导率以及芽生长状况均有差异。并且同时使用6-BA与NAA诱导腋芽的影响效果显著,诱导率随着6-BA浓度的升高而升高,随着NAA浓度的升高呈先升高后下降趋势。植物激素是培养基中的关键物质,用量虽少但对愈伤组织的诱导和分化起着重要的调节作用[12~13]。在一定范围内,植物激素浓度升高,对植物的促进作用增强,超过这一范围浓度再升高,就会抑制植物生长[14]。同时多种激素协同作用效果要远大于一种激素单独使用效果[15]。
其作用效果与外植体及愈伤组织本身内源激素的种类和浓度有重要关系[16]。有研究发现2-4D,KT,NAA等植物激素配比使用有利于外植体愈伤组织的形成,且NAA浓度越高,形成的愈伤组织质地越好[17]。但在本试验中,在添加6-BA、2-4D和NAA的组合中,狭叶黄芩茎段诱导而来的愈伤组织质地坚硬,不利于后期分化培养,这与前人的研究结果不一致。在添加TDZ和NAA的组合中,愈伤组织有褐化和水样化的趋势,而张璐[18]等对宜昌百合的研究中发现,诱导愈伤组织的3种激素中,作用关系最大的是TDZ,其次是2-4D,最后是NAA。在含有6-BA和2-4D的培养基中,愈伤生长良好,愈伤组织的诱导率也最高为91.33%,而贺美忠对黄芩的研究中发现,当使用1 mg·L-1的6-BA和0.5 mg·L-1NAA时愈伤组织的诱导率达到最大值[1]。愈伤组织分化阶段,在NAA浓度为1 mg·L-1,愈伤组织的分化率随着6-BA浓度的升高而增加。所有处理组中褐化率最低的为11.6%,平均不定芽数最多的是6.33个。在6-BA浓度为1 mg·L-1,NAA浓度为0.5 mg·L-1时分化率最高为44.71%。建立狭叶黄芩组织培养快繁体系,实现狭叶黄芩的资源保护与开发利用,仍需要进一步筛选基本培养基、激素、添加物等因素。
研究发现不定芽增殖培养时将6-BA和NAA配合使用,芽苗增殖系数大且生长势强[19]。本试验中激素组合MS+1 mg·L-16-BA+0.5 mg·L-1NAA,不定芽增殖系数是所有配比中最大的,这说明适宜的植物生长调节剂浓度可以产生较高的增殖系数。高山林[3]等人在黄芩组培体系优化的研究中发现,使用PP333和6-BA时黄芩愈伤组织分化出的丛生芽最多,分化率为100%,这一研究结果可为后续研究优化狭叶黄芩的组培体系提供参考。组培苗生根能力的强弱和根系的生长状况直接决定了植株移栽的成活率。组培苗具有强大的根系与生根能力,才能更好的吸收利用土壤中的有效养分[20~21]。有研究认为生长素NAA和IBA对无菌苗生根均有促进作用[22],生长素IBA常用于组培苗不定根的诱导[20,23],在狭叶黄芩试管苗生根试验中,本研究在1/2MS基本培养基的基础上添加不同浓度的IBA和NAA,试验结果发现添加IBA的激素组合整体比添加NAA的生根效果较好,IBA浓度为0.2 mg·L-1时,生根效果最佳,随着IBA浓度的升高,生根率下降,说明浓度较高的IBA对根的诱导有抑制作用。王淑芳[6]等人在研究粘毛黄芩的生根培养基时发现,IBA浓度为0.5 mg·L-1时生根效果最好,比狭叶黄芩所需要的浓度要高,这就说明在相同浓度IBA下,狭叶黄芩比粘毛黄芩生根较容易。植物在移栽时根长应适宜,一般为2 cm,根长过长影响炼苗,过短影响水分吸收,不利于成活[24]。本试验中狭叶黄芩经炼苗后在三种基质中生长均健壮,但移栽成活率差异显著,其中蛭石∶珍珠岩∶园土=1∶1∶3时,移栽成活率最高为79.24%,并且此时园土占比最多,最为经济。
