锌胁迫对矾根生理生化响应及富集作用的影响
2020-03-09朱志国
朱志国
锌胁迫对矾根生理生化响应及富集作用的影响
朱志国
(芜湖职业技术学院园林园艺学院,安徽芜湖,241003)
研究人员通过盆栽试验研究了在四种浓度的锌污染下矾根的生长生理指标及其对重金属的富集能力。研究结果表明:在设计的较低Zn2+处理浓度(<200 mg/kg)下矾根能正常生长;随着Zn2+处理浓度的增加,MDA和脯氨酸的含量表现出显著升高的趋势,细胞质膜透性逐渐增加,而叶片叶绿素含量表现出明显降低趋势;叶片中CAT、POD及SOD活性均随着Zn2+浓度的增加呈现出先升后降的趋势;地下根系部分中重金属离子的含量显著高于地上的茎、叶部分。这表明矾根根系对锌有较强的富集作用。综上所述可知,矾根并不是锌的超累积植物,但对锌具有一定的耐性和适应能力,可以作为较低浓度锌污染的修复植物材料。
锌胁迫;矾根;生理指标;富集作用
矾根()是虎耳草科矾根属多年生耐寒宿根草本植物[1],又名珊瑚铃,近年来在国内广泛应用于林下地被、小型色块、花境、庭院绿化及园林景观中[2]。该植物青绿期长,能够在-15℃以上的温度下生长,喜富含腐殖质的土壤,适宜的pH值为5.8 ~ 6.2[3];可在坡地种植,冬季不落叶,枝条密集,株形圆整,覆盖性强,具有耐干旱、喜半荫、耐全光和耐寒性强等特点。目前,国内外关于矾根的研究主要集中在繁殖方法、组织培养、光合特性、抗寒性比较和适应性等方面[4],而对锌胁迫下矾根的生理指标、土壤酶活性及矾根生长状态所受影响等方面的研究较少。本试验研究了不同浓度的锌胁迫对矾根生长的生理特性、重金属富集能力及土壤酶活性的影响,旨在了解锌胁迫下矾根生理指标变化与其生长及耐受性的关系,为矾根用于受锌污染的土壤修复提供理论依据。
1 材料与方法
1.1 试验材料
供试土壤为市场购买的培养土,土壤质地疏松、透气。供试土壤的理化性质如下:全氮8.73 g/kg,全磷3.54 g/kg,全钾6.36 g/kg,速效钾469.7 mg/kg,有机质26.9 g/kg,电导率1.29 µs/cm,pH 6.35。供试矾根()采于芜湖职业技术学院南校区景观绿地,为生长健壮、长势均匀的健康植株。先将矾根幼苗在园艺实训基地预培养7天,再挑选枝叶比、高度基本相同的矾根幼苗进行盆栽试验,试验过程中各处理组保持常规的养护管理措施。
1.2 试验设计
以水溶液形式一次加入ZnSO4·7H2O(AR)至供试培养土,使培养土Zn2+浓度(以纯锌计算)分别达到0 mg/kg(CK)、100 mg/kg、200 mg/kg、500 mg/kg和1000 mg/kg。将培养土搅拌均匀并在室温下均衡一周后,装在直径18 cm的营养钵中,每个营养钵装土3 kg;每盆栽种1株大小相当的矾根进行试验,每个浓度水平重复三次。试验期间,将栽植好的矾根植株放置于温室内培养,盆内持水量保持在70%。培养20天后,通过目测法观察供试矾根植株的生长状况,然后将矾根植株从营养钵中小心地连根取出,并进行相关指标的测定。
2 结果与分析
2.1 Zn2+浓度对矾根植株生长的影响
从表1可知,随着锌浓度的不断增加,矾根植株的形态发生明显变化,植株变得低矮,叶片变黄缺绿。培养土中Zn2+浓度在200 mg/kg以下时,矾根植株生长正常,没有出现明显的外伤症状;当培养土中Zn2+浓度增加到500 mg/kg时,矾根植株叶片的中心位置就有缺绿现象,叶色变淡;随着培养土中Zn2+浓度的增加,这种缺绿现象越来越严重,叶片的颜色变得越来越淡。在Zn2+浓度上升至500 mg/kg和1000 mg/kg时,矾根植株变得矮小,叶片变黄,甚至有少部分叶片变软,这表明矾根的生长受到了严重影响。在Zn2+浓度达到1000 mg/kg时,植株生长被抑制,受到严重的胁迫伤害。由此可见,土壤中高浓度的锌对矾根的生长有抑制作用。

表1 Zn2+浓度对矾根生长的影响
2.2 Zn2+浓度对CAT、POD和SOD活性的影响
由图1可知,随着Zn2+浓度的增加,CAT、POD及SOD的活性呈现出先升后降的趋势,在1000 mg/kg浓度下均为最小值,分别为对照组的16.6%、46.9%和439.0%。尽管整体变化趋势一致,但CAT、POD和SOD对不同浓度的反应不同。CAT和SOD活性在Zn2+浓度为100 mg/kg时就达到最大值,分别为对照组的1.35倍和1.42倍;而POD活性在Zn2+浓度为200 mg/kg时达到最大值,为对照组的1.83倍。方差分析的结果表明:CAT在Zn2+为200 mg/kg和500 mg/kg浓度时,差异不显著(p>0.05值)。这一结果说明:在这一浓度区间内,Zn2+浓度对CAT活性影响不明显;POD活性酶在不同Zn2+浓度下都呈显著性差异;SOD活性在Zn2+浓度为200 mg/kg时与对照组相比差异不显著,可见SOD活性对锌胁迫的耐受范围在0 ~ 200 mg/kg。
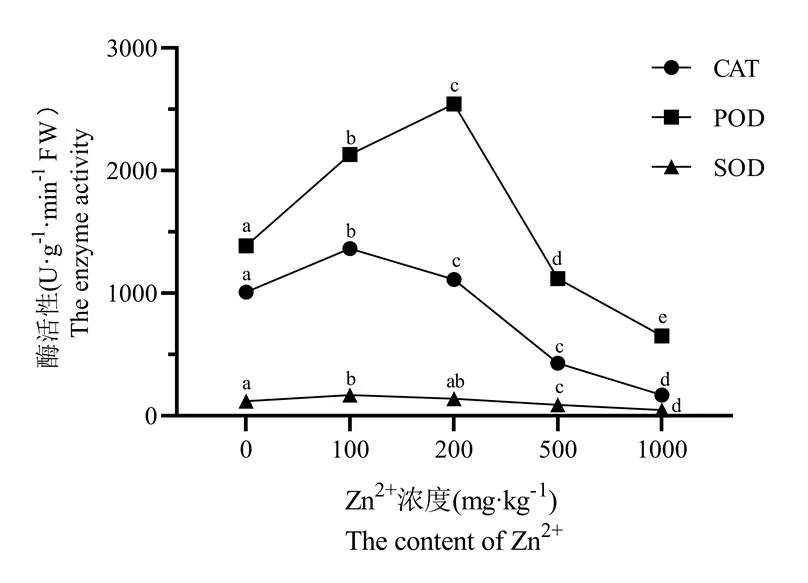
图1 Zn2+浓度对矾根植株CAT活性、POD活性及SOD活性的影响
注:采用Duncan's multiple range test方法分析,同一种酶不同的小写字母表示显著性差异(p<0.05,n=3)
2.3 Zn2+浓度对MDA含量的影响
由图2可知,随着Zn2+浓度的增加,矾根的MDA含量也随之升高。当Zn2+浓度达到100 mg/kg、200 mg/kg、500 mg/kg和1000 mg/kg时,MDA含量分别为对照组的1123.00%、141.32%、197.09%和230.81%。Zn2+浓度为100 mg/kg和200 mg/kg时,处理间MDA含量表现出差异不显著(p>0.05);而在其余各Zn2+浓度条件下,处理间MDA含量表现出差异显著,这表明矾根受到Zn2+浓度的伤害。
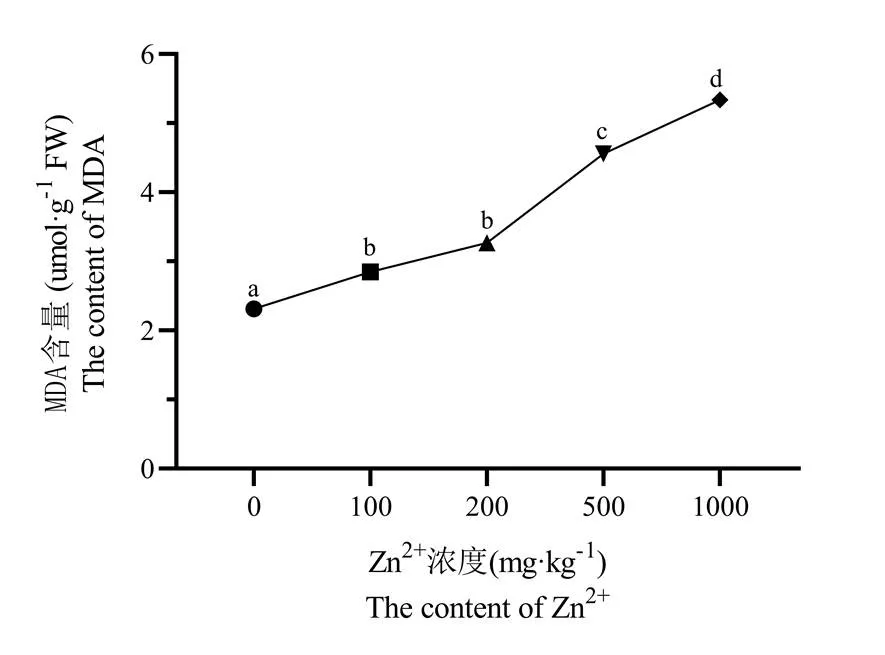
图2 Zn2+浓度对矾根MDA含量的影响
注:采用Duncan's multiple range test方法分析,同一种酶不同的小写字母表示显著性差异(p<0.05,n=3)
2.4 Zn2+浓度对脯氨酸含量的影响
由图3可知,随着Zn2+浓度的升高,矾根叶片中脯氨酸含量总体呈上升趋势。当Zn2+浓度达到1000 mg/kg时,矾根植株中脯氨酸浓度为对照的714.9%。这表明矾根不耐受Zn2+的高浓度胁迫,植株体细胞防御系统从Zn2+浓度升高伊始便一直处于抵抗防御的状态。
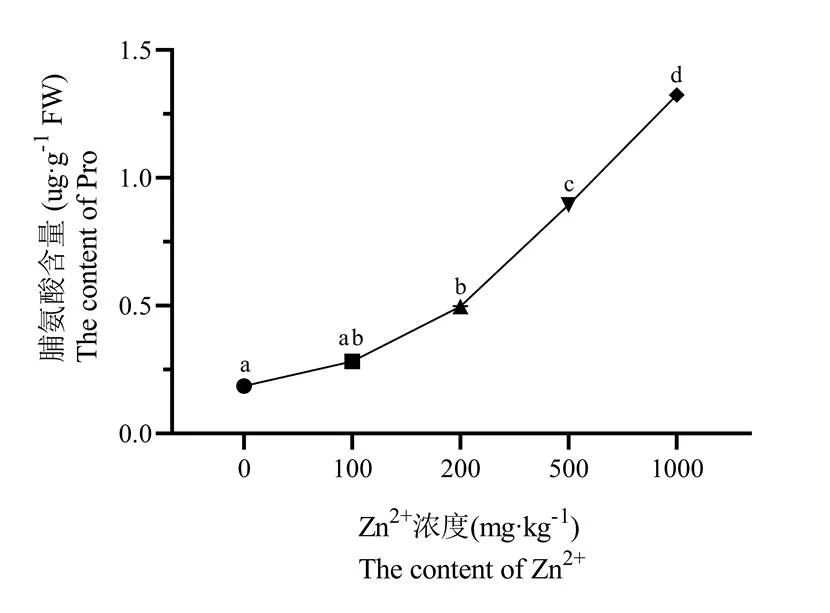
图3 Zn2+浓度对矾根脯氨酸含量的影响
注:采用Duncan's multiple range test方法分析,同一种酶不同的小写字母表示显著性差异(p<0.05,n=3)
2.5 Zn2+浓度对矾根叶片质膜透性的影响
由图4可知,相对电导率随着Zn2+浓度的升高而呈上升趋势。当处理浓度达到1000 mg/kg时,相对电导率为对照组的308%;处理浓度在100 mg/kg时,相对电导率与对照组相比无显著差异(p>0.05);在其余处理浓度条件下,相对电导率与对照组相比均存在显著差异。当Zn2+浓度达到500 ~ 1000mg/kg时,相对电导率差异不显著,并保持在较高水平。这表明高浓度Zn2+破坏了矾根叶片的细胞膜透性。
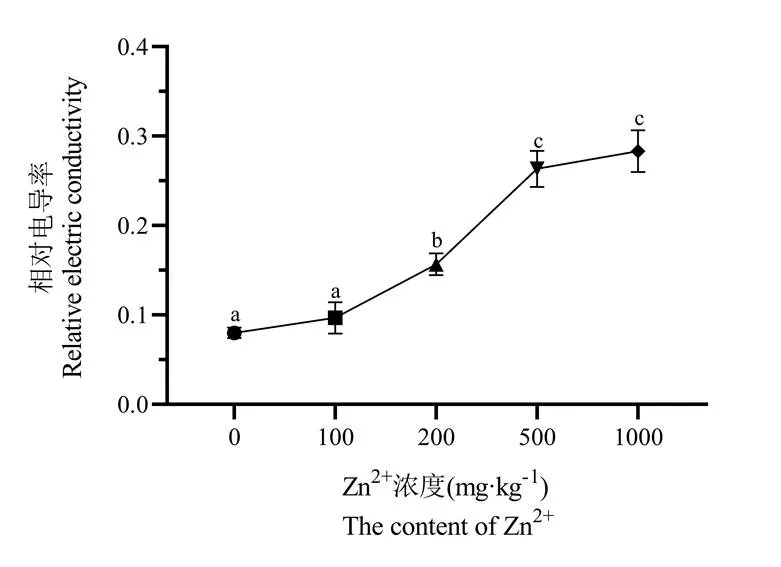
图4 Zn2+浓度对矾根叶片质膜透性的影响
注:采用Duncan's multiple range test方法分析,不同的小写字母表示显著性差异(p<0.05,n=3)
2.6 Zn2+浓度对矾根光合色素含量的影响
由图5可知,随着Zn2+浓度的增加,叶绿素a和叶绿素总量呈现先升高后下降的趋势,当Zn2+浓度在100 mg/kg时达到最高值,分别为对照组的1.13倍和1.09倍;当Zn2+浓度为1000 mg/kg时最小,分别是对照组的48.44%和50.69%。叶绿素b的含量则随着Zn2+浓度的增加而呈现下降的趋势,当Zn2+浓度为1000 mg/kg时含量最小,是对照组的75.42%。叶绿素a的变化趋势与叶绿素总量变化趋势相类似,这表明叶绿素总量的变化是由叶绿素a的变化引起的。对单因素进行方差分析的结果显示:叶绿素a在各Zn2+浓度均差异显著;叶绿素b在各Zn2+浓度均与对照组表现显著差异,但Zn2+浓度在200 mg/kg、500 mg/kg及1000 mg/kg时,各处理之间并无显著差异;而叶绿素总量则只有在Zn2+浓度为200 mg/kg时与对照组相比无显著差异(p>0.05),而在其余Zn2+浓度条件下和对照组相比均表现出极显著差异。不同Zn2+浓度引起的矾根光合色素的含量变化情况与上述不同锌浓度对矾根植株生长的外伤症状影响一致。
叶绿素a/b的比值代表类囊体的垛叠程度,比值高说明类囊体结构完整,能够更加有效地进行光反应。当Zn2+浓度为100 mg/kg和200 mg/kg时,叶绿素a/b的比值与对照组相比表现为不显著,表明Zn胁迫对矾根叶片光化学效率没有造成损害;Zn2+浓度增加到500 mg/kg时,叶绿素a/b的比值与前面的梯度相比表现为显著降低,表明矾根叶片的光抑制程度增加,叶绿素合成效率降低。因此。Zn2+浓度超过500 mg/kg时,叶片的光合作用受到了明显的影响。
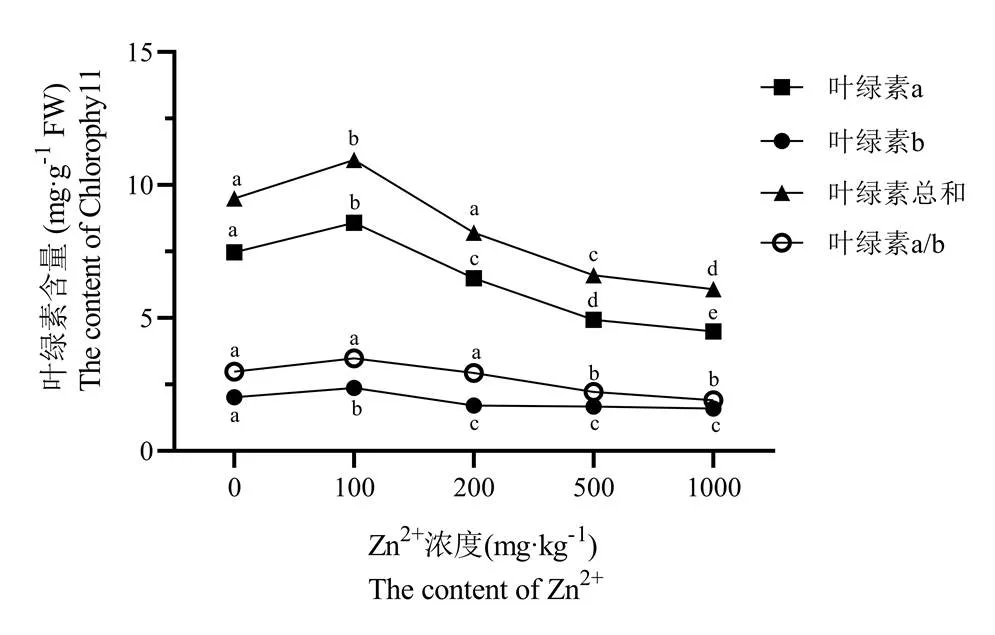
图5 Zn2+浓度对矾根叶绿素含量的影响
注:采用Duncan's multiple range test方法分析,同种叶绿素不同的小写字母表示显著性差异(p<0.05,n=3)
2.7 Zn2+浓度对矾根植株内锌富集状况的影响
由表2可知,随Zn2+浓度的增加,矾根的根系和地上部分中的锌含量都呈上升趋势。当Zn2+浓度为1000 mg/kg时达到最大值。此时,矾根根系和地上部分中的锌含量分别为15.454 mg/kg和11.867 mg/kg,分别为对照组的22.62倍和25.04倍。这表明在矾根植株内锌累积的主要部位是根系(地下部分)。
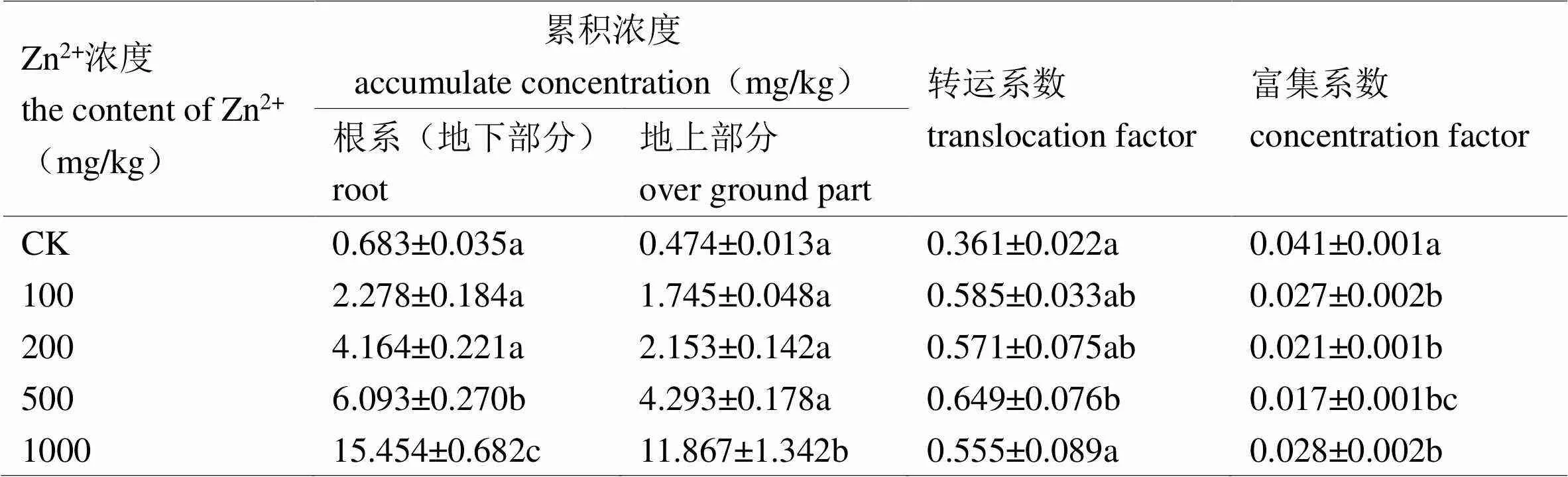
表2 锌在矾根植株内的累积及分布情况
注:数据为平均值±标准误,不同小写字母代表在0.05水平上显著性差异。
3 讨论与结论
在500 mg/kg以下Zn2+处理浓度时,矾根植株所受的影响不大,未表现出不良生长状况;但随着Zn2+处理浓度的逐步增加,矾根的生长受到抑制,耐性逐渐降低,植株受到不同程度的伤害。
在不同Zn2+处理浓度的胁迫下,矾根植株的各项生理生化指标变化表现出明显差异。当Zn2+处理浓度在较低水平时,矾根保护酶的活性上升,从而减少自由基对植物细胞的伤害;但随着Zn2+处理浓度逐渐增加,SOD、POD和CAT的空间结构受到影响,酶活性明显下降,对其生长和生理代谢活动产生影响。高浓度锌严重抑制了矾根植株的生长,并且会给植株带来不可逆转的伤害。
当Zn2+处理浓度增加时,MDA和脯氨酸的含量呈上升趋势;当Zn2+处理浓度达到1000 mg/kg时,MDA和脯氨酸的含量均达到最大值。
试验中,叶绿素含量随着Zn2+处理浓度的增加呈现出先升后降的趋势。叶绿素含量之所以下降,主要是因为在叶绿素合成过程中必需的原叶绿素酸酯还原酶受到重金属锌的抑制,从而导致叶绿素合成量减少[5]。
在不同Zn2+处理浓度下,矾根对锌的富集能力与对照组相比有显著差异。同时,矾根的富集系数随Zn2+处理浓度的增加而减小,即在较低Zn2+浓度时矾根对锌的富集能力较强,因此矾根在低Zn2+浓度范围内更易富集锌。本实验研究中,随着Zn2+处理浓度的增大,矾根植株地上部分的转移系数呈现增大的趋势,但均小于1,这不符合超积累植物转移系数大于1的标准。由此表明,矾根不是锌超积累植物。
[1] 许红娟,张丽, 陈之林,等. 不同彩叶矾根品种苗期在贵州冬季生长适应性比较[J]. 种子, 2016,35(9):104-107.
[2] 韶月. 花园使者——矾根[J]. 中国花卉园艺, 2016 (24):1-1.
[3] 张德祥,张君艳. 新优观叶花卉矾根的栽培管理技术[J]. 林业实用技术, 2014(4):62-63.
[4] 云青. 以叶胜花的精灵——矾根[J]. 中国花卉盆景, 2015(2):4-7.
[5] Stobart A K, Griffths W T, Ameen-Bukhari I, etal. The Effects of Cd2+on the Biosynthesis of Chlorophyll in Leaves of Barley[J]. Physiologia Planta-rum, 1985(63):293-298.
On the Influence by Zinc Stress on the Physiological and Biochemical Responses as well as the Concentration of
ZHU Zhiguo
Through the pot experiment, the physiological index of the growth ofand its ability in concentrating heavy metals in the environments contaminated by four concentrations of Zn2+were studied. The results showed as following: thecan grow normally at the lower concentration of Zn2+(<200 mg/kg); as the concentration of Zn2+increases, the contents of MDA and proline remarkably increase as well, and the permeability of cytoplasmic membrane also increases gradually, while the content of chlorophyll in the leaves significantly decreased; the activity of CAT, POD and SOD in the leaves increased firstly and then decreased as the concentration of Zn2+increases; the content of heavy metal ions in the underground roots is significantly higher than that in the aboveground stems and leaves, indicating that the root system ofhas strong concentration of Zinc. In conclusion, it can be known thatis not a super-accumulative plant of Zinc, but has certain tolerance and adaptability to this element, so it can be used as a kind of bioremediation plant for the environment contaminated by lower concentration of Zinc.
Zinc tress;; physiological index; concentration
Q945.78
A
1009-1114(2020)04-0011-04
2020-08-20
朱志国(1976—),安徽肥西人,硕士,芜湖职业技术学院教授,研究方向为园林植物遗传育种及生理生态。
研究项目:芜湖职业技术学院科技创新服务平台培育项目(Kjcxpt202007);芜湖职业技术学院教授科研启动基金(jsgc201605)。
特约文稿责编 胡好远
