高压氧对大鼠急性脑梗死的治疗作用及其机制
2020-03-09徐小丹黄璟涂涛
徐小丹,黄璟,涂涛
成都医学院第一附属医院,成都 610500
急性脑梗死是最常见的脑血管疾病,已被公认为世界范围内导致死亡和残疾的第三大原因。高压氧(HBO)已被作为一氧化碳中毒、减压病、动脉气体栓塞的主要治疗手段之一,另外对中风模型和脊髓、心、肝脏等器官有缺氧耐受的神经保护作用[1~3]。缺氧诱导因子-1α(HIF-1α)是缺氧诱导基因转录过程中的关键环节和共同信号传递通路[4],是大脑对缺氧反应的主开关,不但参与了缺氧时的血管生成和葡萄糖代谢的调节[5],而且在细胞凋亡、炎症活性的发展中起着关键作用[6]。尽管HIF-1α在脑缺血大鼠中被广泛认为是上调的,然而接受HBO治疗后HIF-1α作用如何目前尚不清楚。2018年2月~2019年3月,本研究通过建立脑梗死大鼠模型,并给予HBO治疗,观察对其大鼠急性脑梗死的治疗作用,并探讨其机制。
1 材料与方法
1.1 实验动物及分组 雄性SD大鼠150只,2月龄,体质量180~200 g。所有动物在饲养期间自由摄食和饮水。随机分为治疗组(60只)、模型组(60只)、对照组(30只)。所有外科手术均经动物实验伦理委员会批准,并按照我院动物实验指南进行。
1.2 急性脑梗死模型制备 无菌自然干燥的血凝块研碎分级过筛,选直径100~200目的微粒制成2 mg/mL的盐水悬浊液即栓塞液。以20%乌拉坦腹腔注射麻醉大鼠,暴露左侧颈总动脉及颈内、外动脉,暂时夹闭颈总动脉,治疗组和模型组大鼠从颈外动脉处逆行穿刺插管注入0.3 mL栓塞液,对照组注入同体积的生理盐水,后结扎颈外动脉,放开颈总动脉,使栓子通过颈内动脉进入颅内至大脑各动脉,逐层缝合伤口。模型制备成功标准:大鼠清醒后出现左侧综合征左侧眼裂变小、瞳孔缩小、右侧偏瘫(以右前肢为明显)、提尾悬拉后右前肢蜷缩屈曲或被动性过度伸展、同时出现向右转圈跌倒。如果大鼠术中死亡或模型未成功,则剔除后增补。
1.3 HBO治疗方案及标本取材 治疗组参照陈清华等[7]的方法进行HBO治疗,每天治疗1次。治疗过程:20 min内表压升至0.15 MPa,稳压吸氧1 h,20 min内减至常压后大鼠出舱。模型组的大鼠被放置在没有加压进行假治疗的房间中,时间与治疗组相同。室内温度保持在22~25 ℃,使用装有碳酸钙晶体的小容器可防止二氧化碳的积聚。为了尽量减少白天变化影响,所有暴露都在上午8∶00开始。在高压氧治疗1、3、7、14、21、28 d(分别计为T1、T2、T3、T4、T5、T6),将治疗组、模型组(每个时点取10只)和对照组(每个时点取5只)进行神经功能评分,完成评分后分别用乌拉坦(1.5 g/kg)腹腔注射深麻醉后断头处死,取5只大鼠脑组织用于测定脑梗死体积及HIF-1α阳性神经元数,剩余5只大鼠脑组织用于检测脑组织含水量及HIF-1α mRNA相对表达量。
1.4 大鼠神经功能评分 按Bederson氏4级评分标准并稍作修改,观察各组全部动物行为的变化并进行评分,0分为没有明显的神经功能缺失,1分为右侧前爪不能伸直,2分为行走时向缺血侧倾斜或划圈,3分为不能行走或右侧肢体反射消失。分值越高说明大鼠活动障碍越重。
1.5 大鼠脑梗死体积测算 将脑快速放于冰盘上,从前额1 mm处开始,切成5个2 mm的冠状切面。用2%的2,3,5-三苯基四唑氯铵(TTC)在0.2 mol/L PBS(pH 7.4)中进行组织学染色30 min,正常脑组织染成红色,梗死脑组织呈白色,再用4%多聚甲醛溶液固定后拍照留存。应用HPIAS-1000高清晰度彩色病理图文报告分析系统测出梗塞灶每一层面梗死面积。用下列公式计算脑梗死灶体积(V),V=dA(d为截面间距,A为截面面积)。
1.6 大鼠脑组织含水量测算 在各时间点切取每只大鼠约100 mg的皮层脑组织,用电子天平称大鼠脑组织湿重后置于105 ℃恒温烤箱中烘干,24 h后冷却称重。用下列公式计算脑组织含水量(X),X=(A-B)/A×%(A为脑组织湿重,B为脑组织干重)。
1.7 大鼠脑组织HIF-1α阳性神经元检测 采用免疫荧光染色检测。脑组织用4 %多聚甲醛固定,石蜡包埋。切片预先处理后采用兔抗HIF-1α(Abcam公司,1∶50)和鼠抗NeuN(Abcam公司,公司1∶200)孵育,PBS洗涤后,用荧光二级抗体山羊抗兔IgG(Abcam,1∶500)和抗鼠IgG(Abcam公司,1∶100)孵育,然后用PBS冲洗切片,用DAPI固定。最后用荧光显微镜(Olympus/BX51)以400倍的放大率拍照后每张切片随机观察5个视野进行细胞计数。
1.8 大鼠脑组织HIF-1α mRNA相对表达量检测 采用RT-PCR法检测。根据厂家说明书,用TRIzol试剂分离总RNA,用cDNA合成试剂盒逆转录到cDNA上。β-actin的mRNA作为内参。RT-PCR程序步骤:95 ℃持续1 min,45个循环95 ℃持续5 s,60 ℃持续5 s,72 ℃持续20 s。测得目的基因和β-actin 基因的循环阈值,根据标准曲线换算目的基因与β-actin 基因的拷贝数,以二者比值表示目的基因的相对表达量。
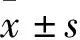
2 结果
2.1 不同时点各组神经功能评分比较 不同时点各组神经功能评分比较见表1。
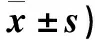
表1 不同时点各组神经功能评分比较(分,
注:与对照组比较,*P<0.05;与模型组比较,△P<0.05。
2.2 不同时点各组脑组织含水量比较 不同时点脑组织含水量比较见表2。
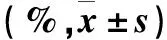
表2 不同时点各组脑组织含水量比较
注:与对照组比较,*P<0.05;与模型组比较,△P<0.05。
2.3 不同时点各组脑梗死体积比较 不同时点脑梗死体积比较见表3。
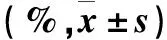
表3 不同时点各组脑梗死体积比较
注:与对照组比较,*P<0.05;与模型组比较,△P<0.05。
2.4 不同时点各组脑梗死区域HIF-1α阳性神经元数比较 不同时点脑梗死区域(皮质和海马)HIF-1α阳性神经元数比较见表4。
2.5 不同时点各组脑梗死区域HIF-1α mRNA相对表达量比较 不同时点脑梗死区域HIF-1α mRNA相对表达量比较见表5。
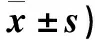
表4 不同时点各组脑梗死区域HIF-1α阳性神经元数比较(个,
注:与对照组比较,*P<0.05;与模型组比较,△P<0.05。

表5 不同时点各组脑梗死区域HIF-1α mRNA相对表达量比较
注:与对照组比较,*P<0.05;与模型组比较,△P<0.05。
3 讨论
急性脑梗死是导致中老年人瘫痪的主要疾病,严重影响患者的生存质量。急性脑梗死临床上以猝然昏倒、言语障碍、偏瘫为主要特征,治疗措施有常规治疗和溶栓治疗,常规治疗包括改善脑供血及脑微循环、脑保护、抗血栓治疗、预防并发症等,但效果不佳。而组织纤溶酶原激活剂(tPA)作为目前FDA惟一批准的治疗缺血性卒中药物,由于时间窗太短,仅被应用于2%~5%的急性脑梗死患者[8]。近年来,随着对脑梗死发病机制研究的日益深入,其治疗方面己有了长足的进步,但仍有机制尚不清楚。
HBO是一种有效的治疗方法,可以改善许多疾病的进展,尤其是缺氧相关的损伤[9],已被广泛应用于临床。研究[10]表明,HBO促进神经功能恢复,然而主要应用于脑梗死初发后数天或数周,不是为了减少梗死,而是改善后期的神经行为功能。因此,早期HBO治疗对脑梗死神经保护作用及其机制尚未研究。本研究显示,对照组不同时点神经功能评分均为0分,表明无神经功能缺损;相比之下,大鼠脑缺血后出现严重的神经功能缺损,并随着时间的推移逐渐下降;与模型组相比,治疗组评分明显降低,但仍高于对照组。这证实脑缺血损伤导致神经功能障碍,而HBO治疗可以抑制这种损伤的进展。脑梗死的梗死灶内因缺血缺氧致各种细胞脱氢酶活性下降或失活,TTC染色时不能产生变化呈苍白色,鲜明的颜色对比较易显示出梗死范围,故常用于脑梗死造模成功与否的评价。本研究显示,对照组大鼠无缺血损伤,呈红色染色,而治疗组梗死区域较模型组明显减轻。脑组织含水量在弥散性脑损伤后就可检测到较对照组明显增高,在第3天时达到最高峰,随后逐渐吸收,至28天检测结果仍然高于对照组水平,而HBO能使颅内血管收缩,从而减少渗出。这些结果表明HBO治疗可显著降低脑缺血损伤时的梗死体积和水肿程度。
当脑组织在一定范围内的缺血缺氧时,会主动合成一些调节因子来减轻缺血缺氧带来的损伤,越来越多的证据发现HIF-1α是机体启动的最强内源性保护因子,它被激活后所产生的生物学效应是调节缺氧反应性基因表达的共同分子通路[11~13]。在缺血条件下,HIF-1α可促进参与能量代谢、血管生成和细胞存活的多种蛋白的转录,这些蛋白可作为抗缺血性脑损伤的神经保护剂[14]。另外HIF-1α可间接影响中性粒细胞向缺氧半影的浸润,这被认为是缺血性脑损伤的主要原因[15],因此HIF-1α是脑缺血损伤后炎症反应进展中的关键分子。HBO治疗对脑缺血大鼠具有神经保护作用,其分子机制可能与HIF-1α的变化有关,主要表现在保护血脑屏障的完整性、调节蛋白合成与神经活性[16,17]和减少活性氧的产生[18]。另外据Liu等[19]报道,HIF-1α通过抑制血管内皮生长因子、半胱氨酸天冬氨酸蛋白酶-9和促红细胞生成素凋亡途径,改善梗死区血管生成。本研究显示,模型组和治疗组HIF-1α的mRNA水平在第1、3、7天均高于对照组,且在损伤后1天达到最大峰值。脑缺血损伤诱导大脑梗死区域HIF-1α的mRNA和蛋白水平的增加,这可能代表了神经元受到缺血损伤的反应,而治疗组在脑缺血早期明显增强。因此,刺激HIF-1α表达可能是HBO诱导的神经保护的关键机制,这与Cheng等[20]报道的结果一致。另外HIF-1α在大鼠脑损伤后脑组织中的表达与脑损伤后脑组织的含水量均处于一个动态的高表达状态。其机制可能是随着时间的延长,其脑水肿逐渐被吸收,对周围组织的压迫减轻,从而使其缺氧较前改善,故其表达呈下降趋势。鉴于HIF-1α在脑损伤超早期对神经细胞的保护作用,通过增加HIF-1α在脑损伤后的早期表达可作为控制脑水肿的一个有效办法。
总之,HBO治疗能显著降低脑缺血所致的损伤,其机制与刺激HIF-1α的过度表达有关。
