环状RNA circ-Foxo3模拟物转染对人食管癌细胞株TE-13增殖、凋亡、放射敏感性的影响
2020-03-09邢瑶查文娟李晓敏高飞刘阳晨
邢瑶,查文娟,李晓敏,高飞,刘阳晨
蚌埠医学院附属泰兴市人民医院,江苏泰兴 225400
食管癌(EC)是全球恶性肿瘤之一,2012年至2016年估计有79万人死亡[1]。EC的主要组织学类型是食管鳞状细胞癌(ESCC),(TE-13细胞则是食管鳞状细胞株之一),其中近一半的ESCC病例发生在中国[2]。叉头盒O3(FOXO3)是一个转录因子,是叉头家族的成员。环状RNA FOXO3(circ-Foxo3)和线性FOXO3(FOXO3 mRNA)均由FOXO3基因编码[3]。在非小细胞肺癌[4]和乳腺癌[5]中,circ-foxo3的表达较低,为肿瘤抑制基因。此外,一些环状RNA有可能成为新的诊断标志物。He等[6]在食管鳞癌组织和细胞系中发现,circ VRK1表达量是下调的,并发现在功能上,circVRK1的过度表达抑制了细胞增殖、迁移和上皮间质转换。circVRK1可能是通过PTEN进行积极调控增加了放射敏感性。然而,circ-Foxo3在食管鳞癌中的具体功能,对放射敏感性的影响及机制,还需要进一步研究。2018年8月~2019年4月,我们选择食管鳞癌细胞株TE-13作为研究对象,通过控制肿瘤细胞内circ-Foxo3基因的表达,进而观察其对食管鳞癌细胞株TE-13的生长增殖、凋亡、放射敏感性以及PTEN蛋白表达的影响,寻找抑制食管鳞癌细胞生长的新路径,旨在为食管鳞癌的放射治疗提供新的治疗思路。
1 材料与方法
1.1 细胞及试剂 TE-13细胞购自上海中科院细胞库;RPMI1640购自Gibco公司,TRIzol试剂、RT-PCR试剂盒购自日本TaKaRa公司,Lipofectamine3000购自美国Invitrogen公司,Annexin V-FITC凋亡检测试剂盒购自BD Biosciences公司,过表达circ-Foxo3质粒购自上海吉玛基因,引物均购自上海生工,CCK-8、0.1%结晶紫、Western blot相关试剂盒均购自上海碧云天生物技术有限公司。
1.2 E-13细胞分组、环状RNA circ-Foxo3模拟物(circ-Foxo3 mimics)转染及circ-Foxo3检测 采用RT-PCR法。将TE-13、HEEPIC细胞株放入RPMI1640培养基(含10%血清),在37 ℃、5%CO2培养箱中培养,待细胞处于对数生长期,使用Lipofectamine3000将circ-Foxo3 mimics和NC转染至TE-13细胞中培养(分别计为过表达组、NC组),用于后续实验。转染前后,用TRIzol试剂提取细胞总RNA,并逆转录得到cDNA,操作按试剂盒说明书进行。circ-Foxo3上游引物:5′-GTGGGGAACTTCACTGGTGCTAAG-3′,下游引物:5′-GGGTTGATGATCCACCAAGAGCTCTT-3;U6为内参基因,每个样品测三个复孔,用2-ΔΔCt分析circ-Foxo3相对表达量。
1.3 TE-13细胞增殖率测算 采用CCK-8实验。过表达组和NC组以每孔2 000个细胞接种于96孔细胞培养板中,每组设置3个复孔,在0、24、48、72、96 h每孔加入10 μL的CCK-8溶液,孵育3 h,酶标仪检测450 nm波长处的OD值。
1.4 TE-13细胞凋亡率测算 采用流式细胞术。取过表达组和NC组对数生长期的细胞,用4 Gy剂量的X线照射后,继续培养48 h,胰酶消化收集1×106个细胞,用冰预冷的PBS洗涤重悬细胞,1 000 r/min 离心10 min,弃上清,加入100 μL结合缓冲液,充分重悬后分别加入5 μL膜联蛋白V-异硫氰酸荧光素(Annexin V FITC)和5 μL碘化丙啶(PI),混匀后37 ℃下避光孵育20 min,加400 μL结合缓冲液过筛网,流式细胞仪检测两组细胞照射前后的细胞凋亡率。
1.5 TE-13细胞放射敏感性测算 采用克隆形成实验。将过表达组和NC组用胰酶消化,重悬,并在六孔板上分别以200、500、1 000、2 000、5 000/孔铺板,对应照射剂量为0、2、4、6、8 Gy,每个照射剂量设3个复孔。采用6MV X射线直线加速器从下向上垂直照射细胞,源皮距(SSD)为100 cm。继续培养,待六孔板出现肉眼可见的集落时,90%乙醇固定15 min,PBS洗涤,0.1%结晶紫染色20 min,统计细胞个数≥50的单克隆集落,计算各组细胞克隆形成率(PE)及存活分数(SF),PE=克隆数/接种细胞数×100%,SF=受照射组PE/未照射对照组PE×100%。
1.6 TE-13细胞PTEN蛋白检测 采用Western blotting法。将过表达组和NC组细胞进行4 Gy照射处理,24 h后收集细胞,加入细胞裂解液,冰上裂解30 min后,12 000 r/min离心15 min,将蛋白上清吸取至EP管中,保存于-80 ℃。参照BCA蛋白浓度检测试剂盒说明书检测所提蛋白的浓度。将已知浓度的蛋白样品与5×loading buffer按照4∶1的比例混合后,100 ℃金属浴煮沸 5 min。10%聚丙烯酰胺凝胶电泳时,每孔加入50 μg变性蛋白样品,分离胶用80 V电压电泳,浓缩胶用120 V电压电泳,待溴酚蓝进入胶的底端边缘时结束电泳,转膜至聚氟乙烯(PVDF)膜上,后封闭2 h;洗涤液洗膜3次,每次10 min,与1∶1 000稀释的一抗,4 ℃孵育过夜;与稀释的辣根过氧化物酶标记的二抗常温孵育1 h。洗涤后滴加化学发光剂,凝胶成像系统扫描分析PTEN蛋白的表达水平。
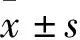
2 结果
2.1 TE-13细胞转染前后circ-Foxo3相对表达量比较 TE-13细胞转染前后circ-Foxo3相对表达量分别为0.05±0.01、3.99±0.17,转染前后比较,P<0.05。
2.2 两组不同时点OD值比较 不同时点OD值比较见表1。
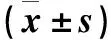
表1 不同时点两组OD值比较
注:与对照组比较,*P<0.05。
2.3 两组细胞凋亡率比较 过表达组照射前后细胞凋亡率分别为4.83±0.85、11.67±0.47,NC组分别为0.37±0.06、5.17±0.25,两组同组照射前后及两组治疗后比较,P均<0.05。
2.4 两组不同剂量X线照射下细胞存活分数比较 不同剂量X线照射下细胞存活分数比较见表2。
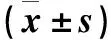
表2 不同剂量X线照射下两组细胞存活分数比较
注:与对照组比较,*P<0.05。
2.5 两组细胞PTEN蛋白条带灰度值比较 过表达组照射前后PTEN蛋白条带灰度值分别为0.71±0.02、0.87±0.01,NC组分别为0.53±0.04、0.55±0.04,两组同组照射前后及两组治疗后比较,P均<0.05。
3 讨论
食管鳞癌是食管癌主要组织学类型,目前食管鳞癌的多种治疗(手术、放疗、化疗、靶向、免疫等)正在迅速发展,但由于ESCC早期没有典型的临床症状,确诊时多数已是晚期并有淋巴结转移,发病率和复发率仍然很高,总体5年存活率仍然很低[7,8]。因此,了解食管鳞癌的发生发展机制及相关的基因调控,对食管鳞癌的治疗提供新的思路,是目前需要研究的方向。
环状RNA在恶性肿瘤发生、发展中的作用已逐渐被发现,大量文献显示可能跟miRNA海绵吸附功能有关,环状RNA作为miRNA海绵调节靶基因的表达[9,10]。此外,环状RNA在各种生物体中有丰富的稳定性和保守性,由于这种特性,环状RNA可能成为潜在的生物标志物[11]。近年来,在竞争的内源 性RNA(ceRNA)网络的生物学功能中,环状RNA发挥着重要作用[12]。研究显示,circ-MTO1通过吸附癌基因miR-17抑制肺腺癌的生长,表明circ-MTO1在肺腺癌中起到抑制肿瘤增殖的作用[13]。circ DENND4C是一种与 HIF1α相关的环状RNA,在缺氧条件下促进乳腺癌细胞的增殖[14]。研究表明,circ-Foxo3可与ID-1、E2F1、FAK和HIF1相互作用,使它们不能再发挥抗衰老和抗应激作用,从而增加细胞衰老[15]。Du等[16]在研究circ-Foxo3功能时发现,circ-Foxo3的表达水平与Foxo3 线性mRNA的表达水平无关,尽管两者似乎都有抑制肿瘤的活性。目前在人类癌症中已经注意到circ-Foxo3的失调,但关于circ-Foxo3在食管癌中的生理功能研究尚少。本研究显示,circ-Foxo3在食管鳞癌细胞中的表达水平较食管正常上皮细胞明显降低,这说明circ-Foxo3在食管鳞癌中也起着抑癌基因的作用,与circ-Foxo3在其他恶性肿瘤中的研究结果一致。进一步我们发现,细胞的增殖能力在过表达组较NC组明显被抑制,而细胞凋亡数明显增加,提示circ-Foxo3可能与了食管鳞细胞的增殖、凋亡能力有关。
1997年首次在胶质瘤细胞中发现了PTEN基因[17],后进一步研究发现PTEN参与了细胞内多数信号传导通路[18],并影响了细胞增殖、凋亡。PTEN作为miR-106b 的直接靶基因,在一定程度上诱导了细胞放射抵抗[19]。上调PTEN蛋白水平可以抑制肿瘤细胞增殖并且诱导食管癌细胞凋亡和细胞周期阻滞,而PTEN的表达水平与肿瘤放疗疗效显著相关[20]。本研究结果显示,经过X射线照射后,过表达组细胞存活率较NC组降低,细胞凋亡数及PTEN蛋白表达水平较NC组升高。
总之,circ-Foxo3在食管鳞癌发生发展过程中发挥着抑癌基因的作用,过表达circ-Foxo3可能抑制细胞增殖,促进凋亡,增加了细胞对放射的敏感性,其可能的机制跟PTEN基因表达上调有关。
