有关液相吸附研究的常见问题综述
2020-03-08刘永军
刘 磐,刘永军
(1.西安航空职业技术学院,陕西 西安,710089;2.西安建筑科技大学 环境与市政工程学院,陕西 西安,710082)
前言
吸附是一种用于市政废水、地下水和工业废水的极具竞争力的处理和净化技术。由于吸附操作简单高效、成本低,对其研究仍是热点,不断有新型高效吸附剂开发出来,如纳米材料[1]、石墨烯基吸附剂[2]、磁性材料[3]、金属有机框架[4]等。此外,一些研究建议使用低成本吸附剂,包括农业和工业废物、副产品[5-7]和生物质[8]。当然他们可能只是借助吸附研究表征新型吸附剂性能,然而准确描述新型吸附剂性能,并正确阐释其吸附机理仍处于重要的地位,那么,准确使用专业术语,深入理解并选择合理的模型用于描述其吸附现象则是重中之重。
然而,不少国际学术期刊中出现了一些关于吸附研究的错误描述,或矛盾解释,包括专业术语的使用、一些常数意义的确定、动力学研究和动力学吸附数据建模、寻找适合的等温线模型拟合平衡实验数据、吸附热力学参数计算等。一旦错误进入学术文献中就很难根除,有些错误会继续传播下去。不管这些错误是由于作者的主观原因还是客观原因造成的,但是这对科研工作者,尤其是初学者来说,势必会造成极大的困扰与误导,对于他们深入研究吸附过程相关工作极其不利。因此,笔者就水污染控制中污染物的吸附研究中应注意的一些问题作简要概述,并给出正确的解决方法,希望对后续研究提供正确的研究思路,避免此类错误的继续传播。
1 吸附性能测定几点注意事项
1.1 性能表征参数选择要准确
吸附性能可用平衡时吸附的吸附质的量或被除去的吸附质的百分比。平衡吸附量(qe:mg/g)通常用吸附系统的物质平衡来计算,从溶液中消失的吸附质一定在吸附剂中[9]。

其中,C0(mg/L)和Ce(mg/L)分别为溶液中的初始吸附质浓度和平衡吸附质浓度;m(g)为所用吸附剂的干燥质量;V(L)为吸附溶液的体积;m/V(g/L)定义为固液比。
根据研究目的不同,qe可以选用不同的单位:(1)mg/g 用于评价实际和工程过程,这里涉及到过程质量守恒。(2)当研究吸附过程的化学计量学,或者研究官能团和金属结合机制时,用mmol/g 或meq/g 表示吸附量才有用。(3)mmol/g 也可用于比较各种吸附材料的选择性吸附性能[9]。(4)由于对反应器体积的考虑(如填料床),吸附量也可用mg/L 表示,当然,孔隙度会使定量比较吸附量变得复杂[10]。在这些单位中,mg/g 最常用于qe吸附研究。
用溶液中吸附质的去除率(%)表示吸附性能的这种方法只适用于粗略测定,也可用于快速和近似筛选吸附剂材料[11]。因此,去除率(%)的使用需谨慎,在某种程度上,吸附平衡研究中使用去除率可能导致不正确的实验结果,从而导致吸附性能的错误结论。
1.2 初始接触时间确定要合理
在吸附动力学研究中,吸附初始时间的确定非常重要,获得准确的初始吸附数据对进行正确动力学建模和得出有效实验结论起着重要作用。根据吸附剂与吸附质间的亲和力,初始吸附速率可能非常快。在吸附去除重金属离子过程中,Müller 等[12]发现Lewatit S1468(磺化聚苯乙烯树脂)在1min 内可将溶液中Zn2+去除90%,5min 内达吸附平衡状态;Tran 等[13]发现桔皮生物炭在1min 内即可将80.6%~96.9%Cd2+去除,并达平衡状态。在有机污染物的吸附动力学研究中也发现类似现象,Canzano 等[14]注意到用未经处理和酸处理过的松果粉吸附阴离子刚果红染料,在<5min 内可达到平衡状态,但在此期间没有进行任何测量;活性炭在1min 内可从溶液中去除50%~73%的阳离子亚甲基绿5[15]。早在2006年,Azizian 等[16]就认为实验数据的获得应从<2min开始。
吸附平衡实验数据不能反映吸附平衡的达到方式,因此,在非常接近或已达平衡后重要时间间隔内记录的实验数据极有可能导致吸附动力学错误结论。
1.3 平衡时间确定要科学
由于多孔吸附剂和无孔吸附剂的吸附机理不同,无机和有机污染物在多孔吸附剂(如活性炭、活性炭颗粒、生物炭、分子筛和大孔树脂)上的吸附过程比无孔吸附剂(如生物吸附剂、氢炭)的吸附需更长时间(几天或几周)才能达到真正平衡。孔隙填充是多孔吸附剂最常见的吸附机理,同时还可能存在另外几种依赖于吸附剂和吸附质相互作用(如静电吸引、氢键、表面沉淀、π-π 相互作用、n-π 相互作用和阳离子交换)的吸附机理。许多研究选择将24h 作为吸附等温线实验平衡时间,但是没有证据表明其吸附系统达到了真正平衡。例如,Kim 等[17]推测了合成介孔炭颗粒(GMC)和商用活性炭颗粒(GAC)对甲基紫(MV)的吸附过程。动力学研究结果表明,GMC-聚乙烯醇吸附MV 可在20d 内达到平衡,GMC-羧甲基纤维素可在26d 内达到平衡,而GAC 的吸附平衡在75d 后仍未达到。此外,达到吸附平衡后还有可能在吸附剂表面发生吸附质解吸现象,Sharma 等[18]研究氧化石墨烯吸附甲基蓝,发现1h 左右即可达吸附平衡,吸附时间延长后开始出现解吸现象,2 h 时解吸严重,吸附剂吸附量很低。同时发现,反应温度越高,解吸现象显现越早,平衡持续时间越短。因此,通过吸附动力学研究来确定吸附过程所需平衡时间和最佳接触时间具有重要意义。
2 吸附动力学模型
对于任何实际应用,吸附动力学对过程设计和操作控制都是非常重要的。吸附动力学模型解释了吸附过程发生的快慢以及影响反应速率的因素。在液相吸附过程中,伪一级动力学模型和伪二级动力学模型最常用于描述本征动力学吸附常数。然而,在文献中发现了很多与动力学模型使用有关的讨论及表述,下面将对这两种模型的一些错误进行归纳总结并给出正确做法。
2.1 伪一级动力学模型(PFO)
该方程最先由Lagergren 提出,是用于描述炭吸附草酸和丙二酸的一级吸附速率方程[19]。该方程的线性表达式及线性表达式,以及在使用过程中出现的许多错误线性形式表达式汇总至表1。
大多数情况下,PFO 方程只适用于初始接触的20~30 min,而不适用于整个范围[20]。因此,上述线性化方程作图时只在前30 min 内是呈线性的,超出此时间范围,则实验值不能正确拟合理论值[21]。若使用线性化方程拟合实验数据,涉及到qe值,由于达平衡所需时间很长,qe值很难精确测定。要准确估计PFO 方程中动力学参数,在进行数据拟合时应使用非线性方法。目前,常用的绘图分析软件MatLab、Origin 等均可进行非线性拟合。另外,还需注意的一点就是,估算的qe值不能低于实验所得的最大qt值。

表1 PFO 方程的表达式及错误线性表达式Table 1 The correct and incorrect linear expressions of PFO equation
2.2 伪二级动力学模型(PSO)
该方程由Blanchard 等[22]在1984 年首次提出并用于描述天然沸石去除水中重金属的二阶速率方程,见表2 非线性方程表达式。据文献报道,汇总了4 种线性化形式,以及错误的线性形式(见表2)。
鉴于PSO 方程对实验结果的拟合效果最佳,一些文献研究认为由于吸附质与吸附剂间共用电子对而形成了价键驱动力,故吸附过程符合化学吸附机理等类似的有争议结论。一些研究人员针对此类结论存在问题进行了讨论[23-25],他们认为吸附机理不能仅通过动力学实验或拟合动力学模型(如PFO及PSO 模型)而得出。吸附机理的确认需借助多种分析技术(如FTIR、SEM、N2吸附-脱附等温线、拉曼 光 谱、TGA/DTA、DSC、29Si、13C 固 态NMR、XRD、XPS、pHPZC、PHIEP、CHN 元素分析、Boehm 滴定法和溶液量热法),并联合对吸附质和吸附剂的表面物理化学性质及其二者间相互作用的充分了解[9,23,24],与吸附热力学数据、活化能、吸附能共同使用来确定吸附过程是物理吸附过程或化学吸附过程[23,26]。
3 吸附等温线
吸附等温线对阐明吸附机理的贡献不如吸附动力学和热力学数据有帮助[27,28],但是,吸附等温线是描述恒温条件下吸附质在液相与固态吸附剂上的分布关系,是设计吸附系统的有效策略[26]。使用完整吸附等温线的平衡数据是获得等温线表达式中参数的最佳方法,只有部分平衡数据的等温线是不充分的。另外,还需注意的是,必须绘制出完整的qe~Ce吸附等温线,而不是去除率%~Co、去除率%~Ce或qe~Co的曲线[29]。
Langmuir 和Freundlich 模型是最常用的,不仅因为它们的模型参数简单有用,易于解释,而且这两种方程在大多数情况下均可很好地拟合实验数据(R2>0.9)。
3.1 Langmuir equation
Langmuir 方程[30]最初应用于气体在固体表面的吸附,是基于以下假设建立的:(1)吸附剂表面有固定数量的吸附位点,且所有活性位点的能量相同;(2)吸附是可逆的;(3)吸附质一旦占据了一个位点,该位点上就不会再发生吸附;(4)吸附质之间不存在相互作用。Langmuir 模型的非线性形式以及四种线性化形式见表3。

表2 PSO 方程表达式与错误线性表达式Table 2 The correct and incorrect linear expressions of PSO equation

表3 Langmuir 方程及其线性表达式Table 3 The nonlinear and linear expressions of Langmuir equation
对于好的吸附剂,Q0max值高、陡峭的初始等温线斜率(即KL 值高)一般是可行的[31,32]。
尽管大有量的吸附动力学研究中依然采用Langmuir 模型Type 1 型进行研究,实际上对数据进行线性化变换会导致误差结构改变,将误差引入自变量,改变每个数据点的权重,这些会导致线性和非线性Langmuir 模型拟合参数值的差异,因此不建议使用线性化的动力学吸附模型。
3.2 Freundlich equation
Freundlich 方程用于描述吸附剂非均匀表面上的吸附,或具有不同亲和性吸附位点的吸附。假设较强的结合位点最先被占据,结合强度随着位点被占据程度的增加而降低[33]。与Langmuir 方程不同,Freundlich 等温线既不能描述浓度很低时的线性范围,也不能描述浓度很高时的饱和效应。因此,Freundlich 等温线不能描述吸附剂的饱和行为[31]。Freundlich 方程的非线性和线性形式,以及观察到的一个错误线性表达式见表4。
必须注意的是,方程中指数n 必须是无量纲的,然而,有文献[34]却对n 添加了单位,如g/L,这违背了Freundlich 理论的原始理念,是错误的。

表4 Freundlich 方程及其错误线性表达式Table 4 The correct and incorrect linear expressions of Freundlich equation
4 吸附热力学
热力学研究是预测吸附机理(如物理和化学)不可缺少的组成部分。最近的一份报告[26]详细总结了物理吸附和化学吸附之间的主要区别。根据热力学定律,热力学参数可以用下列公式计算得出:

将(1)式代入(2)式可得著名的van't Hoff 方程:
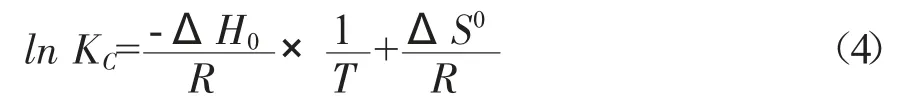
其中,R=8.3144 J/(mol×K),T 为液相Kelvin 温度。
ΔG0(J/mol)可由(2)式直接计算得到,ΔH0和ΔS0可通过(4)式对lnKC~1/T 作图所得斜率和截距得到。(3)式不能用来计算得到ΔG0值,它表示的是三者间的关系,可用于校核这些热力学参数计算值的逻辑性。
为了准确获得热力学参数,依赖于准确获得平衡常数KC。文献报道[26,35,36]可通过吸附等温线(如Langmuir,Freundlich)常数或分配系数来确定KC。准确确定KC时需注意以下几点:(1)KC必须是无量纲的;(2)van't Hoff 方程线性回归系数(R2)必须大;(3)用于吸附平衡研究(吸附等温线)的吸附质浓度高还是低;(4)温度单位必须K,而不是℃。
一般来说,温度的升高往往伴随着吸附能力的下降,这反映了吸附过程的放热性质(ΔH0<0)。一个放热的吸附过程(-ΔH0),以热的形式向周围环境释放能量,这种放热现象是由于断键吸收的总能量小于成键释放的总能量,导致额外的能量以热的形式释放出来[37]。相比之下,吸热过程(+ΔH0)以热的形式从周围环境中吸收能量。ΔG0是决定吸附过程自发性程度的关键因素,ΔG0的负值越大,表明吸附更加积极有利。如果ΔG0为负值,则在给定的温度下,吸附过程将有利而自发地发生;相反,它将是非自发、不可行的。ΔS0的大小和符号反映了固-溶界面上吸附质的组织结构变得不自由(ΔS0<0)还是更自由(ΔS0>0),ΔS0的负值也意味着吸附现象涉及一个缔合机理,ΔS0为正值则意味着吸附现象涉及一个解离机理。
5 总结
应注意对基本吸附和化学概念的各种常见误解,了解吸附剂和吸附质的独特性质有助于避免在解释吸附机理时所犯的错误。在表征吸附性能时应以qe(mg/g)表示,应避免或谨慎使用去除率(%)来表征。
研究液相吸附时,吸附动力学测量应在初始时间小于2 min 时开始,吸附过程达到真正平衡时结束。提供完整的吸附等温线(qe~Ce图)。对于吸附热力学,平衡常数(KC)必须是无量纲的。根据吸附平衡实验数据,选择最佳的热力学参数计算方法。深入了解吸附动力学和等温线模型是必要的,以避免误用这些模型,以及不准确的讨论、计算和结论。
