眼斑芫菁在斑蝥素合成期的抑制性消减杂交文库构建及分析
2020-03-07张利萍殷幼平
王 宇, 张利萍, 殷幼平
(1.攀枝花学院 医学院,四川 攀枝花617000; 2.攀枝花学院 附属医院,四川 攀枝花617000;3.攀枝花学院 康养学院,四川 攀枝花617000; 4.重庆大学 生物工程学院,重庆400030)
斑蝥素主要来源于芫菁科昆虫中的眼斑芫菁,是我国《药典》里面记载的一种传统动物药材[1].近年来发现,斑蝥素及其衍生物如去甲斑蝥素可以诱导肿瘤细胞凋亡或者抑制肿瘤细胞的扩散和增殖[2],对于治疗肝癌、淋巴癌、胃癌等肿瘤有很好的疗效[3-5].
眼斑芫菁斑蝥素合成具有性二型现象,雌性成虫合成斑蝥素很少,主要由雄性成虫合成.此外,雄性成虫在不同发育阶段其斑蝥素合成量具有显著的差异.雄性成虫羽化后第1—10 天雄性成虫合成斑蝥素的质量分数仅为0.114% ~0.237%,羽化后第20—25 天斑蝥素质量分数急剧增加,从0.486%增加到0.942%,达到斑蝥素合成的高峰期[6].同时,通过SDS-PAGE 和双向电泳技术分析苹斑芫菁在斑蝥素合成前期、大量合成早期和末期的蛋白质组成的变化,发现3 个时期蛋白质组成的变化趋势与芫菁合成斑蝥素质量分数显著峰值变化相一致,表明芫菁体内斑蝥素的合成是由多种蛋白质参与的复杂过程[7].目前,由于眼斑芫菁的斑蝥素合成途径仍不清楚,所以本研究通过构建SSH筛选眼斑芫菁在斑蝥素合成期的差异表达基因,这为阐明斑蝥素合成途径奠定基础.
1 材料和方法
1.1 材料眼斑芫菁成虫采自贵州省罗甸县,采回后在实验室内以室温(30 ± 1)℃、相对湿度75% ±5%、光周期14 hL/10 hD 的条件下饲养,收集羽化后第6—10 天和第21—25 天的雄性成虫作为供试材料.
1.2 主要试剂和仪器主要试剂包括TRIzol试剂(购于Invitrogen公司)、PCR-Select cDNA Subtraction Kit 和SMART PCR cDNA Synthesis Kit(购于Clontech 公司)、RNase -free DNaseI(购于Fermentas公司)、mRNA纯化试剂盒和pMD18 -T 克隆载体试剂盒(购于TaKaRa 公司)、标记探针的DIG High Primer Kit(购于Roche 公司)、荧光定量PCR试剂盒(购于Bio -RAD 公司)、DNA 纯化试剂盒(购于AXYGEN 公司).主要仪器包括凝胶成像系统(Bio-Rad)、PCR仪(Bio -Rad)、DU640 紫外分光光度计(Beckman).菌株JM109 为本实验室保存.所用引物及测序分别委托上海生工公司和华大基因公司完成.
1.3 方法
1.3.1 样本采集 分别取隔离饲养羽化后第6—10 天的雄性成虫(driver)和第21—25 天的雄性成虫(tester),液氮速冻后保存于-80 ℃超低温冰箱中,-80 ℃保存,供提取RNA.
1.3.2 总RNA 提取和mRNA 纯化 按照Invitrogen 公司提供的操作指南提取总RNA,然后用RNase-free DNaseI 进行处理,随后按照mRNA 纯化试剂盒说明书要求纯化mRNA,用琼脂糖凝胶电泳和紫外分光光度计检测总RNA 的完整性和纯度.
1.3.3 消减杂交文库的构建 参照消减文库试剂盒说明进行.将实验组(tester)和驱动组(driver)的cDNA用RsaⅠ酶酶切和连接头,2 组混合经2 次液相杂交和2 次PCR 扩增,最后将PCR 产物插入到pMD-18T载体中,导入感受态细胞JM109,构建成cDNA消减杂交文库.
1.3.4 斑点杂交筛选 用巢式PCR引物对插入的cDNA进行扩增后,按照DIG High Primer Kit 说明进行斑点杂交,进一步去除假阳性克隆.
1.3.5 测序和序列分析 将点杂交阳性克隆送华大基因公司测序,用DNA Star软件将测序序列除去两端载体序列和接头序列,即得到EST 序列;用PHRAP拼接程序将预处理后的EST序列进行聚类分析、数据拼接.将ESTs 提交到Genbank(http:/ /www.ncbi.nlm.nih.gov.)的BLASTN 和BLASTX,对拼接后所得非冗余序列进行同源性比对,确定各序列对应的基因功能.使用KEGG 数据库(http:/ /www.genome.jp/kegg/)和AMIGO(http:/ /amigo.geneontology.org/cgi - bin/amigo/go.cgi)对所得ESTs进行基因功能分析,全部ESTs 提交NCBI 的dbEST数据库.
1.3.6 差异表达基因的荧光定量检测 随机抽取9 个EST序列,使用Primer 5.0 软件设计特异性定量PCR引物,在NCBI数据库中进行引物特异性比对,引物具体信息见表1.以TAF5、UBE3A 和RPL22e为内参基因,用qRT -PCR 对差异表达基因进行验证.反应体系(25 μL)为:1 μL cDNA、12.5 μL SYBR®Premix Ex TaqTM II(2 ×)、上下游引物(10 μmol/L)各0.5和10.5 μL 水.反应体系为:95 ℃预变性10 min;然后95 ℃变性15 s,58 ℃退火30 s,72 ℃延伸30 s进行42 个循环,添加熔解曲线,确保扩增产物的特异性,每个样品重复测定3次.采用IQ5 软件对qRT-PCR得到的试验数据进行分析.

表1 qRT-PCR分析中的基因的引物序列Tab.1 The primers of selected genes analyzed by qRT-PCR
2 结果
2.1 RNA的检测经紫外分光光度计检测,tester和driver总RNA的A260/A280比值在1.85 ~2.0之间,表明纯度较高.经质量分数1%琼脂糖凝胶电泳鉴定,总RNA的18S和28S rRNA条带清楚,无任何拖尾现象,表明没有发生降解,完整性好(图1).用紫外分光光度计测定分离的mRNA,其A260/A280 比值在1.9 ~2.0 之间,mRNA 总量为3.0 μg,表明mRNA的纯度和质量满足构建文库的要求.
2.2 斑点杂交分别以正向消减和反向消减的cDNA作为正向和反向探针,利用斑点杂交对本文库中的1 500 个克隆进行筛选,在正向探针的杂交结果中显示为阳性信号,而在反向探针的杂交结果中显示为阴性信号或正向探针杂交信号明显强于反向探针杂交信号的克隆作为阳性克隆(图2).经过筛选,选出阳性克隆285 个.

图1 总RNA凝胶电泳鉴定Fig.1 The electrophoresis identification of total RNA

图2 斑点杂交结果Fig.2 Differential screening of positive clones by dot blotting
2.3 测序结果和分析对文库中的285 个差异表达克隆进行测序分析.利用DNAStar和PHRAP软件对EST序列去除载体序列和接头序列,聚类分析、数据拼接,共拼接成130条ESTs,其中72条singletons,58条contigs,将处理后的ESTs提交到Genbank进行blastn比对.在130条ESTs中,34条(26%)与假设蛋白质基因有同源性;51 条(39%)与已知功能蛋白基因有同源性;而剩下的45 条(35%)与数据库中的序列没有发现同源性,可能代表了新的未知功能基因(图3).对51 条己知功能的同源ESTs 进行功能分析,这些基因涉及多种代谢和应答过程,如生物调控、应激反应和解毒、信号转导、代谢和合成等(表2).所有ESTs提交到NCBI中的dbEST数据库,序列号为JZ139169-JZ139298.

图3 130 条ESTs序列的功能分类Fig.3 Functional classification of 130 ESTs
2.4 差异表达基因的qRT -PCR 检测为了准确鉴定SSH 文库中差异表达基因的可靠性,使用qRT -PCR分析9个EST序列在第6—10天和第21—25 天的雄性成虫中的表达变化.在这些EST序列中,有3 个基因是编码已知蛋白的基因,分别预测的是转录因子myb(JZ139170)、细胞色素P450单加氧酶(JZ139184)、异柠檬酸脱氢酶(JZ139199)和3 个假设蛋白质基因JZ139223、JZ139225、JZ139236);其余3 个基因是未知功能基因.结果显示这9 个基因在雄性成虫不同发育阶段的表达水平差异从(3.8 ±1.1)倍到(14.5 ±2.1)倍变化,差异显著(图4).

表2 部分ESTs与已知基因的同源性比较Tab.2 Partial ESTs similarity analysis by comparing with the identified function genes in Genbank
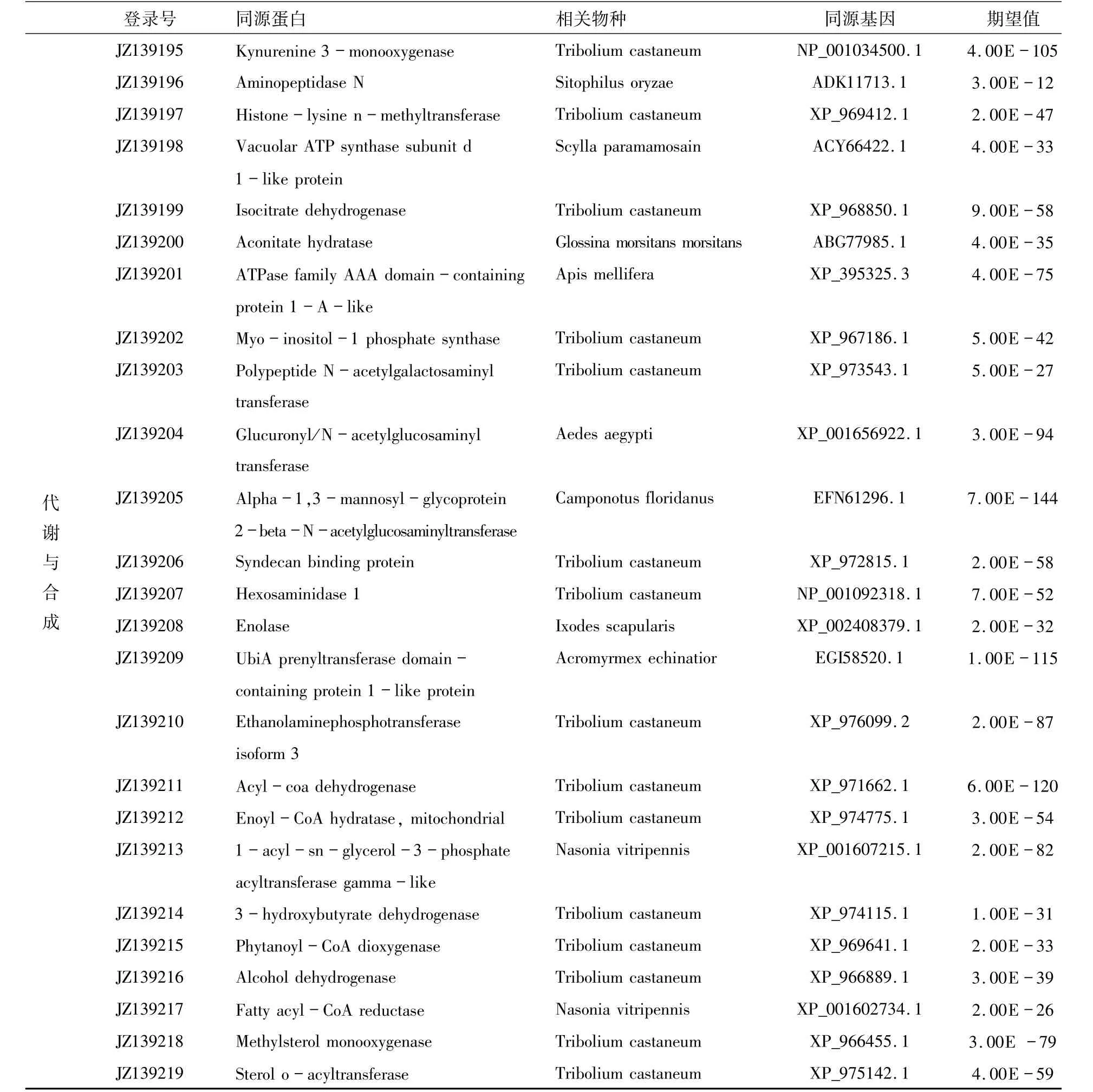
表2 (续)

图4 差异表达基因的qRT-PCR分析Fig.4 qRT-PCR analysis of differentially expressed genes
3 讨论
通过构建SSH文库,共筛选到130 个在眼斑芫菁雄性成虫斑蝥素合成高峰期特异表达的基因,其中65%的ESTs与NR库中的蛋白质有高度的同源性,涉及多种代谢和应答过程,如生物调控、应激反应和解毒、信号转导、代谢与合成等,表明芫菁体内斑蝥素的合成是由多种蛋白质参与的复杂过程.而35%的ESTs与数据库中的序列没有发现同源性,可能代表了新的未知功能基因,由于目前昆虫的遗传信息比较缺乏,而鞘翅目昆虫的遗传背景更为缺失,因此这些基因的功能尚不清楚.
现有研究表明斑蝥素是一类倍半萜的衍生物,而倍半萜的形成需要通过甲羟戊酸途径(MVA)[8-10].此外,McCormick 等[11]以原野豆芫菁雄性为材料,同位素18O 标记氧气或水的实验证明,原野豆芫菁的斑蝥素是由降解的法尼醇的碳骨架生成,斑蝥素中的四氢呋喃环上的氧原子及另外2 个氧原子都来自分子氧,另外一个氧原子来自于水,并提示斑蝥素可能是保幼激素(JH)的代谢产物.本文库中也发现了几个参与倍半萜合成及JH合成代谢的相关基因,这些基因可能参与了斑蝥素的合成.异戊烯基转移酶基因,它能催化异戊烯醇焦磷酸(IPP)与二甲烯丙基二磷酸(DMAPP)合成牻牛儿焦磷酸(GPP),IPP和GPP被催化生成法尼焦磷酸(FPP);FPP是合成倍半萜、法尼醇和JH 的前体物质,倍半萜又能参与昆虫防御物质及激素的合成[12].本实验室已经克隆到该基因的全长序列,在斑蝥素合成持续增长期内(第5—25 天),该基因在雄虫体内的表达量也不断升高并达到最大,而雌虫的该基因在斑蝥素合成旺盛期(第22—25 天)的表达量极低,表明该基因在斑蝥素合成途径中可能发挥重要作用[13].EST(JZ139216)编码乙醇脱氢酶,它能氧化法尼醇和法尼醛.法尼醇转化为法尼醛、法尼醛转化为法尼酸是JH 合成途径中的2 个关键反应[14].EST(JZ139184)编码细胞色素P450单氧酶,该酶不仅在昆虫解毒中发挥重要作用,而且在一些昆虫中细胞色素P450 单氧酶能使甲基法尼醇环氧化,有助于JH合成[15-16].同时,还有一个EST(JZ139186)编码保幼激素酯酶(JHE),它参与JH 代谢,可以在昆虫的不同时期调节JH 的水平[17].
本研究不仅丰富了眼斑芫菁的遗传信息,而且发现一些与斑蝥素合成的相关基因,这些基因可能在调控斑蝥素合成中发挥重要作用.本实验室正在采用基因敲除、RNA 干扰[18]等技术对这些相关基因进行功能验证,为最终揭示斑蝥素的合成机理奠定基础.
