卵巢癌患者血清CEA、SCCA和Cyfra21-1含量的检测价值
2020-03-07午翔向林李楠
午 翔 向 林 李 楠
卵巢癌是妇科的常见病,由于卵巢位于盆腔深部,起病隐匿,早期病变难以发现,约70%的卵巢癌患者在首次就诊时已属晚期,因此生存率在30%以下[1-2]。根据卵巢癌的病理特征可分为良性、交界性、恶性肿瘤[3]。卵巢交界性肿瘤与上皮性卵巢癌相比,其是一种低度恶性潜能的肿瘤,预后显著优于上皮性卵巢癌[4-5]。肿瘤标志物是一类癌症患者的血液、尿液或者体液中出现的异于正常人的特殊生化物,可以起到早期筛查癌症的作用,但并不是所有的癌症在早期都会表现出肿瘤标志物的异常[6]。癌胚抗原(carcinoembryonic antigen,CEA)为常见的肿瘤标志物,但是诊断的特异性一直不太高,鉴别能力不强[7]。鳞状细胞癌相关抗原(squamous cell carcinoma associated antigen,SCCA)从子宫颈鳞状上皮中分离出来的鳞状上皮相关抗原亚单位糖蛋白,可参与肿瘤的淋巴结浸润[8-9]。细胞角蛋白19片段抗原(CYFRA21-1)与卵巢癌的诊断密切相关,对卵巢癌的诊断有较大意义[10-11]。本文具体探讨了CEA、SCCA和Cyfra21-1在卵巢癌诊断中的临床意义,明确其对卵巢交界性肿瘤与上皮性卵巢癌的鉴别价值。现总结报告如下。
1 资料与方法
1.1 一般资料
采用回顾性研究方法,2016年8月到2018年6月选择在我院诊治的卵巢交界性肿瘤40例(交界组)和上皮性卵巢癌90例(卵巢癌组),纳入标准:组织病理学确诊为卵巢交界性肿瘤或上皮性卵巢癌;临床与病理资料完整;年龄20~60岁;患者检查前未接受放、化疗;医院伦理委员会批准了此次研究;单侧发病。排除标准:临床与病理资料缺项者;妊娠与哺乳期妇女;心、肝、肾等重要脏器障碍者;合并输卵管积水及子宫器质性病变者;其他部位恶性肿瘤的转移。
交界组中,卵泡膜纤维瘤24例,卵泡膜细胞瘤10例,囊性腺纤维瘤6例;年龄最小24岁,最大56岁,平均年龄(45.22±2.19)岁;平均体重指数(22.85±1.49)kg/m2;平均病程(2.49±0.22)年。
卵巢癌组中,浆液性腺癌46例,黏液性腺癌40例,支持细胞瘤4例;年龄23~59岁,平均年龄(45.99±1.38)岁;平均体重指数(22.32±2.91)kg/m2;平均病程(4.29±0.52)年;病理分期:Ⅰ期40例,Ⅱ期44例,Ⅲ期6例;分化程度:低分化22例,中分化28例,高分化40例;淋巴结转移15例,无转移75例。
1.2 血清CEA、SCCA和Cyfra21-1检测
所有患者在禁食12 h与禁饮8 h起空腹抽取静脉血4 ml,静置30 min,混匀后3 000 rpm离心10 min,分离上层血清,将其置于-80 ℃冰箱保存待测。
采用电化学发光免疫分析法检测血CEA、SCCA和Cyfra21-1含量,试剂盒来自美国罗氏公司,仪器型号为雅培ARCHITECTI2000全自动化学发光仪,质控品为其配套试剂,均严格按照试剂盒中说明进行。
1.3 阳性标准
CEA>5 ng/ml,SCCA>1.5 ng/ml,Cyfra21-1>3.3 ng/ ml。
1.4 统计方法
应用SPSS 22.00软件包进行统计学分析,计量数据以均数±标准差表示,计数数据以%表示,对比为t检验与卡方χ2分析,相关性分析采用Spearman等级相关分析,根据受试者工作特征曲线(receiver operating characteristic curve,ROC曲线)分析确定鉴别诊断价值,检验水准为α=0.05。
2 结果
2.1 血清CEA、SCCA和Cyfra21-1含量对比
卵巢癌组的血清CEA、SCCA和Cyfra21-1含量都显著高于交界组(P<0.05)。见表1。
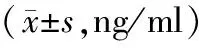
表1 2组血清CEA、SCCA和Cyfra21-1含量
2.2 CEA、SCCA和Cyfra21-1阳性表达率对比
卵巢癌组的CEA、SCCA和Cyfra21-1阳性表达率分别为95.0%、80.0%、90.0%,显著高于交界组37.8%、36.7%、30.0%(P<0.05)。见表2。
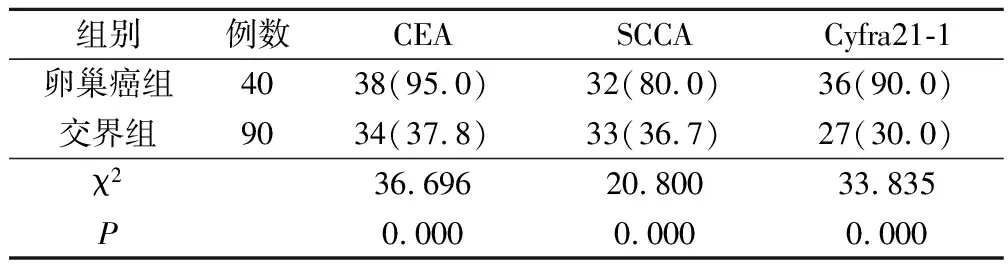
表2 2组CEA、SCCA和Cyfra21-1阳性表达情况对比(例,%)
2.3 相关性分析显示
在90例卵巢癌患者中,Spearman等级相关分析显示CEA、SCCA和Cyfra21-1阳性率与上皮性卵巢癌存在显著正相关性(P<0.05)。见表3。

表3 CEA、SCCA和Cyfra21-1与上皮性卵巢癌的相关性(n=90)
2.4 诊断价值
ROC曲线分析显示CEA、SCCA和Cyfra21-1鉴别诊断卵巢交界性肿瘤和上皮性卵巢癌曲线下最大面积分别为0.766、0.674、0.714。
3 讨论
卵巢癌是妇科最常见肿瘤之一,具有比较高的死亡率。卵巢交界性肿瘤是上皮性卵巢肿瘤的特殊病理类型,该病的组织学特点为缺乏破坏性的间质浸润,轻至中度不典型上皮增生,核分裂较少[12]。不过因其早期症状隐匿,缺乏有效的敏感而特异的早期诊断方法,多数的患者已进展为上皮性卵巢癌,预后比较差[13]。研究发现卵巢交界性肿瘤的5年生存率可达90%,而上皮性卵巢癌的5年生存率不到40%,为此早期鉴别上皮性卵巢癌具有重要价值[14]。
本研究显示卵巢癌组的血清CEA、SCCA和Cyfra21-1含量都显著高于交界组。肿瘤标志物是当前诊断癌症的有效标志物,并且由于对肿瘤标志物进行检测具有操作简单、可重复进行等优点。CEA是一种酸性糖蛋白,从结肠腺癌和胚结肠黏膜组织中分离而得,广泛应用于恶性肿瘤的鉴别诊断[15]。SCCA与恶性肿瘤的侵袭、转移、复发和预后有关,SCCA在健康人血清中的质量浓度比较低,由于恶性肿瘤的癌细胞释放SCCA增多,故SCCA在恶性肿瘤患者血清中的质量浓度升高[16]。Cyfra21-1是细胞角蛋白家族成员之一,当肿瘤细胞溶解或死亡时,细胞角蛋白19可溶性片段可进入血液循环,从而导致Cyfra21-1在血清中的表达量升高[17]。
卵巢交界性肿瘤占卵巢肿瘤的10%,是介于良性和恶性之间的卵巢肿瘤。肿瘤标志物可以起到早期筛查卵巢交界性肿瘤与上皮性卵巢癌的作用,但并不是所有的上皮性卵巢癌在早期都会表现出肿瘤标志物的异常[18]。本研究显示卵巢癌组的CEA、SCCA和Cyfra21-1阳性率分别为95.0%、80.0%、90.0%,显著高于交界组37.8%、36.7%、30.0%。SCCA分子量为48 kD左右,在正常的鳞状上皮细胞中可抑制细胞凋亡并参与鳞状上皮层的分化,当机体癌细胞增多时,可释放更多的SCCA[19]。Cyfra21-1 对肺鳞癌有较高的诊断价值,当肿瘤细胞溶解或坏死时,Cyfra21-1可释放到血液中,且与对非小细胞肺癌的预后预测有重要意义[20]。
肿瘤抑癌基因失活和癌基因突变协同作用可能在上皮性卵巢癌的发展中起关键性作用,经历了多步骤、多阶段、多因素、多基因变异参与的复杂的生物学演变过程,肿瘤标志物是检测上皮性卵巢癌与卵巢交界性肿瘤的一个重要辅助手段。本研究显示ROC曲线分析显示CEA、SCCA和Cyfra21-1鉴别诊断卵巢交界性肿瘤和上皮性卵巢癌曲线下最大面积分别为0.766,0.674,0.714,都具有一定的诊断价值。本研究也有一定的不足,没有明确上述指标鉴别诊断上皮性卵巢癌的最佳阈值,且诊断的效果也有待提高;样本数量也不足,导致诊断效用不足,将在下一步进行深入分析。同时卵巢癌是由不同表型及生物学特性的各细胞亚群组成,故在分泌肿瘤标志物的质和量上也各有差异[21-22],这也可说明为什么并不是所有的卵巢癌患者都存在血清CEA、SCCA和Cyfra21-1含量的升高。
总之,血清CEA、SCCA和Cyfra21-1在上皮性卵巢癌中呈现高表达状态,与卵巢癌的发生显著相关,可用来鉴别诊断卵巢交界性肿瘤和上皮性卵巢癌。
