tRNA影响肿瘤发生发展的研究进展
2020-03-06徐慧璇陈文标戴勇
徐慧璇,陈文标,戴勇
(暨南大学第二临床医学院 深圳市人民医院临床医学研究中心,广东 深圳518020)
转运RNA(transfer RNA,tRNA)自发现以来,一直受到科学家们的广泛关注。tRNA是细胞内主要的RNA分子之一,通常由73~93个核苷酸组成,其三级结构呈“倒 L”型。tRNA的经典功能是参与蛋白质合成,其3′端负责将相应的氨基酸携带进入核糖体,然后通过反密码子与信使RNA上的密码子相互配对识别,从而确保遗传信息的精确传递[1]。tRNA作为连接遗传信息和对应氨基酸之间的“接头分子”,是蛋白质合成中的关键生物大分子之一。近年来,肿瘤相关因子的鉴定已经成为研究热点,有助于了解肿瘤发生的基本机制,并为发现相关的治疗靶点提供依据。近年来的研究表明,tRNA可以通过加速转录翻译调控和提供对肿瘤代谢有高需求的分子而在肿瘤发生、发展中发挥重要作用[2-4]。此外,tRNA与其他小非编码RNA分子相似,具有组织特异性、相对稳定性[5]。因此,基于tRNA的非侵袭性生物标志物在肿瘤诊断中具有广阔的应用前景。现就tRNA影响肿瘤发生、发展的研究进展予以综述,旨在更好地了解肿瘤的发病机制和提供对肿瘤研究新的切入点,为肿瘤个性化治疗的开展奠定生物化学基础。
1 tRNA的表达水平与肿瘤

2 tRNA衍生物与肿瘤
在性激素、缺氧等应激条件的作用下,tRNA的反密码子环特异性地剪接成tRNA半分子(tRNA halves,tiRNA)[14-15]。tRNA衍生片段(tRNA-derived RNA fragment,tRF)和tiRNA由成熟的tRNA或其前体tRNA在不同位点特异性剪切产生,它们是一类广泛存在于原核生物和真核生物转录组中的非编码小RNA分子;tRF主要有tRF-5、tRF-3和tRF-1三个亚类,分别来自成熟tRNA的D环至反密码环茎区间切割至5′端、T环开始至3′端和前体tRNA的 3′端尾部,其长度为14~30个核苷酸;tiRNA主要有5′tiRNA和3′tiRNA两个亚类,是在成熟tRNA反密码子环处切割分别产生,其长度为29~50个核苷酸[15-16]。而另一类具有生物学功能的tRNA降解产物——tRNA来源的小tRNA(tRNA-derived small RNA,tsRNA)逐渐被熟知[17]。tRFs和tiRNAs在肿瘤、代谢疾病和神经系统疾病等重大疾病中具有重要的调控功能。在肿瘤细胞中,与应激有关的tRNA裂解作用可导致细胞凋亡失衡和促进肿瘤细胞增殖,前列腺癌细胞中与应激相关的tRFs和tiRNAs的表达量与前列腺癌细胞的增殖率呈正相关[18]。tRFs和tiRNAs作为基因表达的调节者,通过结合蛋白质影响信使RNA的稳定性[19];tRF与tiRNA可以作为父代表观遗传因子,改变子代基因转录级联过程[20-21]。
现已发现,tiRNA和tRF与人类多种肿瘤密切相关,tiRNA中与肿瘤关系最密切的是5′tiRNA,5′tiRNA可以促进骨肉瘤细胞内应激颗粒的组装[22],而应激颗粒是一种细胞质核糖核蛋白,在应激诱导的转移抑制、细胞修复及细胞生存相关蛋白转移中起重要作用,故可推断5′tiRNA可以帮助肿瘤细胞对抗应激条件下的不利生长环境。5′tiRNA 也是性激素依赖的产物,可以催化并通过细胞增殖,导致乳腺癌及前列腺癌等性激素相关肿瘤的发生[2,23]。而更具有小分子非编码RNA特性的tRF,可以影响靶基因的转录水平,并且在人体内含量仅次于信使RNA,是科学家们公认的有望成为非侵袭性生物标志物的小分子物质[19]。目前通过高通量测序技术,已经在精子外泌体中发现了tRFs[24]。研究发现,tRFs和tiRNAs在体液中高度富集,有时甚至高于微RNA[25]。Dhahbi等[26]研究发现血清中存在大量的tiRNA复合物。因此,开展微创方法用于肿瘤患者体液中tRF和tiRNA的检测具有一定的可行性。
研究表明,受原癌基因与抑癌基因的影响,肿瘤细胞中前体tRNA转录受到调控,而前体tRNAs的表达异常可能导致肿瘤中tRF和tiRNA的失调[27]。而tRF和tiRNA失调通过调控转录翻译过程参与了癌细胞的增殖、转移和侵袭。首先,tRNA衍生物是核糖体RNA和蛋白质生物合成的重要调控因子[28]。Kim等[17]发现,LeuCAG3 tsRNA(携带亮氨酸的反密码子为CAG的tsRNA)通过结合RPS(ribosomal protein related genes)28和RPS15,促进其靶信使RNA翻译,从而促进癌细胞增殖。研究表明,肝癌患者肿瘤中LeuCAG3 tsRNA的表达上调,而人为增加癌细胞中LeuCAG3 tsRNA的水平可以提高癌细胞的存活率,反之抑制LeuCAG3 tsRNA可诱导肝癌细胞凋亡,通过腹腔注射与LeuCAG3 tsRNA互补的反义寡核苷酸靶向抑制LeuCAG3 tsRNA表达,可导致腹腔肝转移瘤缩小[3]。另一方面,在癌细胞中一些tRF通过与AGO(argonaute)蛋白质结合,发挥其作为miRNA的基因沉默作用[17]。以上研究解释了tRNA衍生物在转录后机制调节基因的表达,为癌症治疗提供了新的机会。其次,tRF和tiRNA通过结合RNA结合蛋白调控基因表达。Castello等[29]发现的第一个RNA结合蛋白图谱显示,在生物世界中至少有300个RNA结合蛋白,其中大约一半由已知的癌症或疾病突变编码;Goodarzi等[30]发现,tRNAAsp、tRNAGlu、tRNATyr、tRNAGly等来源的tRFs与乳腺癌细胞中一些内源性原癌基因转录本竞争性与Y-盒结合蛋白结合。Y-盒结合蛋白是一种具有多种生物学功能的RNA结合蛋白,通过与一些内源性原癌基因转录本结合,导致癌细胞增殖,Y-盒结合蛋白-原癌基因转录复合物解离时,原癌基因转录的稳定性受到干扰,此时,原癌基因的表达降低,进而抑制癌细胞的生长[31]。最后,tRF和tiRNA调节蛋白激酶活性。Shao等[32]发现,tRFLeu CAG在非小细胞肺癌中调控细胞增殖和细胞周期进展,当tRFLeu CAG的表达下调时,Aurora激酶A(aurora kinase A,AURKA)的表达被抑制。AURKA是一种丝氨酸/苏氨酸激酶,在有丝分裂中起重要作用,它与中心体成熟和分离有关,调节主轴的装配和稳定性。既往研究表明,miR-137和miR-32直接与AURKA结合,影响非小细胞肺癌的进展[33-34]。tRFLeu CAG的过度表达增加了AURKA的活性,进而促进非小细胞肺癌细胞G0/G1期细胞周期的进展[32]。这意味着tRFLeu CAG可通过调节AURKA的表达调控细胞周期进展影响非小细胞肺癌的进展。
此外,tRNA衍生物还可以通过影响信使RNA的稳定性、调节逆转录、抑制翻译和调节核糖体生物发生来影响癌症的发生、发展[35-36]。
3 tRNA修饰与肿瘤
在细胞内,直接由转录产生的tRNA前体并不能直接行使其功能,需要经过一系列的剪接和转录后修饰等加工过程才能形成具有生物学功能的成熟tRNA。tRNA是含有转录后修饰核苷酸数目和类型最多的非编码小RNA[37]。基因组中1%~10%基因编码的蛋白质参与tRNA 核苷酸修饰过程,远多于编码tRNA本身的基因数目[21]。tRNA核苷酸修饰是tRNA参与精准信号转导和精确调节tRNA参与的转录调控及蛋白质翻译的物质基础,参与翻译过程、信号转导、细胞应激等多方面的生物功能,对维持细胞生长代谢有重要作用[38-42]。tRNA核苷酸修饰的缺失甚至导致细胞死亡和相关人类疾病。tRNA修饰与不同类型的癌症(如皮肤癌、乳腺癌、膀胱癌)存在直接联系(表1)。
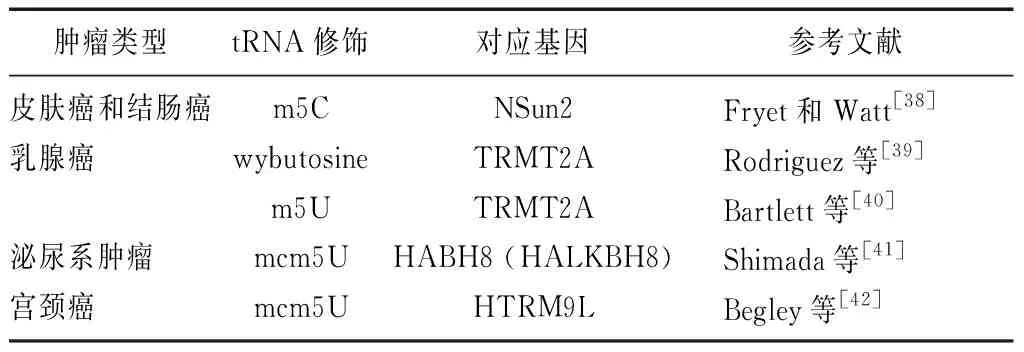
表1 tRNA修饰与肿瘤
tRNA:转运RNA
RNA甲基转移酶Misu(RNA methyltransferase Misu,NSun2)是由原癌基因Myc的下游靶点Misu编码的一种tRNA甲基转移酶,与Myc诱导的细胞增殖和细胞周期提前有关,NSun2在正常组织中表达水平较低,但在一些人类和小鼠肿瘤细胞中表达丰富,如鳞状细胞癌、结直肠癌和乳腺癌[38]。实验证明,人为降低NSun2表达可以减少小鼠中人类鳞状细胞癌异种移植物的生长[11]。
还有其他tRNA修饰酶与肿瘤相关。tRNA甲基转移酶12是tRNAPhe位点37处参与wybutosine碱基(yW)形成的酶[43]。目前,测定体内tRNA甲基转移酶2A(酵母菌Trm2p同源物)表达,可以协同乳房钼靶检查作为预测三苯氧胺治疗后乳腺癌复发的预测工具[40]。氮杂胞苷是目前正在研发的一种用于表观遗传癌症治疗的药物,其原理之一是通过抑制由DNA甲基转移酶2催化的tRNAAsp的胞嘧啶甲基化抑制肿瘤细胞的发生、发展[44-45]。随着对细胞代谢过程中tRNA修饰研究的深入,tRNA 核苷酸修饰参与肿瘤发生、发展的生理过程日益清晰,为新型肿瘤标志物的产生及相关靶向治疗药物提供了新的思路。
4 tRNA氨酰化与肿瘤
哺乳动物细胞含有一系列细胞质和线粒体的氨基酰-tRNA合成酶(aminoacyl-tRNA synthetases,ARSs),它们负责细胞蛋白的合成、催化氨基酸与同源tRNA的高保真度连接。ARSs作为一种将信使RNA转化为蛋白质的分子适配器,存在于最原始的原核生物中。底物氨基酸与其同源tRNA的连接过程分为两个步骤:第一步是ARSs催化下的底物氨基酸活化,生成氨基酰-AMP-E,消耗1个ATP分子;第二步是将活化的氨基酸传递到tRNAs的受体端[1]。这种反应的保真度依赖于ARSs对底物氨基酸和tRNA的准确识别及活性校正,它能水解错配的氨基酸,并替换与反密码子相对应的氨基酸。
尽管一些ARSs表现出与肿痛相关的过表达[46-47],但尚不清楚这种表达增加是由于癌细胞对蛋白质合成的需求增加还是ARSs本身就是引起细胞转化的驱动因素。以甲硫氨酸-tRNA合成酶(methionyl-tRNA synthetase,MRS)为例,MRS在人结肠癌中的催化活性增加,目前已有研究发现MRS反应产物tRNAiMet的过度表达可导致原癌基因转化[11]。MRS在恶性纤维组织细胞瘤、肉瘤、恶性胶质瘤和胶质母细胞瘤等不同类型的肿瘤中过表达[48-49]。这些肿瘤具有染色体12q13位点的扩增,其中编码MRS基因与编码重组人CCAAT增强子结合蛋白转录因子基因重叠,这种扩增可能导致MRS和内质网应激相关蛋白的过表达,这可能产生促进肿瘤进展的有利环境[50]。
色氨酰tRNA合成酶(tryptophanyl-tRNA synthetase,WRS)通过催化色氨酸与其对应的tRNA结合,增加细胞内色氨酰tRNA储备,竞争性抑制吲哚胺2,3双加氧酶介导的色氨酸消耗,与恶性肿瘤的发生、发展和预后密切相关[51]。吲哚胺2,3双加氧酶是催化色氨酸沿犬尿氨酸途径分解代谢的限速酶,其高表达在抑制T细胞免疫、诱导肿瘤免疫耐受中发挥重要的调节作用;另一方面,WRS具有抗血管生成的作用,可能在肿瘤微环境中发挥作用[52]。越来越多证据表明,WRS的低表达水平与结肠癌、患者复发风险的增加及生存期的降低有关[6,53]。这可能与WRS参与肿瘤免疫耐受及抗血管作用相关,为抗肿瘤药物的开发提供了新的切入点。
5 小 结
人类细胞中有49种同工tRNA,参与蛋白质合成的过程。这些非编码小RNA分子具有复杂的生理功能,在肿瘤等疾病中发挥着重要的作用。tRNA衍生物可以通过影响核糖体RNA合成、结合RNA结合蛋白、调节蛋白激酶活性参与肿瘤发生、发展过程;而一些tRNA修饰酶在肿瘤患者中过度表达,并开始用于预测复发风险及肿瘤靶向治疗。ARSs的催化活性直接影响蛋白质合成的速度和准确性,其作为控制血管生成和免疫反应的细胞因子也可能在肿瘤微环境中发挥作用。此外,某些特定tRNA还可以对基因进行调控。线粒体tRNA突变等也参与了肿瘤的发生。总之,tRNA与肿瘤关系十分密切,参与肿瘤的发生、发展,可能成为肿瘤诊断的新标志物。
