土鳖虫活性肽组分对急性血瘀模型大鼠血液流变学、血脂四项指标及血液因子含量的影响
2020-03-06王少平张加余刘子菡王喻淇
姜 珊 王少平 代 龙 张加余 高 鹏 刘子菡 王喻淇
(1. 滨州医学院,山东 烟台 264003; 2. 山东中医药大学,山东 济南 250300;3. 北京中医药大学,北京 102488)
土鳖虫为鳖蠊科昆虫地鳖或冀地鳖的雌虫干燥体,为中医临床传统用药。其最早记载于《神农本草经》[1],又称土元、土鳖子、地乌龟,能活血逐瘀、续筋接骨,临床主要用于跌打损伤、筋损骨折、血瘀经闭以及产后血瘀腹痛等症[2]。土鳖虫蛋白质含量占总虫体质量的60%,且所含的氨基酸种类完整,几乎包括构成蛋白质的所有氨基酸[3]。但是,大分子蛋白无法被人体吸收,只能经过胃肠道蛋白消化酶的作用转变为小分子活性肽后方能发挥药效[4-7]。仿生酶解动物蛋白制备的活性物质主要以小肽或寡肽形式存在,被认为是动物类中药真正起效的物质基础[8-10]。
中医“血瘀证”是一类疾病的统称,主要包括高血脂、高血压、血管狭窄、动脉粥样硬化和脑血栓等病症。其病理表现为全血黏度上升、血细胞压积升高、血小板聚集性增强、电泳时间加长、血管功能失调、促血管生成因子减少、自由基增加和局部组织缺血造成坏死等[11-12]。
据报道[13],土鳖虫体内含有具有纤溶活性的物质,具有显著的活血化瘀功效。目前大部分研究[14-16]是关于土鳖虫干粉和土鳖虫蛋白质具有纤溶活性的报道,土鳖虫乙醇(水)提取物均可以改善大鼠机体凝血因子、抗氧化/氧化因子的水平,并促进血管生成。韩雅莉等[17]从地鳖虫中分离出3种具有纤溶活性的蛋白质EFF1、EFF2和EFF3,其中EFF2活性最强。而土鳖虫活性肽是由土鳖虫蛋白质经仿生酶解而来,结合蛋白质体内消化过程,推断土鳖虫活性肽具有纤溶活性。但是以土鳖虫活性肽为材料研究其对“血瘀证”的作用机制未见报道。同时对于土鳖虫活性肽中存在的活性小肽组分也没有明确信息。
试验拟以土鳖虫活性肽为研究材料,基于多种分离方式联合检测手段并行的原则,分离纯化获得土鳖虫活性肽组分,并探讨分离组分对急性血瘀模型大鼠血液流变学、血脂四项指标及血液因子含量的影响,为动物药治疗血瘀证提供新的研究思路和试验依据。
1 材料与方法
1.1 动物、材料与试剂
土鳖虫药材:中华冀地鳖[Steleophagaplancyi(Boleny)],山东省长清土元养殖公司;
SD大鼠:8周龄,体重180~200 g,许可证号SCXK(鲁)20140007,山东济南朋悦实验动物有限公司;
凝血酶:500 U/g,深圳生化制剂厂;
牛血纤维蛋白原:纯度95.3%,沈阳拜英生物科技有限公司;
胃蛋白酶(2 500 U/mg)、胰蛋白酶(5 000 U/mg):上海国药试剂集团有限公司;
大孔吸附树脂:DA201-C型,沧州宝恩树脂有限公司;
Sephadex G25:南京海克尔生物科技有限公司;
T-CHO、TG、HDL和LDL试剂盒:南京建成生物工程研究所有限公司;
NO、SOD、t-PA和FIBELISA试剂盒:上海酶联生物科技公司。
1.2 仪器与设备
恒温培养箱:BPH-9082型,上海一恒科学仪器有限公司;
恒温水浴锅:HH-601型,镇江瑞祥仪器有限公司;
十万分之一天平:MS104型,梅特勒—托利多国际贸易(上海)有限公司;
超声振荡仪:KQ2200DV型,杭州法兰特超声波科技有限公司;
全自动血细胞分析仪:LH 750型,贝克曼库尔特中国仪器公司;
恒温旋转仪:N-1100VEYeLa型,日本东京理化仪器公司;
多功能电导仪:FE30型,梅特勒—托利多(上海)精密仪器公司;
小型电渗析仪:LH320型,辽宁金科水处理有效公司;
膜处理设备:DKH-43型,上海陶氏膜处理集团。
1.3 方法
1.3.1 土鳖虫活性肽的制备 根据课题组[18]前期的研究,取土鳖虫药材(过80目筛)500 g,加10倍量去离子水,加热至沸,放至室温。用稀盐酸调pH至2.0,加1%胃蛋白酶,37 ℃酶解1.0 h;再用氢氧化钠溶液调pH至9.0,加1%胰蛋白酶,酶解3.0 h后加热灭酶15 min,放凉后冷藏12 h,离心,收集上清液。调整上清液浓度到500 mg/mL,pH值至6.5,分装入电渗析仪器内,平衡15 min 后进行除盐操作2.5 h,收集土鳖虫活性肽溶液,备用。
1.3.2 纤溶活性测定 采用尿激酶为对照药物进行体外纤溶活性测定[19],以溶圈面积为纵坐标,尿激酶活力(U)的对数为横坐标进行线性回归,建立标准曲线。
1.3.3 土鳖活性肽的分离纯化
(1) 超滤和纳滤分离:取土鳖虫活性肽溶液,用截留分子量为3 kDa的超滤膜和截留分子量为1 kDa纳滤膜进行分段,收集分子量>3,1~3,<1 kDa的酶解液,经冷冻干燥后进行纤溶活力测定,筛选出纤溶活力最高的组分。
(2) DA201-C型大孔吸附树脂分离:根据文献[20]修改如下,将1.3.3(1)获得的纤溶活性最高的组分离心过滤后,调整pH值至6.0,上样质量浓度为20 mg/mL,上样体积为0.02 BV,上样流速2 BV/h;上样结束后吸附3 h。再依次用去离子水、25%乙醇溶液、50%乙醇溶液、75%乙醇溶液进行洗脱,收集各洗脱液后分别冻干后测定纤溶活性。
(3) 葡聚糖凝胶G-25分离:将1.3.3(2)获得的纤溶活性最高的组分用去离子水溶解后上样,上样质量浓度为10 mg/mL,上样体积为0.02 BV,用去离子水进行洗脱,流速为0.2 mL/min,每1.0 mL收集一试管,采用可见—紫外分光光度仪检测每个试管在220 nm下的吸光度(A),至最后几个试管的吸光度和去离子水相同时停止洗脱。将各洗脱峰分别冻干并测定纤溶活性。
(4) RP-HPLC分离:将1.3.3(3)获得的纤溶活性最高组分采用RP-HPLC进行分离纯化。色谱条件:色谱柱为Agilent BOZAX300SB-C18肽色谱柱;检测波长220 nm;流速1.0 mL/min;流动相A为乙腈(含0.1%三氟乙酸),流动相B为纯水(0.1%三氟乙酸),梯度洗脱方法为0~50 min,95% B~50% B;50~65 min,50% B~95% B;进样量50 μL。对各洗脱峰进行制备,冻干后进行纤溶活性测定。
1.3.4 土鳖虫活性肽对急性血瘀模型大鼠的影响
(1) 急性血瘀大鼠造模及给药:根据文献[21]修改如下,90只雄性SD大鼠适应性饲养7 d后随机分为5组,即空白组、模型组、尿激酶阳性组、土鳖活性肽组分F2高剂量组、土鳖活性肽组分F2低剂量组。除空白组以外,其他组大鼠每天定量给予50 g高脂饲料和4.0 mL高脂乳剂,空白组大鼠给予普通饲料,持续45 d。同时,用高脂饲料和高脂乳剂饲养15 d后,每只老鼠肌肉注射0.2 mL 盐酸肾上腺素注射液(除空白组)。注射30 min后冷水浴(4 ℃)15 min,持续30 d造模。按照体表面积方法计算,尿激酶组给药剂量1.0×105U/kg,土鳖活性肽组分F2高、低剂量组按照预试验结果确定的给药浓度分别为50,25 mg/kg,模型组和空白组给予生理盐水。所有样品均用生理盐水溶解,肌内注射给药15 d,给药期间持续给予高脂饲料。
(2) 血液取样:末次给药5 h后,于大鼠腹主动脉取血3.0 mL,注入肝素钠的玻璃硅化管内,离心取血浆;同时取5.0 mL血液注入未加入抗凝剂的EP管,离心取血清。
(3) 生化指标测定:采用全血液自动分析仪、血流变分析仪对各组大鼠血浆进行血液流变指标检测,并测定血清中HDL/LDL、TG、T-CHO、SOD、NO、t-PA和FIB的含量。
1.4 数据统计与分析
所有数据采用SPSS 20.0和Graphpad Prism进行处理,试验数据为3个平行样品的平均值,以Mean±SD表示,LSD检验两两比较;若方差不齐,检验其差异性则采用H-G检验。
2 结果与分析
2.1 纤溶活性测定标准曲线
以溶圈面积为纵坐标,尿激酶活力的对数为横坐标得到的线性方程为Y=1.564X-1.863 5,R2=0.997 2,线性范围为1.337 6~5.987 1 cm2。

图1 标准曲线测定结果Figure 1 Standard curve measurement results
2.2 土鳖活性肽分离纯化
2.2.1 超滤和纳滤分离的活性肽 超滤试验结果表明,分子量>3 kDa活性肽溶液无纤溶活性,而分子量<3 kDa 活性肽溶液具有明显活性,因此对分子量<3 kDa活性肽溶液进行纳滤分离。如表1所示,分子量1~3 kDa 活性肽溶液和分子量<1 kDa活性肽溶液均有纤溶活性,但是分子量1~3 kDa活性肽溶液纤溶活性更强,对结果进行分析得出:<1 kDa活性肽溶液多为游离氨基酸,氨基酸并不能直接发挥活性作用,而>3 kDa活性肽溶液多为灭活后残留的胰蛋白酶、胃蛋白酶,几乎没有活性。1~3 kDa活性肽溶液多为活性肽集中存在区域,故选定该分子质量范围的酶解液进行分离纯化。
表1超滤和纳滤分离土鳖虫活性肽溶液纤溶活力
Table 1 Determination of fibrinolytic activity ofE.steleophagaactive peptide solution obtained by ultrafiltration and nanofiltration

土鳖活性肽溶液分子量/kDa溶圈面积/cm2活力/(U·g-1)>30.00000.00<31.53942997.76<11.10531582.121~32.00615959.35
2.2.2 DA201-C型吸附树脂、葡聚糖凝胶G-25和RP-HPLC分离的活性肽 DA201-C型吸附树脂处理后的去离子水洗脱液纤溶活性为0,可直接舍弃;其他3个洗脱组分的纤溶活性顺序为50%乙醇洗脱液(13 159.89 U/g)>25%乙醇洗脱液(4 107.95 U/g)>75%乙醇洗脱液(515.87 U/g)。说明DA201-C树脂分离的活性较强的肽多为中等极性。然后采用葡聚糖凝胶G-25对50%乙醇洗脱液进行分离纯化,获得的P1、P2和P3洗脱峰(图2)的纤溶活性分别为1 674.33,62 044.61,8 615.63 U/g,因此选定活性最强的P2洗脱组分继续分离纯化。由图3可知,经过RP-HPLC色谱柱分离后,可获得5个色谱峰(F1~F5)。其中,F2的纤溶活性(167 808.97 U/g)远大于其他峰,故选择土鳖虫生物活性肽F2进行药理试验。
2.3 土鳖虫活性肽组分F2对急性血瘀模型大鼠影响
2.3.1 血细胞、血液流变指标 如表2所示,尿激酶组大鼠红细胞压积、血小板计数明显降低,并与模型组比较具有显著性差异,说明尿激酶可以明显改善血液流动。土鳖虫活性肽组分F2高、低剂量组也具有使两项指标降低的作用,其中高剂量组与模型组差异显著(P<0.05)。对表3中血流变试验结果分析得出,尿激酶组对其改善效果较佳且与模型组比较具有极显著性差异(P<0.01)。土鳖虫活性肽组分F2高、低剂量组均能降低急性“血瘀证”大鼠在高、中、低切度下的血流变值,且与模型组相比具有极显著性差异(P<0.01),说明土鳖虫活性肽组分F2具有改善急性“血瘀证”大鼠的血液流变指标的作用。土鳖虫活性肽组分F2高、低剂量组除低切下具有差异外,其他切度下没有显著性差异,说明治疗效果和剂量间没有关系。
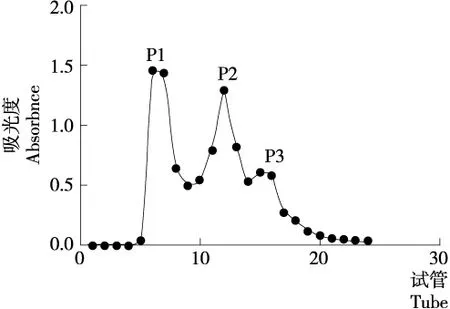
图2 葡聚糖凝胶G-25层析分离纯化结果Figure 2 Sephadex gel G-25 chromatography separation and purification results

图3 RP-HPLC分离图谱Figure 3 RP-HPLC liquid phase separation spectrum
2.3.2 血脂四项指标的检测 由图4可知,经过长期给予高脂喂养后,模型组大鼠血液内TG、T-CHO、HDL-C和LDL-C的含量较空白组明显上升,具有极显著性差异著性差异(P<0.01)。阳性药物尿激酶组明显降低大鼠血液内TG、T-CHO、HDL-C和LDL-C的含量。土鳖虫活性肽组分F2高、低剂量给药后,血脂四项均有下降趋势,与模型组比较具有显著性差异(P<0.05)。说明土鳖虫活性肽可下调高脂血大鼠血液内TG、T-CHO、HDL-C和LDL-C的含量。土鳖虫活性肽组分F2高、低剂量组之间差异不显著,说明治疗效果和剂量间相关性不明显。

表2 血细胞检测结果†Table 2 Blood cell test results
† **. 与空白组比有极显著性差异(P<0.01);△. 与模型组比有显著性差异(P<0.05),△△. 与模型组比有极显(P<0.01)。

表3 血液流变指标检测结果†Table 3 Blood rheology index test results
† **. 与空白组比有极显著性差异(P<0.01);△. 与模型组比有显著性差异(P<0.05),△△. 与模型组比有极显著性差异(P<0.01);●. 与低剂量组比有显著性差异(P<0.05)。
2.3.3 血液因子含量的测定 如图5所示,血清SOD含量测定结果表明,造模后模型组大鼠血清中SOD含量降低,只有(15.511 1±0.884 3) μmol/mL,与空白组比具有极显著差异(P<0.01)。连续给药后,尿激酶组和土鳖虫活性肽组分F2高、低剂量组大鼠血清中SOD含量均升高。其中,土鳖虫活性肽组分F2高剂量组与模型组大鼠相比具有极显著性差异(P<0.01)。
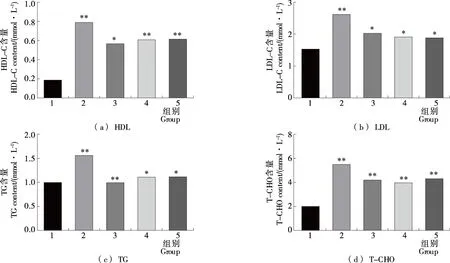
1. 空白组 2. 模型组 3. 尿激酶组 4. F2高剂量组 5. F2低剂量组 *. 与空白组相比有显著性差异(P<0.05) **. 与空白组相比有极显著差异(P<0.01)图4 各样本血清HDL、LDL、TG和T-CHO含量测定结果Figure 4 Results of serum HDL, LDL, TG and T-CHO determination in each sample
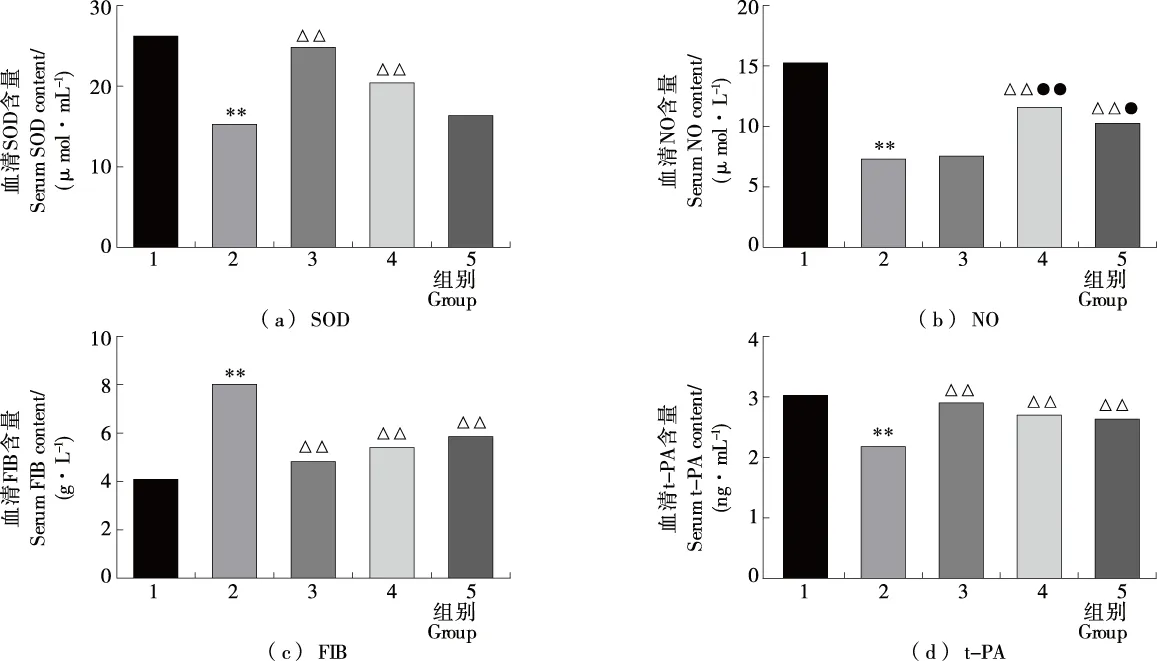
1. 空白组 2. 模型组 3. 尿激酶组 4. F2高剂量组 5. F2低剂量组 *. 与空白组相比有显著性差异(P<0.05) **. 与空白组相比有极显著差异(P<0.01) △△. 与模型组比有显著性差异(P<0.05) ●. 与尿激酶组比有显著性差异(P<0.05) ●●. 与尿激酶组比有极显著差异(P<0.01)图5 各样本血清SOD、NO、FIB和t-PA含量测定结果Figure 5 Results of determination of serum SOD, NO, FIB and t-PA in each sample
NO在体内作为血管扩张机动因子,主要起到扩张血管、降低血压、降低血黏度作用,为血瘀证改善的主要评价指标。血清中NO含量结果表明,急性血瘀证模型组大鼠血清NO含量比空白组大鼠NO含量降低明显,具有极显著性差异(P<0.01);连续给药治疗15 d后,各组大鼠血清NO含量均有升高,除尿激酶组外,其他各组与模型组均具有显著性差异(P<0.05)。考虑到尿激酶属于直接纤溶剂,并不具有调节血清NO功能。
血液内t-PA含量下降,造成FIB含量增加,使得大鼠具有形成血栓的潜在危险性。连续给药后,试验各组大鼠血清内t-PA含量增加,对应的纤维蛋白FIB含量减少,与模型组比,均具有显著性差异(P<0.05),说明恢复效果良好。其中,尿激酶作为t-PA直接作用药物,尿激酶组大鼠血清中t-PA含量恢复最好,基本达到了空白组水平,与模型组比较具有极显著性差异(P<0.01)。
以上说明,土鳖虫活性肽组分F2治疗“血瘀证”的机理可能是上调NO、t-PA,使血液内FIB含量减少,从而降低血液黏度,使血细胞指数下降。
3 结论
试验将分离纯化得到的纤溶活性肽进行药效研究,采用高脂乳剂灌胃+高脂饲料饲养并结合注射盐酸肾上腺素与冰水冷浴方法,复制大鼠急性血瘀证模型,以大鼠血细胞和血液流变分析,血脂四项(HDL、LDL、T-CHO、TG)为指标衡量土鳖虫活性肽组分F2的治疗作用,结果显示F2组分能显著降低大鼠血清内TG、T-CHO、HDL和LDL的含量,上调NO、t-PA使得FIB含量减少,从而降低血液黏度,改善血液流动性,土鳖虫活性肽F2组分对急性血瘀模型大鼠产生了影响。说明采用上述工艺对土鳖虫活性肽进行分离是可行的。同时也证明,土鳖虫活性肽可能是土鳖虫“活血化瘀”作用的重要物质。
试验过程也存在一些不足,如:最终分离组分F2的氨基酸组成是否与活性之间存在紧密联系,目前尚未知;分离组分F2究竟是通过哪种途径或者通路来调控相关因子含量,试验没有涉及。针对存在的问题,后期会对F2组分进行LC-MS分析,获得其氨基酸序列。并进行更加深入的研究,揭示其作用机制。
