4种胆盐水解酶在发酵乳杆菌AR497中的异源表达
2020-03-06印伯星石俊康孔令慧杨仁琴艾连中熊智强
印伯星 石俊康 孔令慧 杨仁琴 艾连中 熊智强
(1. 扬州大学实验农牧场,江苏 扬州 225009;2. 江苏省乳业生物工程技术研究中心,江苏 扬州 225004;3. 扬州市扬大康源乳业有限公司,江苏 扬州 225004;4. 上海理工大学医疗器械与食品学院,上海 200093;5. 上海食品微生物工程研究中心,上海 200093)
高胆固醇被认为是引起冠心病、高血压及脑中风的重要因素[1]。胆盐水解酶(bile salt hydrolase, BSH)是一种重要的降解胆固醇酶,能够结合胆盐释放游离氨基酸和非结合态胆酸,由于游离胆酸的重吸收利用率低,从而达到降低体内胆固醇的效果[2-3]。目前,从双歧杆菌、乳杆菌和球菌等乳酸菌属中发现的BSH基因具有降胆固醇和耐受胆盐功能[4]。Smet等[5-6]研究表明发酵乳杆菌(Lactobacillusfermentum)能降低血清胆固醇的重要原因是能够产生BSH。基于基因组学研究[7-8]发现不同乳酸菌中含有1~4个编码胆盐水解酶的BSH基因,分散在基因组不同位置上,其氨基酸相似度较低,仅为21%~39%。Lambert等[9]通过分别敲除植物乳杆菌WCFS1中的4个BSH同源基因,发现仅BSH1基因和植物乳杆菌的BSH活性密切相关,而其他3种BSH在植物乳杆菌不同菌株之间十分保守;Xiong等[10]从耐胆盐能力强的植物乳杆菌AR113中克隆4个BSH基因,在干酪乳杆菌中异源表达,证明4种BSH均有水解结合甘氨酸胆盐的能力。
发酵乳杆菌作为一种异型发酵乳酸菌,在食品工业中广泛应用。作为益生菌,发酵乳杆菌能减少由致病菌引起的胃肠道疾病发病率、调节免疫系统和降低患膀胱癌的风险[11-12]。由于胃肠道在运输过程中面临胆汁酸压力,因此迫切需要提升发酵乳杆菌的耐受性。尽管发酵乳杆菌中含有一个BSH基因,但发酵乳杆菌对胆盐的胁迫仍比较敏感。课题组前期[13]分离出一株具有优良生物学特性的发酵乳杆菌AR497,能有效改善小鼠肠炎。为提高该菌株耐胆汁和降胆固醇的益生功能,试验拟以AR497为宿主,表达来自植物乳杆菌AR113的4种BSH基因,从胆盐胁迫下菌株的生长状况、致死率和BSH酶活角度分析BSH基因异源表达的作用,为开发耐胆盐和降解胆固醇的乳酸菌基因工程菌提供依据。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒
所用菌株与质粒如表1所示。

表1 菌株与质粒Table 1 Bacterial strains and plasmids
1.1.2 试剂
质粒提取试剂盒:美国Axygen公司;
MRS培养基(牛肉膏5 g/L、酪蛋白胨10 g/L、酵母膏5 g/L、葡萄糖20 g/L、乙酸钠8.3 g/L、柠檬酸氢二胺2 g/L、K2HPO42 g/L、MgSO40.58 g/L、MnSO40.25 g/L、吐温80 1 mL/L、固体培养基另加琼脂粉15 g/L):分析纯,国药集团化学试剂有限公司;
MRSMC复苏培养基(0.8 mol/L山梨醇、20 mmol/L MgCl2、2 mmol/L CaCl2、MRS培养基):分析纯,国药集团化学试剂有限公司。
1.1.3 仪器与设备
分光光度计:DΜ-800型,德国Beckman公司;
电转化杯:2.0 mm型,美国BTX公司;
超微量核算蛋白测定仪:Nanodrop 2000型,赛默飞世尔科技公司;
厌氧培养箱:DG250型,英国Ruskinn公司;
电泳仪:Powerpacbasic型,美国Bio-Rad公司;
电泳槽:170-4486型,美国Bio-Rad公司;
凝胶成像仪:GelDocXR型,美国Bio-Rad公司;
PCR仪:S1000型,美国Bio-Rad公司;
冷冻离心机:3K30型,德国Sigma公司。
1.2 方法
1.2.1 发酵乳杆菌AR497感受态制备和重组质粒转化
将-80 ℃冰箱保存的AR497菌株进行活化培养,然后接种至含20 g/L甘氨酸的MRS培养基中培养至OD600 mm为0.3~0.4。收集菌体用10%甘油(体积分数)洗涤两次并重悬分装,-80 ℃保藏,电转化备用。从大肠杆菌中提取pMG36e(空质粒,对照)和含有不同BSH基因的重组质粒pMG-BSH1、pMG-BSH2、pMG-BSH3、pMG-BSH4和pMG-BSH1-3,将这些质粒分别与感受态细胞混匀,电击后加入MRSMC复苏培养基,37 ℃下培养4 h,收集菌体涂布于红霉素抗性平板,37 ℃厌氧培养48 h。挑取转化子进行菌落PCR鉴定,采用Em-F(5’-CGAAAAACAAGTTAAGGGATGCA-3’)/Em-R(5’-TCAGCACAGTTCATTATCAACCAAA-3’)引物,扩增条件为95 ℃预变性3 min,98 ℃变性10 s,55 ℃退火30 s,72 ℃延伸45 s,30个循环;72 ℃ 10 min。PCR产物通过琼脂糖凝胶电泳鉴定。
1.2.2 平板Ca2+沉淀法检测 配制含有0.37 g/L CaCl2的MRS固体培养基平板,加入终浓度5 mmol/L胆盐和100 μg/mL红霉素。取OD600 mm≈1.0的重组菌株菌液10 μL点涂于上述固体培养基平板上,每株菌3个平行。37 ℃厌氧培养48 h,观察培养基底部或菌落周围是否有白色沉淀圈产生。
1.2.3 重组菌株在胆盐胁迫下的生长 将重组菌株培养至OD600 mm≈1.0,3%接种量接种至含有100 μg/mL红霉素和0.0,0.5,1.0,1.5,2.0 mg/mL甘氨脱氧胆酸钠盐的MRS培养基中,检测20 h内菌株生长状况[14]。
1.2.4 重组菌株耐胆盐能力的测定 将重组菌株接种至含有100 μg/mL红霉素和0.0,0.5,1.0,1.5,2.0 mg/mL甘氨脱氧胆酸钠盐的MRS培养基中,培养12 h进行活菌计数。按式(1)计算致死率。
(1)
式中:
c——致死率,%;
m1——相应胆盐浓度下活菌数;
m2——普通MRS培养下活菌数。
1.2.5 BSH酶活的测定 通过水解结合胆盐释放的氨基酸量来衡量,即酶活力与氨基酸生成量呈正比。采用茚三酮显色法测定氨基酸含量[15-16]。样品超声破碎(200 W 破碎20 min,工作5 s,间隔10 s)后加入溶菌酶,使细胞壁裂解完全,参照文献[17]的方法测定上清液BSH活力。BSH酶活定义为每毫升菌体裂解上清液水解胆盐生成1 mmol氨基酸为一个活力单位。
1.3 数据分析
采用 Origin 8.0和GraphPad 5.0软件进行统计分析和作图。
2 结果与讨论
2.1 发酵乳杆菌BSH基因工程菌的鉴定
转化子菌落PCR扩增产物经琼脂糖凝胶电泳分析(图1)表明,含有重组质粒的菌株都有734 bp的特异性条带,且与预期大小一致,而不含重组质粒的AR497没有条带,说明重组质粒均已成功转化至AR497中。
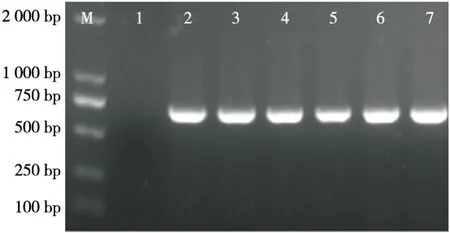
M. 2 000 Marker 1. 阴性对照 2. AR497/pMG36e 3. AR497/pMG-BSH1 4. AR497/pMG-BSH2 5. AR497/pMG-BSH3 6. AR497/pMG-BSH4 7. AR497/pMG-BSH1-3图1 转化子菌落PCR电泳Figure 1 Electrophoretogram of colony PCR
2.2 平板Ca2+沉淀法检测发酵乳杆菌BSH基因工程菌
由图2可知,除表达BSH2的重组菌外,其他工程菌均无法在添加5 mmol/L甘氨脱氧胆酸钠盐的MRS培养基上生长;表达BSH2的重组菌周围产生不透明白色沉淀圈,说明该重组菌株具有降解甘氨脱氧胆酸钠盐的能力[10]。空载体菌株与重组菌株都可以在含有5 mmol/L牛磺鹅脱氧胆酸钠盐的MRS固体培养基上生长,说明AR497具有良好的牛磺鹅脱氧胆酸钠盐耐受能力。在含有5 mmol/L牛磺鹅脱氧胆酸钠盐和甘氨脱氧胆酸钠盐的MRS固体培养基上,除空载体与BSH4表达菌株生长受到完全抑制外,其他菌株在该平板上均有生长,但表达BSH2或同时表达BSH1和BSH3菌株其耐受性明显优于表达BSH1或BSH3菌株。此外,含牛磺鹅脱氧胆酸钠盐的平板无明显白色沉淀圈形成,说明其BSH酶活偏低或不具有水解牛磺鹅脱氧胆酸钠盐的能力。

图2 Ca2+沉淀法检测重组菌的耐胆盐能力Figure 2 Bilesalt resistance of recombinant bacteria bycalcium ion precipitation method
2.3 发酵乳杆菌BSH基因工程菌在胆盐胁迫下的生长
由图3可知,在没有胆盐压力下,与对照菌株AR479/pMG36e相比,表达BSH基因重组菌株可显著提高发酵乳杆菌AR497的胆盐耐受性,BSH2和BSH4基因的表达对菌株生长具有一定的抑制作用,BSH1和BSH3基因的表达对菌株生长有促进作用。重组菌株在0.5 mg/mL胆盐的MRS培养基中培养时,与不加胆盐相比,重组菌株生长受到一定程度的抑制。重组菌株的生长随甘氨脱氧胆酸钠盐浓度的提高受到明显抑制,但BSH2基因的表达对菌株表现出优良的耐胆盐特性;当胆盐浓度提高到1.5 mg/mL时,在液体MRS培养基中,除表达BSH2重组菌株外,其他重组菌株均无法生长。综上,异源表达植物乳杆菌来源的BSH能够提高发酵乳杆菌的耐胆盐能力。
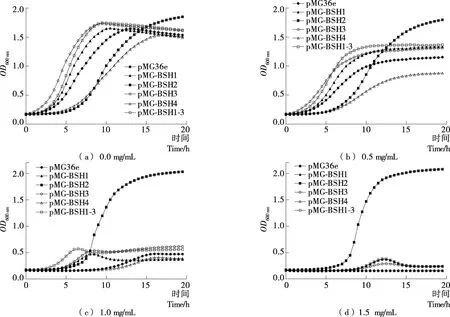
图3 重组菌株在不同甘氨脱氧胆酸钠盐浓度下的生长曲线Figure 3 Growth curve of recombinant strains under different glycodeoxycholic acid sodium salt
2.4 发酵乳杆菌BSH基因工程菌的耐胆盐能力
由图4可知,随着甘氨脱氧胆酸钠盐浓度的增加,表达BSH2重组菌活菌总数并未减少,表明BSH2基因的表达可提高AR479的耐受胆盐能力;表达BSH1、BSH3、BSH4及同时表达BSH1和BSH3基因的重组菌株致死率逐渐升高,BSH基因对发酵乳杆菌提高胆盐耐受效果依次为BSH2>BSH1和BSH3>BSH1>BSH3>BSH4,其中过表达BSH4基因与对照相比,效果不显著(P>0.05)。
2.5 发酵乳杆菌BSH基因工程菌BSH酶活
由图5可知,表达BSH2基因重组菌株酶活最高,达57.74 U/mL,为对照菌株酶活的2.88倍,推测BSH2基因可能在水解结合型甘氨类胆盐为非结合型胆盐过程中效果更强,与前述试验结果相符;而表达BSH1和BSH3、BSH1、BSH3及BSH4基因重组菌株的酶活依次降低。Ren等[18-19]在大肠杆菌中表达植物乳杆菌ST-III的4种BSH基因,其酶活数据与试验结果类似。Lambert等[9]在乳酸乳球菌中表达植物乳杆菌WCSF1的4种BSH基因,其中BSH1基因的活性最高,与试验结果不同,可能与宿主或酶活测定方法(如反应条件和胆盐底物)不同有关[20]。

图4 重组菌株的胆盐致死率Figure 4 Lethality of recombinant strains bybile salt
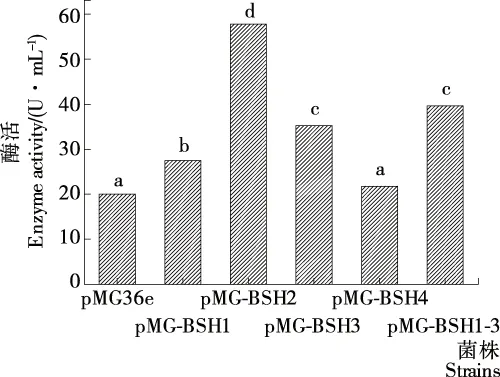
小写字母不同表示差异显著(P<0.05)
3 结论
将具有强耐胆盐能力的植物乳杆菌AR113中4种BSH同功酶基因通过基因工程技术,在发酵乳杆菌AR497中异源表达。通过测定不同BSH基因表达菌株的生长、胆盐耐受性和酶活,发现重组菌株均能在0.5 mg/mL 甘氨脱氧胆酸钠盐的胁迫下生长,仅AR497/pMG-BSH2能够将结合态甘氨脱氧胆酸钠盐为转化为游离态;BSH2重组菌株的BSH酶活最高,达57.74 U/mL,表明BSH2可能具有较其他3种BSH更高的水解甘氨脱氧胆酸钠盐的能力。后续可进一步研究4种BSH同功酶的动力学和蛋白结构特征,解析BSH2对甘氨脱氧胆酸钠盐的水解机制。
