正丙醇对浑浊红球菌PD630影响的代谢组学分析
2020-03-06楚美云张林尚娄文勇宗敏华唐语谦徐晓飞杨继国
楚美云 张林尚 娄文勇 宗敏华 唐语谦, 徐晓飞 杨继国,
(1. 华南理工大学食品科学与工程学院,广东 广州 510640;2. 华南协同创新研究院,广东 东莞 523808)
浑浊红球菌PD630拥有高脂质产量[1-2],适合于高细胞密度的方式来进行培养,并且可以代谢多种碳源[3-4]。该菌是用于工业生产微生物油脂极具潜力的菌株之一[5],其基因组信息已被公布,遗传改造体系也已建立。浑浊红球菌PD630可以将醇类作为其碳源实现油脂的合成[6],合成的油脂在医疗、保健领域以及生物能源领域都具有重要的应用前景[7-8]。
一般而言,自然条件下油脂中偶数碳脂肪酸的含量比较高,奇数碳脂肪酸的含量低。而近些年的一些报道显示奇数碳脂肪酸具有重要的功能特性。奇数碳脂肪酸可用作抗过敏、抗炎和抗真菌剂[9]。奇数碳脂肪酸在人体健康中也起着重要作用[10]。有文献[11]报道正丙醇的添加对于提高浑浊红球菌PD630中奇数碳脂肪酸的含量至关重要。然而,对于微生物而言,醇类可能会对其产生一定的毒害作用。比如对其细胞膜的结构会产生破坏作用,进而使得胞内的物质发生外泄,原因是醇能改变细胞膜的流动性并破坏磷脂层[12]。此外,许多生理功能,包括营养物和离子的转运以及细胞代谢都会受到醇的影响[13]。目前正丙醇对红球菌PD630的毒害作用尚不清楚,红球菌在正丙醇存在时的应激机制尚不明确。
UPLC-Triple-TOF/MS非靶标代谢组学分析可以通过检测微生物在经受外部刺激前后,其体内小分子代谢物的变化进而阐明微生物对外界刺激的应激机制。红球菌在正丙醇存在时的应激机制还未见研究。试验拟采用UPLC-Triple-TOF/MS对正丙醇存在条件下浑浊红球菌PD630体内的代谢物进行非靶标代谢组学分析,并结合主成分分析(PCA)和正交最小偏二乘判别分析(OPLS-DA)对其进行多元统计分析、识别差异代谢物,分析短肽、磷脂和丙酰辅酶A(CoA)等代谢物的变化以探究浑浊红球菌PD630对正丙醇的应激机制;同时采用气相色谱仪测定脂肪酸的变化,为后续的深入研究提供试验依据。
1 材料与方法
1.1 菌种
浑浊红球菌PD630(RhodococcusopacusPD630, DSMZ44193):北京北纳创联生物技术研究院。菌种保藏于体积浓度为25%的甘油溶液中,-80 ℃冰箱冻存。
1.2 主要仪器
高压蒸汽灭菌锅:SQ510C型,广州科朋科学仪器有限公司;
振荡培养箱:ZQLY-180S型,上海知楚仪器有限公司;
医用型洁净工作台:AIRTECH SW-CJ-2FD型,苏州安泰空气技术有限公司;
气相色谱仪:GC-2010PlusAF型,岛津企业管理(中国)有限公司;
超高效液相色谱串联三重四级杆飞行时间质谱仪:TripleTOF®6600型, 美国AB Sciex公司;
-80 ℃超低温冰箱:DW-86L578J型,广州科晓科学仪器有限公司。
1.3 主要培养基
NB培养基配方:牛肉膏粉3.0 g/L,蛋白胨10.0 g/L,氯化钠5.0 g/L,最终pH 7.4±0.2,250 mL三角瓶,装液量为50 mL;
对照组发酵培养基配方:葡萄糖12 g/L,KH2PO41.5 g/L,Na2HPO4·12H2O 9 g/L,尿素0.6 g/L,FeNaEDTA 5 mg/L,MgSO4·7H2O 0.5 g/L,CaCl2·2H2O 20 mg/L,MnCl2·4H2O 0.05 mg/L,CoCl2·6H2O 0.2 mg/L,H3BO30.3 mg/L,Na2MoO4·2H2O 2 mg/L,ZnSO4·7H2O 0.1 mg/L,NiCl2·6H2O 0.02 mg/L,CuCl2·2H2O 0.01 mg/L[14-15];
试验组发酵培养基配方:在对照组发酵培养基的基础上添加体积分数1%正丙醇;
配置后装入250 mL三角瓶,装液量为100 mL。其中对照组和试验组每组6个生物学重复。以上培养基均在121 ℃,20 min条件下灭菌,冷却备用。
1.4 培养方法
(1) 种子培养:将菌种接入上述种子培养基,在温度为30 ℃、转速为160 r/min的摇床上培养24 h,即为种子液。
(2) 发酵培养:接种量1%,培养温度和转速分别为30 ℃、160 r/min。分别在48 h(对应于指数期)和72 h(对应于稳定期)取样,液氮淬灭,并置于-80 ℃冰箱备用。
1.5 GC测定脂肪酸
发酵培养84 h后,收集菌体、破壁提油。具体步骤:称取1 g湿菌体置于10 mL提脂瓶中,加入4 mL 3 mol/L盐酸、2 mL正己烷,振荡30 s充分混匀;然后沸水浴煮5 min,边煮边振荡;冷却至室温,离心(5 000×g,5 min),收集正己烷层(上层)[16]。再对试样进行甲酯化[17],分析脂肪酸组成。色谱柱为HP-88(100 m×0.32 mm,0.22 μm),FID检测器,检测器温度270 ℃,汽化室温度250 ℃,分流比20∶1,进样体积2 μL,载气N2。程序升温设置:180 ℃保持5 min,以2 ℃/min 的速度提高到220 ℃,保持20 min[18]。以37种脂肪酸甲酯混合标准品的保留时间为标准进行定性分析,由相对质量校正因子来修正的峰面积归一化法进行计算脂肪酸的含量。
1.6 UPLC-MS分析
使用超高效液相色谱串联三重四级杆飞行时间质谱(UPLC-Triple-TOF/MS)对样品进行分析。色谱柱:Waters UPLC BEH C18柱(2.1 mm×100 mm,1.7 μm)。流动相A为体积比1∶1乙腈—异丙醇溶液(含0.1%甲酸),流动相B为水(含0.1%甲酸)。梯度洗脱,洗脱程序:0 min,5% A;3 min,20% A;9 min,95% A;13 min,95% A;14 min,5% A;16 min,5% A。柱温40 ℃,进样体积5 μL。质谱条件:离子源温度120 ℃;载气流量900 L/h;电喷雾毛细管电压1.0 kV;进样电压40 V;质谱扫描范围(m/z)50~1 000;分辨率30 000[11]。
1.7 数据处理与统计分析
将UPLC-Triple-TOF/MS获得的原始数据导入代谢组学处理软件Progenesis QI(Waters Corporation,Milford,USA)对数据进行预处理。然后将预处理后的数据集导入ropls软件(Version1.6.2)中进行处理,并在Majorbio I-Sanger云平台(https://www.i-sanger.com)对数据进行PCA以及OPLS-DA分析。同时在Majorbio I-Sanger云平台(https://www.i-sanger.com)结合OPLS-DA模型的VIP值≥1和P值≤0.05确定样品之间的显著差异代谢物[19]。
原始数据用代谢组学处理软件Progenesis QI 进行搜库鉴定,将一级质谱(MS)和二级质谱(MS/MS)信息与代谢数据库进行匹配。其中主要数据库为https://metlin.scripps.edu/;http://www.hmdb.ca/等公共数据库以及Majorbio I-Sanger云平台(https://www.i-sanger.com)的自建数据库。
1.8 数据分析
用SPSS 20.0软件进行单因素方差分析(ANOVA),每组重复3次。P值<0.05时,认为是具有显著性差异。数据表示为(平均值±标准偏差)。
2 结果与分析
2.1 脂肪酸组成
为了进一步印证正丙醇能够提高浑浊红球菌PD630所产油脂中奇数碳脂肪酸的百分含量,分析了体积分数1%正丙醇添加量下菌油的脂肪酸组成,结果见表1。正丙醇的添加对油脂的脂肪酸含量影响较大。体积分数1%正丙醇使奇数碳脂肪酸的含量从32.91%提高至79.66%,提升了46.75%。主要的奇数碳脂肪酸为C15:0(38.42%)、C17:0(17.56%)和C17:1(23.68%)。Zhang等[11]研究表明向培养基中添加体积分数0.5%~1.5%正丙醇,奇数碳脂肪酸的含量提高了46.7%~55.1%,与试验结果一致。
2.2 代谢组数据的统计分析
PCA分析结果(图1)表明在48 h和72 h试验组和对照组样本在整体分布上有分离趋势,但两个主成分对X累积解释率分别为0.650和0.608,表明PCA模型的稳定性不够高。主要原因是PCA是一种无监督的模式,其分类判别能力还不够强。
为了获得更好的分离模型,采用OPLS-DA对数据进行进一步分析。结果表明,48 h时,模型对X矩阵累积解释率为0.780,对Y矩阵的累积解释率为0.991,模型预测能力良好(0.978)。72 h样本,3个模型的参数分别为0.727,0.995,0.986,表明模型质量较好,模型具有良好的可靠性和预测性。此外,由图2可知,试验组和对照组明显分开,模型良好。
2.3 差异代谢物
由于OPLS-DA模型优于PCA方法分析的结果,故使用OPLS-DA模型对差异代谢物进行分析,其热图见图3。48 h的样本中,试验组与对照组的差异代谢物共有54种;72 h的样本中,试验组与对照组的差异代谢物有61种。在众多的差异代谢物中,短肽和磷脂的变化最为突出。此外,丙酰CoA也发生了显著变化。因此,重点分析这3类化合物。

表1 正丙醇对浑浊红球菌PD630脂肪酸组成的影响Table 1 Effect of 1-propanol on the fatty acid profiles produced by Rhodococcus opacus PD630 %
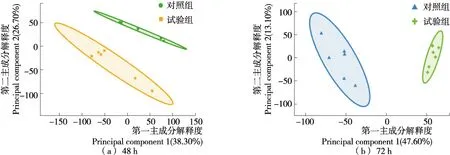
图1 试验组和对照组各样品在48 h和72 h的主成分分析(PCA)Figure 1 Principal component analysis (PCA) for the samples between test and control at 48 and 72 h

图2 试验组和对照组各样品在48 h和72 h的正交最小偏二乘判别分析(OPLS-DA)Figure 2 Orthogonal partial least-squares discriminant analysis (OPLS-DA) for the samples between test and control at 48 and 72 h
在添加正丙醇后,菌体代谢物中短肽的丰度显著下降,丰度下降的短肽主要有:Gamma-Glu-Leu、Glu-Val、Glu-Met、Glu-Tyr、Glu-Trp。这些短肽均含有谷氨酸残基,谷氨酸残基是重要的鲜味物质。同时谷氨酸是已知的渗透保护剂,醇存在时,能够起到保护作用[20-21]。

*. P<0.05 **. P<0.01 ***. P<0.001
实验室培养浑浊红球菌PD630时发现培养的后期有风味物质产生,推测与这些短肽有关。这些短肽可能是红球菌生长进入稳定期后产生的信号分子。另外,短肽是氨基酸合成和分解的中间代谢产物,短肽的进一步降解生成氨基酸,进而进入氨基酸代谢途径。而氨基酸代谢对于提高菌对醇的耐受性至关重要[22]。此外,短肽降解的增加在一定程度上防止了蛋白质在溶剂激发下蛋白质聚集或错误折叠[23-24]。试验过程中发现添加丙醇时二肽的含量显著下降,一方面可能是正丙醇抑制了某些酶,导致二肽信号分子的含量降低。另一方面,可能是菌启动了自身的应激机制,加速了蛋白质的代谢,进而提高自身对正丙醇的耐受性。
菌体代谢物中磷脂分子的不饱和度增加显著。由于磷脂是膜的主要结构组分,对细胞的活力至关重要[25],所以对磷脂的变化进行了研究。通过对磷脂上脂肪酸的不饱和度进行分析,图4表明在正丙醇存在条件下磷脂分子的不饱和度增加,间接说明细胞膜的不饱和度增加。在长期暴露于醇中会改变膜中存在的饱和脂肪酸与不饱和脂肪酸的比例,这种效应主要取决于所用溶剂的碳链长度[26]。例如文献[27]中报道,短链(C2~C4)烷醇存在时,菌会增加细胞膜的不饱和脂肪酸浓度。然而,长链(C5~C9)烷醇会增加其饱和脂肪酸的含量[27]。菌是通过增加不饱和脂肪酸的浓度来保护膜功能,以最小化溶剂对双层结构的影响,或通过增加饱和脂肪酸以恢复膜中的顺序[27-28]。由于有机溶剂会使得膜的流动性发生改变,并且引起磷脂双层的稳定性降低,因此细胞的应激反应通过改变磷脂的生物合成速率和组成来补偿这种情况。此外,不同的菌暴露在不同有机溶剂中所产生的应激机制是不同的。Henderson等[25]通过脂质组学研究发现酵母通过改变脂质组成来减轻乙醇的胁迫作用。而Nielsen等[29]发现溶血性葡萄球菌和芽孢杆菌ORAs2是通过增加膜流动性来适应溶剂挑战。
菌体代谢物中丙酰CoA的丰度上升显著。丙酰CoA是产生奇数碳脂肪酸的关键中间体,因为合成奇数碳脂肪酸的主要起始底物是丙酰CoA。由图5可知,正丙醇的加入使得丙酰CoA的丰度增加。以二碳单位的形式来对脂肪酸链进行延长是脂肪酸合成的方式。当以丙酰CoA为起始底物每经一个循环延伸两个碳原子单元,所以最终生成的脂肪酸为奇数碳脂肪酸。例如在丙酰CoA的基础上经过6或7个循环时,最终分别产生C15:0和C17:0[30-31]。所以由丙酰CoA的丰度增加可以推断奇数碳脂肪酸的合成将增加,与表1中脂肪酸的结果相吻合。表明正丙醇是通过影响丙酰CoA的丰度进而影响奇数碳脂肪酸的产生。
3 结论
采用UPLC-Triple-TOF/MS测定代谢物的变化,探究了红球菌PD630在正丙醇存在时的应激机制。并且运用气相色谱对添加正丙醇的菌油的脂肪酸组成及含量进行了分析。结果表明:应激机制主要表现在短肽减少、细胞膜磷脂的不饱和度增加且丙酰CoA出现显著性的增加;奇数碳脂肪酸的含量从32.91%提高到79.66%。但试验仍然还存在着一些问题有待解决,如在基因水平上解释该应激机制。

*. P<0.05 **. P<0.01 ***. P<0.001
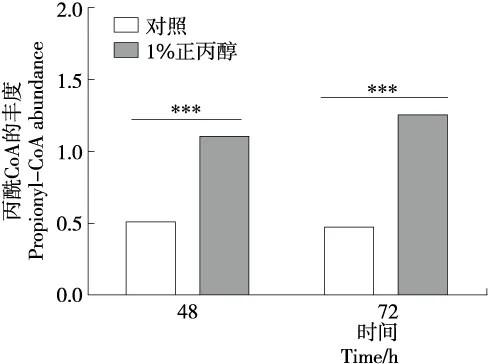
*. P<0.05 **. P<0.01 ***. P<0.001
