鸡传染性囊病免疫复合物疫苗和活疫苗对鸡外周血淋巴细胞免疫功能的影响
2020-03-05叶丽娜张建伟史爱华郑小兰章振华
叶丽娜,李 林,沈 佳,张建伟,史爱华,郑小兰,章振华
(北京市农林科学院畜牧兽医研究所 畜禽疫病防控技术北京市重点实验室,北京 海淀 100097)
鸡传染性囊病(Infectious bursal disease,IBD)是由传染性法氏囊病病毒(Infectious bursal disease virus,IBDV)引起的雏鸡的一种急性、高度接触性传染病,以3~6周龄雏鸡最易感。IBDV主要侵害鸡的免疫中枢器官囊,病毒在囊B淋巴细胞内大量复制、增殖,使B淋巴细胞发生变性、坏死和/或凋亡,导致鸡不同程度甚至长期的免疫抑制,尤其是鸡的体液免疫功能遭到严重破坏[1],不仅降低了机体对其他病原的抵抗力,还可导致其他禽用疫苗免疫效果差或免疫失败,给养禽业造成重大经济损失。
IBDV侵入机体后主要通过B淋巴细胞介导的体液免疫发挥作用[2],虽然T淋巴细胞不是IBDV复制的靶细胞,但T淋巴细胞能抵抗IBDV的感染[3],因此T、B淋巴细胞数量变化及细胞活性状态可作为IBDV感染后评判机体免疫功能状态的重要指标。本试验以IBD免疫复合物疫苗和活疫苗作为研究对象,运用流式细胞术测定不同免疫时间鸡外周血淋巴细胞凋亡率及CD4+T、CD8+T和Bu-1+B细胞数变化,旨在研究IBD免疫复合物疫苗和活疫苗免疫对鸡外周血免疫功能的影响及其差异,同时为IBD免疫复合物疫苗的发展提供理论依据。
1 材料与方法
1.1 材料
1.1.1 主要试剂 HISTOPAQUE®-1083,购自Sigma公司;Annexin V-FITC细胞凋亡检测试剂盒,购自北京欣博盛生物科技有限公司;FITC标记小鼠抗鸡Anti-CD4、FITC标记小鼠抗鸡Anti-CD8、FITC标记小鼠抗鸡Anti-Bu1a+Bu1b,均购自Abcam公司;流式细胞管;RPMI 1640培养液;锡箔纸。
1.1.2 主要仪器 Countstar自动细胞计数仪(上海睿钰生物科技有限公司);多维高清流式细胞分析仪BD LSRFortessaTM(BD公司)。
1.1.3 试验动物及疫苗 1日龄SPF雏鸡,购自北京勃林格殷格翰维通生物技术有限公司;IBD免疫复合物疫苗,由本研究室制备,制备方法参照章振华等[4]的文章;BX株活疫苗,由本研究室制备。
1.2 方法
1.2.1 实验动物 将108只1日龄SPF雏鸡随机分成3组,每组36只,第1组和第2组分别颈背侧皮下注射鸡传染性囊病复合物疫苗组和鸡传染性囊病BX株活疫苗组,每只0.1 mL,第3组鸡不接种疫苗作为空白对照组。3组分别于免疫后7、14、21、28、35 d和42 d随机抽取各6只,翅静脉采外周血进行试验。
1.2.2 外周血淋巴细胞凋亡数检测 无菌取免疫后不同时间鸡的外周抗凝血,用等体积PBS稀释抗凝血,将4 mL稀释后的抗凝血缓慢加至等体积1083淋巴细胞分离液面上,常温下1 200 g离心40 min,收集中间层淋巴细胞,PBS洗3次,每次4 ℃,1 200 g离心5~10 min,PBS重悬细胞并将细胞浓度调至1×107个/mL。参照Annexin V-FITC/PI细胞凋亡检测试剂盒说明书操作步骤进行。1 h内上流式检测,收获10 000个细胞,获取淋巴细胞阳性百分比。
1.2.3 外周血CD4+T、CD8+T、Bu-1+B细胞数检测 淋巴细胞分离步骤同1.2.2。取100 μL淋巴细胞液加入到流式管中,分别加入适当浓度的FITC标记小鼠抗鸡Anti-CD4、Anti-CD8、Anti-Bu1a+Bu1b抗体,混均,并设立同型对照作为阴性对照。用锡箔纸包裹流式管,室温避光孵育30 min,加入3 mL PBS混匀,1 200 g离心15 min,弃上清,用500 μL 的PBS重悬沉淀,上机检测。
1.3 统计方法 利用FlowJo软件分析流式细胞仪上获得的外周血细胞凋亡、CD4+T和CD8+T淋巴细胞、Bu-1+B淋巴细胞阳性比例;SPASS Statistics 17.0中的One Way-ANOVA进行单因素方差分析,Duncan氏法进行多重比较;数值以“Mean±SE”表示;**P<0.01,*P<0.05表示免疫复合物疫苗组VS活疫苗组;##P<0.01,#P<0.05表示活疫苗组VS对照组;ΔΔP<0.01,ΔP<0.05表示免疫复合物疫苗组VS对照组。P<0.01表示差异极显著,P<0.05表示差异显著,只对同一免疫时间进行比较;用GraphPad Prism 5.0软件作图。
2 结果
2.1 外周血淋巴细胞凋亡数检测 流式细胞仪检测外周血淋巴细胞凋亡数,结果如图1,免疫后7 d,活疫苗引起鸡外周血淋巴细胞总凋亡比例明显高于免疫复合物疫苗组和对照组,且差异极显著(P<0.01);免疫后14、21、28、35 d和42 d,活疫苗组、免疫复合物疫苗组和对照组3组间无显著差异(P>0.05)。
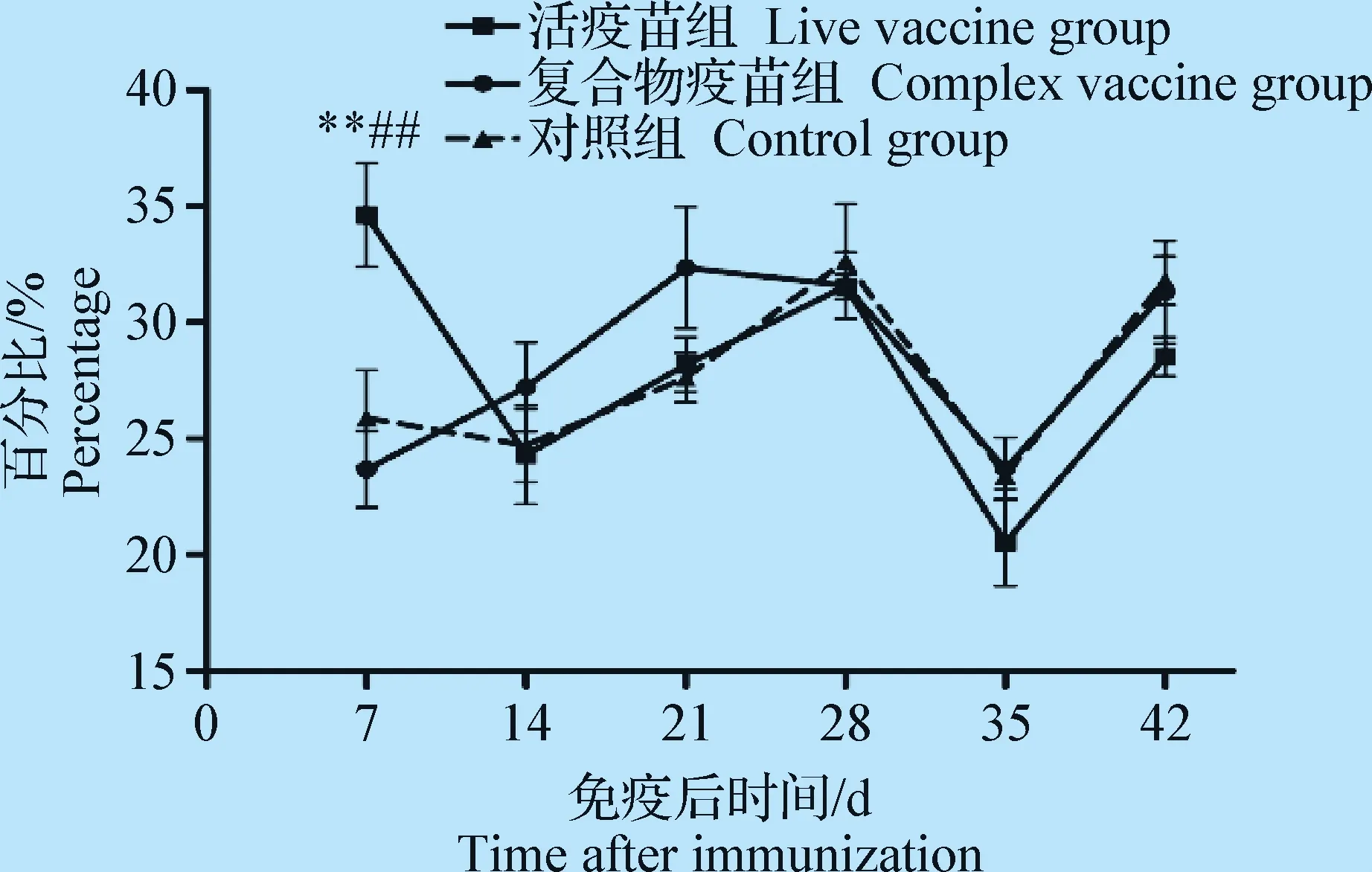
图1 外周血淋巴细胞凋亡变化规律Fig.1 Changes of apoptosis of peripheral blood lymphocytes
2.2 外周血CD4+T淋巴细胞数检测 结果如图2,免疫后7 d,活疫苗组CD4+T淋巴细胞数升高,与免疫复合物疫苗组差异极显著(P<0.01),与对照组差异显著(P<0.05);免疫后21 d和28 d,免疫复合物疫苗组CD4+T淋巴细胞数均高于活疫苗组和对照组,且差异显著或差异极显著(P<0.05或P<0.01);免疫后21和28 d,免疫复合物疫苗组和对照组无显著差异(P>0.05);免疫后14、35 d和42 d活疫苗组、免疫复合物疫苗组和对照组3组间无显著差异(P>0.05)。
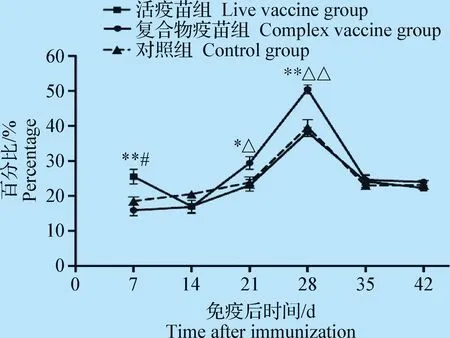
图2 外周血CD4+T淋巴细胞数量变化Fig.2 Changes of the number of CD4+ T lymphocytes in peripheral blood
2.3 外周血CD8+T淋巴细胞数量检测 结果如图3,免疫后7 d和35 d,活疫苗组CD8+T淋巴细胞数均高于免疫复合物疫苗组和对照组,且差异极显著(P<0.01);免疫后14~28 d,活疫苗组CD8+T淋巴细胞数高于对照组,差异显著或差异极显著(P<0.05或P<0.01),活疫苗组与免疫复合物疫苗组无显著性差异(P>0.05);免疫后42 d,免疫复合物疫苗组高于活疫苗组,且差异显著(P<0.05),免疫复合物疫苗组和对照组无显著性差异(P>0.05);免疫后7、14、21、28、35 d和42 d免疫复合物疫苗组和对照组均无显著性差异(P>0.05)。
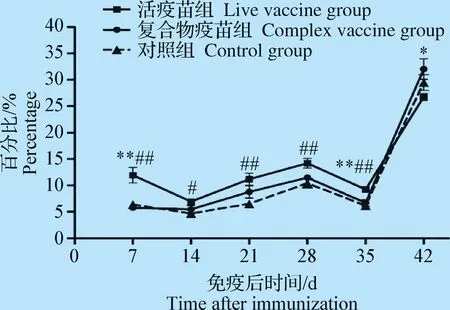
图3 外周血CD8+T淋巴细胞数量变化Fig.3 Changes of the number of CD8+ T lymphocytes in peripheral blood
2.4 外周血Bu-1+B淋巴细胞数检测 结果如图4,免疫后7~42 d,对照组Bu-1+B淋巴细胞数均高于免疫复合物疫苗组和活疫苗组,且差异显著或极显著(P<0.05或P<0.01),免疫复合物疫苗组和活疫苗组无显著性差异(P>0.05)。
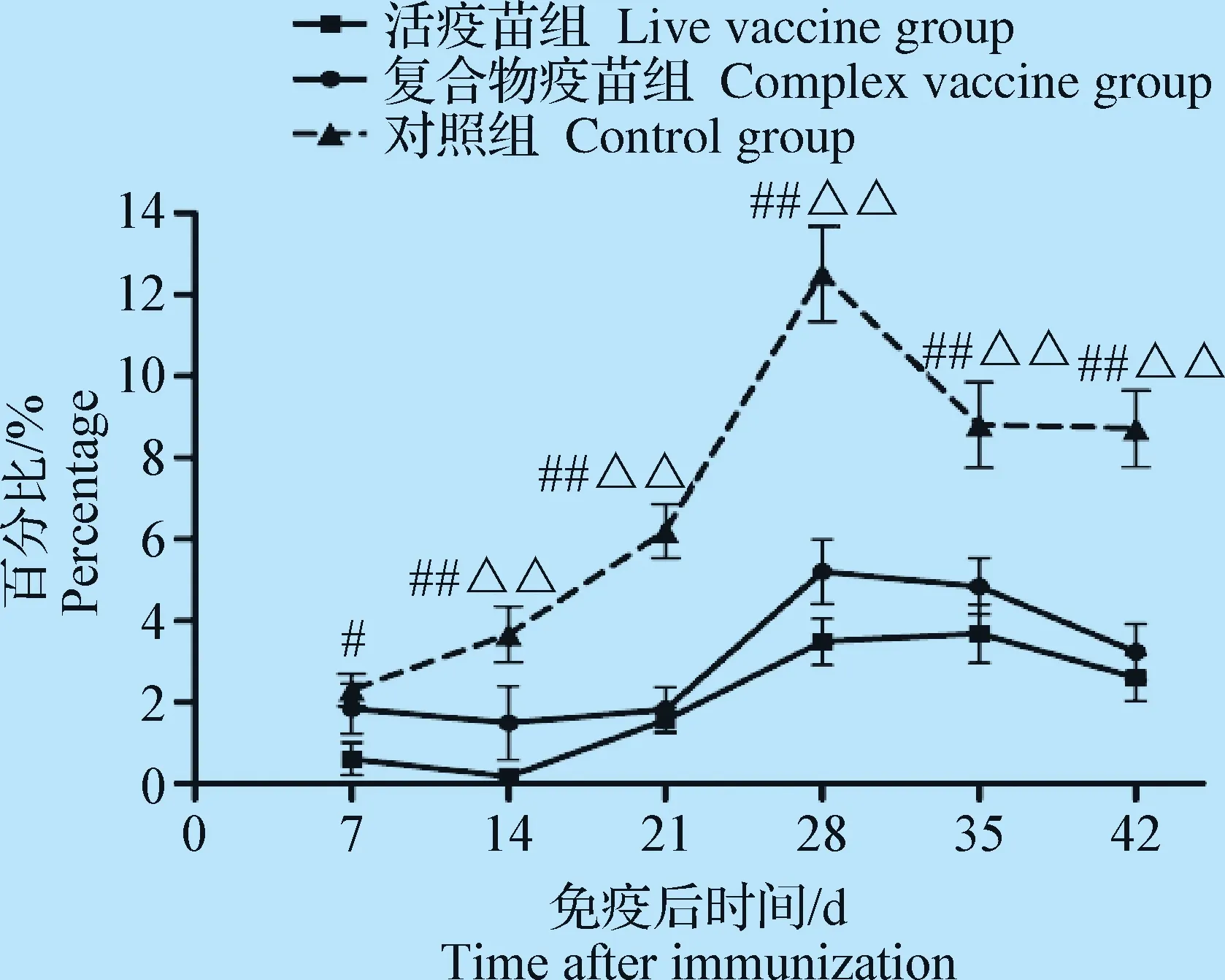
图4 外周血Bu-1+ B淋巴细胞数量变化Fig.4 Changes of the number of Bu-1+ B lymphocytes in peripheral blood
3 讨论
细胞凋亡是指机体为维护内环境的稳定,由基因调控的细胞主动性死亡过程,正常情况下这个过程是为了清除机体内老化和多余的细胞。当某些病毒感染时,机体细胞也可以通过诱导细胞凋亡而有效阻止病毒的繁殖,但是大量的细胞凋亡又会使机体致死,造成机体免疫功能下降。IBDV感染能引起鸡外周血淋巴细胞的凋亡[5],因此试验将鸡外周血淋巴细胞凋亡数作为评判机体免疫功能状态的一种指标。Annexin V/PI 双染色法常用于检测细胞凋亡,其原理是根据细胞凋亡早期细胞膜的磷脂对称性发生改变,磷脂酰丝氨酸(PS)由细胞膜内移位到细胞膜外,Annexin V与磷脂酰丝氨酸有高度亲和力,可通过细胞外侧暴露的磷脂酰丝氨酸与凋亡早期细胞的细胞膜结合。其结果判断:正常活细胞为Annexin V-/PI-,早期凋亡细胞为Annexin V+/PI-,晚期凋亡或坏死细胞为Annexin V+/PI+。坏死细胞与凋亡细胞不同,坏死细胞是由极端的物理、化学因素或严重的病理性刺激引起的细胞损伤和死亡。细胞坏死一般发生在成群细胞或大片组织,引起机体炎症反应,而细胞凋亡只针对单个细胞,不引起机体炎症反应。本试验以Annexin V/PI 双染色法检测鸡外周血淋巴细胞凋亡率,因试验鸡不存在极端的物理、化学或严重的病理刺激,因此试验结果将Annexin V+/PI+判为晚期凋亡细胞。免疫后7 d,活疫苗组外周血淋巴细胞凋亡数极显著高于免疫复合物疫苗组和对照组(P<0.01),其他时间均差异不显著(P>0.05);免疫复合物疫苗组细胞凋亡数与对照组均差异不显著(P>0.05)。试验结果表明,活疫苗组中的IBDV在免疫后7 d能促进外周血淋巴细胞发生凋亡,降低了机体的免疫应答能力,免疫后14~42 d机体免疫功能又开始恢复;免疫复合物疫苗组中的IBDV在免疫后7~42 d对细胞凋亡没有显著影响。至于免疫复合物疫苗中的IBDV为什么不引起机体外周血淋巴细胞的显著凋亡,还需进一步的研究。
T细胞属于淋巴细胞中的一种,根据T细胞表面标志及功能的不同,可将T细胞分为CD4+T细胞和CD8+T细胞2大亚群。CD4、CD8分子在机体免疫应答中起着十分重要的作用[6-7]。鸡的CD4、CD8分子作为T细胞受体(T-cell receptor,TCR)的辅受体参与对主要组织相容性复合物(Major histocompatibility complex,MHC)分子递呈抗原的识别,CD4+T淋巴细胞具有辅助细胞免疫和体液免疫应答的作用,CD8+T淋巴细胞则是重要的效应细胞。鸡感染IBDV后,T淋巴细胞在抵抗IBDV入侵时的作用可能是机体产生额外抗体所必需的因素,即使通过体外注射额外抗体免疫接种也同样需要T细胞的参与,否则免疫失败,这里的T细胞是指CD4+T细胞,它可作为抗原递呈细胞将抗原信号传递给B细胞然后激活B细胞产生抗体[8]。试验中与对照组相比,免疫复合物疫苗免疫后7~42 d,主要引起CD4+T细胞数升高,活疫苗主要引起CD8+T细胞数升高,试验结果提示免疫复合物疫苗和活疫苗均能增强鸡外周血细胞免疫功能,但免疫复合物疫苗引起的CD4+T细胞升高间接引起的体液免疫应答水平可能比活疫苗的高。
IBDV侵入机体后主要由B淋巴细胞介导的体液免疫发挥作用,因此B淋巴细胞数可直接反应机体的免疫功能状态。Bu-1+是鸡B淋巴细胞表面特异性分子,因此试验通过测定Bu-1+B淋巴细胞数作为反映B淋巴细胞数量的依据。试验中与对照组相比,免疫复合物疫苗和活疫苗免疫均能引起B淋巴细胞数的减少,降低机体对IBDV的体液免疫应答能力。本试验提示活疫苗对免疫鸡细胞免疫和体液免疫水平的抑制作用大于免疫复合物疫苗的,且这2种疫苗的免疫应答机制可能并不相同,为IBD免疫复合物疫苗的研发提供了依据。
