猪瘟病毒化学发光竞争ELISA抗体检测方法的建立
2020-03-05张乾义夏应菊任雪健邹兴启赵启祖
徐 璐,张乾义,夏应菊,任雪健,李 翠,邹兴启,徐 嫄,王 兆,赵启祖,王 琴
(1.中国兽医药品监察所 国家/OIE猪瘟参考实验室,北京 海淀 100081;2.洛阳莱普生信息科技有限公司,河南 洛阳 471000)
猪瘟(Classical swine fever,CSF)是由猪瘟病毒(Classical swine fever virus,CSFV)引起的严重危害养猪业的重大传染病,是世界动物卫生组织(OIE)规定的必须报告的动物疫病。猪瘟弱毒疫苗的问世,结束了猪瘟疫情肆虐的局面,英国和美国甚至消灭了猪瘟[1-2]。但是在某些国家,猪瘟仍然流行并造成巨大的经济损失。在我国,猪瘟的大规模暴发已经停止,但仍呈现点状散发[3-4]。我国实行猪瘟疫苗全面免疫策略防控该病,而进行疫苗抗体水平监测是评价疫苗免疫效果、评估疫病流行情况的主要手段[5]。另外,对于某些不免疫猪瘟疫苗的国家来说,对猪瘟抗体的检测则是进行猪瘟病毒感染检测的主要手段[6]。因此,对抗体检测方法进行不断优化和升级,进一步增加检测的准确度、提高检测效率,对猪瘟防控工作大有裨益。国内外目前有很多针对猪瘟病毒E2蛋白抗体的检测试剂盒[7-11],但无论是间接ELISA还是阻断ELISA,都是采用两步法的操作过程,检测时间一般约为3 h,试剂盒在操作便捷性和信号灵敏度等方面并未有明显的提高。另外,传统ELISA试剂盒多采用TMB底物,信号的线性范围窄,无法准确区分抗体效价的高低,大大影响了试剂盒的检测效果。为了进一步提高试剂盒的敏感性、特异性,同时简化反应步骤,缩短反应时间,本课题组采用猪瘟病毒E2蛋白单克隆抗体作为竞争抗体,结合化学发光免疫分析技术,建立猪瘟病毒化学发光竞争ELISA抗体检测方法(简称:化学发光方法),通过对标准曲线的绘制,实现了检测结果的相对定量。
1 材料与方法
1.1 主要试剂 猪瘟病毒E2蛋白,由本实验室构建的重组杆状病毒表达和纯化[12-13];HRP标记猪瘟病毒E2蛋白单克隆抗体,由本实验室制备;猪瘟病毒抗体检测试剂盒(简称:阻断试剂盒),购自美国爱德士公司,批号:FS7083;溯源血清为猪瘟强阳性血清国家参考品和猪瘟阴性血清国家参考品,由中国兽医药品监察所提供;质控血清盘共计501份,其中含猪瘟抗体阳性血清248份,猪瘟抗体阴性血清253份,由本实验室制备和鉴定;交叉反应试验用血清5份,分别为猪细小病毒(Porcine parvovirus,PPV)阳性血清、猪源牛病毒性腹泻病病毒(Bovine viral diarrhea virus,BVDV)阳性血清、猪伪狂犬病病毒(Porcine pseudorabies virus,PRV)阳性血清、猪圆环病毒II型病毒(Porcine circovirus virus-II,PCV-II)阳性血清和猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome,PRRSV)阳性血清,经金标准方法-荧光抗体病毒中和试验(Fluorescent antibody virus neutralization test,FAVN)检验为猪瘟抗体阴性;比对试验用血清共计391份,为田间采集的猪瘟疫苗免疫和非免疫猪血清。
1.2 主要仪器和耗材 化学发光仪,购自美国Panomics 公司;聚乙烯发光板,购自Thermo公司。
1.3 方法
1.3.1 标准品的制备和标准曲线的绘制 采用猪瘟血清国家参考品作为溯源血清,用于绘制标准曲线。将猪瘟抗体强阳性血清国家参考品的抗体剂量值赋值为10 000 NCU/mL,并进行系列稀释,测定稀释血清的发光值。以抗体剂量值为横坐标,发光值为纵坐标,运用数据统计软件进行分析,通过四参数曲线拟合方法拟合绘制标准曲线,从中选择具有特征的5个浓度绘制标准曲线。
1.3.2 反应条件的优化 由于本方法采用的是竞争原理,因此,反应条件优化时采用猪瘟抗体阴性和阳性血清做2组重复试验测定发光值(阴性血清发光值的平均值为N,阳性血清发光值的平均值为P),以N/P的最高比值作为最佳反应条件,进行如下条件优化:(1)抗原的最佳包被浓度和酶标单抗的最佳反应浓度的确定;(2)从1%明胶、1%酪蛋白、5%BSA和10%脱脂乳的PBST溶液中筛选封闭效果最佳的组分;(3)最佳包被条件和封闭条件的确定;(4)室温条件下,抗原与待检血清/酶结合物反应以及底物的最佳反应时间的确定。
1.3.3 临界值的确定 用本方法对质控血清盘进行检测,同时采用标准品绘制标准曲线,计算每份血清的抗体剂量值。采用SPSS 16.0软件对所有血清样本的抗体剂量值进行分析。以敏感性为纵坐标,(1-特异性)为横坐标,绘制ROC曲线,曲线上的每一个点代表临界值所对应的敏感性和特异性。计算每个临界值的Youden指数[Youden指数=敏感性-(1-特异性)],并以Youden 指数最大的点作为阴、阳性判断的临界点,确定该方法的敏感性和特异性。
1.3.4 交叉反应试验 采用本方法对5份相关猪病毒性传染病阳性血清进行检测,判断是否具有交叉反应。
1.3.5 与商品化试剂盒的比较研究 田间采集的391份血清,分别采用本方法和进口的阻断试剂盒进行比较,计算两者的符合率[符合率=(两种方法检测结果均阳性数量+两种方法检测结果均为阴性数量)/样本总数×100%]。同时对检测结果出现差异的血清,采用FAVN方法进行定性检测。
2 结果
2.1 标准曲线的绘制 通过对标准曲线分析发现,当抗体剂量值>200 NCU/mL时,不同抗体浓度的发光值区分并不明显。当抗体剂量值在0~200 NCU/mL 时,发光值与抗体剂量值的呈现比较典型的线性关系。在此范围内,最终选择10、20、40、100 NCU/mL和200 NCU/mL五个浓度作为绘制标准曲线的标准品(图1)。
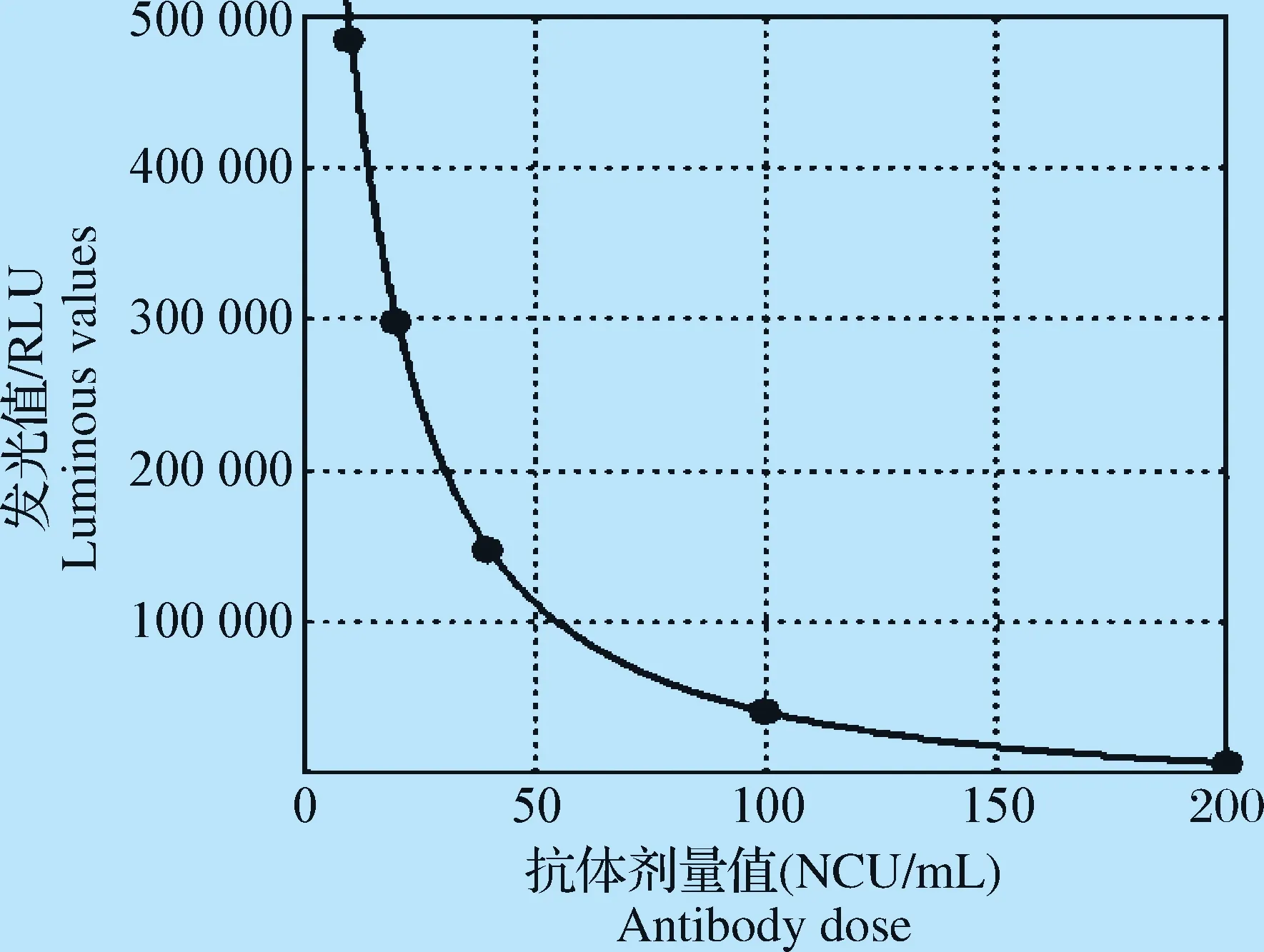
图1 猪瘟病毒化学发光竞争ELISA抗体检测方法的标准曲线Fig.1 Standard curve of CLIA competition ELISA method to detect CSFV antibody
2.2 反应条件的优化
2.2.1 抗原包被浓度和酶标单抗最佳浓度 将包被蛋白和酶标单抗分别进行梯度稀释,结果显示,当包被抗原进行6 000倍稀释(终浓度为0.1 μg/mL)、酶标单抗进行4 000倍稀释时,N/P值最高。因此,确定包被蛋白的最佳包被浓度为0.1 μg/mL(图2),酶标单抗的最佳稀释度为4 000倍(图3)。
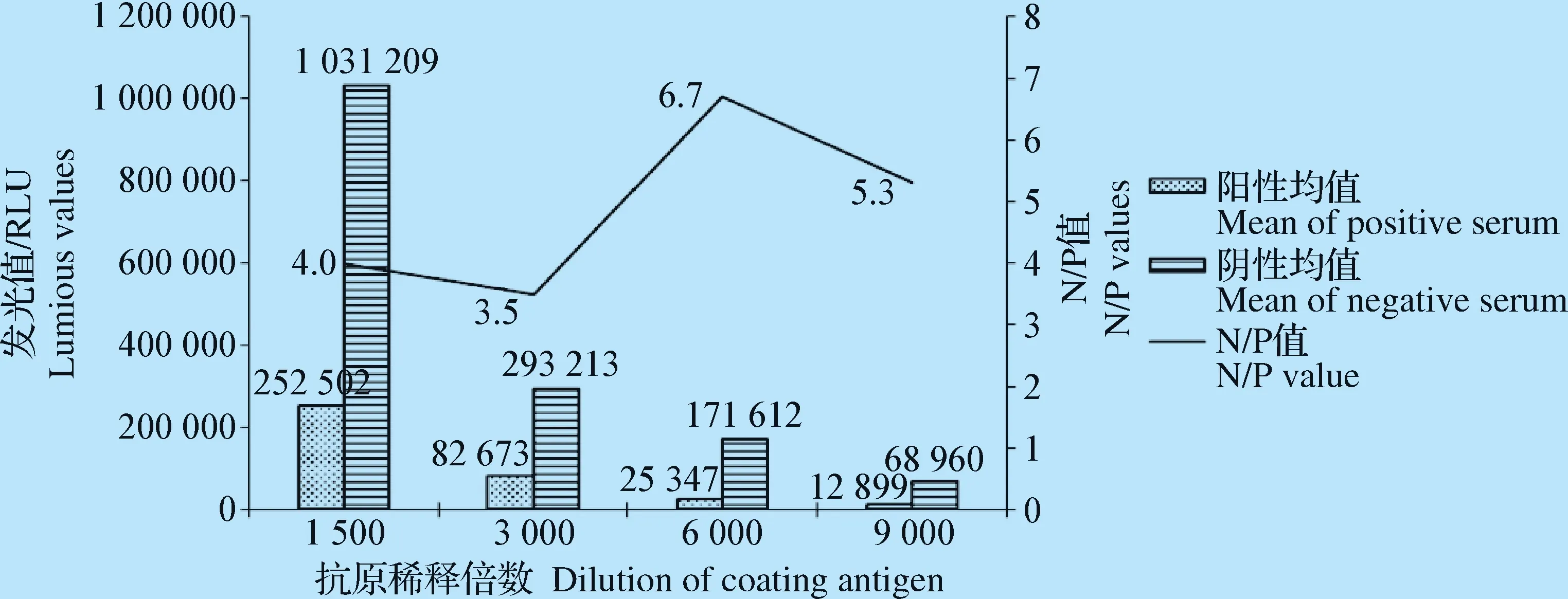
图2 包被抗原最佳稀释倍数的确定Fig.2 Determination of the best dilution of multiple coating antigen
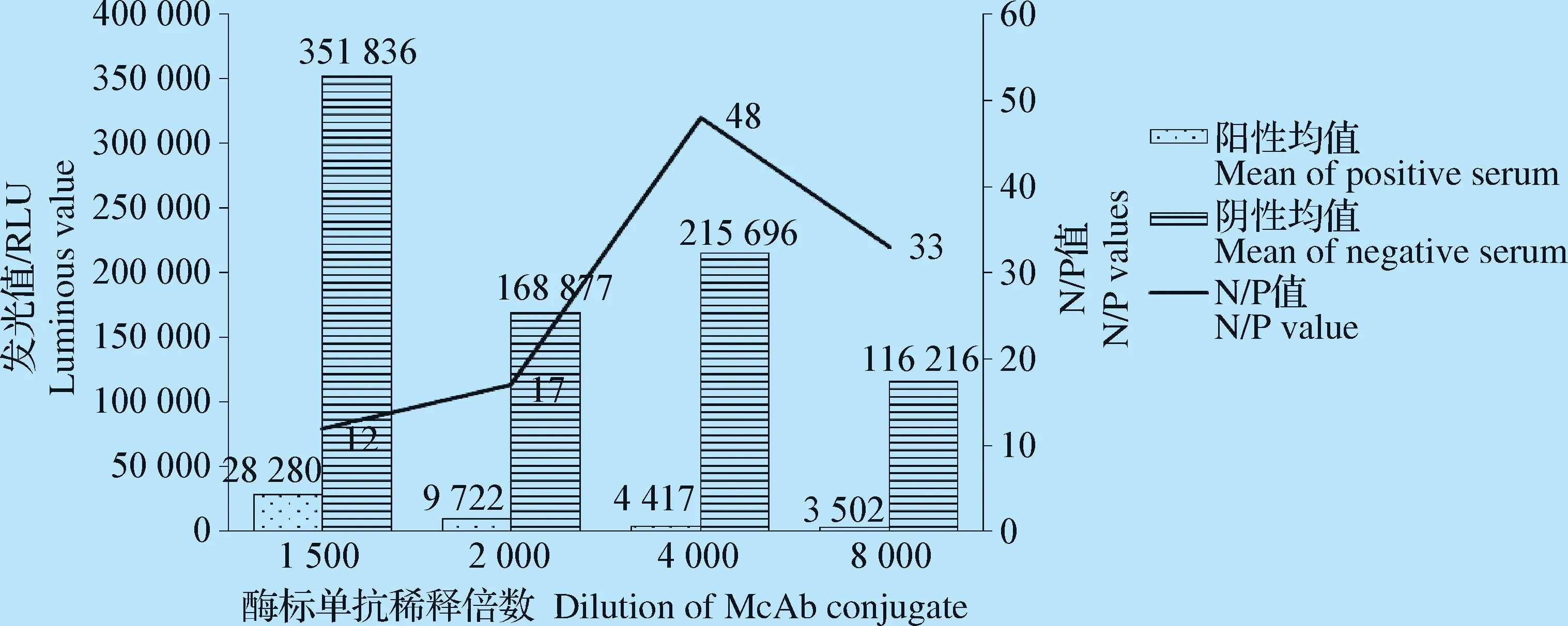
图3 酶标单抗的最佳稀释倍数的确定Fig.3 Determination of the best dilution multiple of enzyme labeled antibody
2.2.2 封闭液的选择 通过对不同封闭液组分的比较,结果显示,含1%酪蛋白的PBST溶液能有效的降低本底值,N/P值最大,故将本方法的封闭液组份确定为含1%酪蛋白的PBST溶液(图4)。
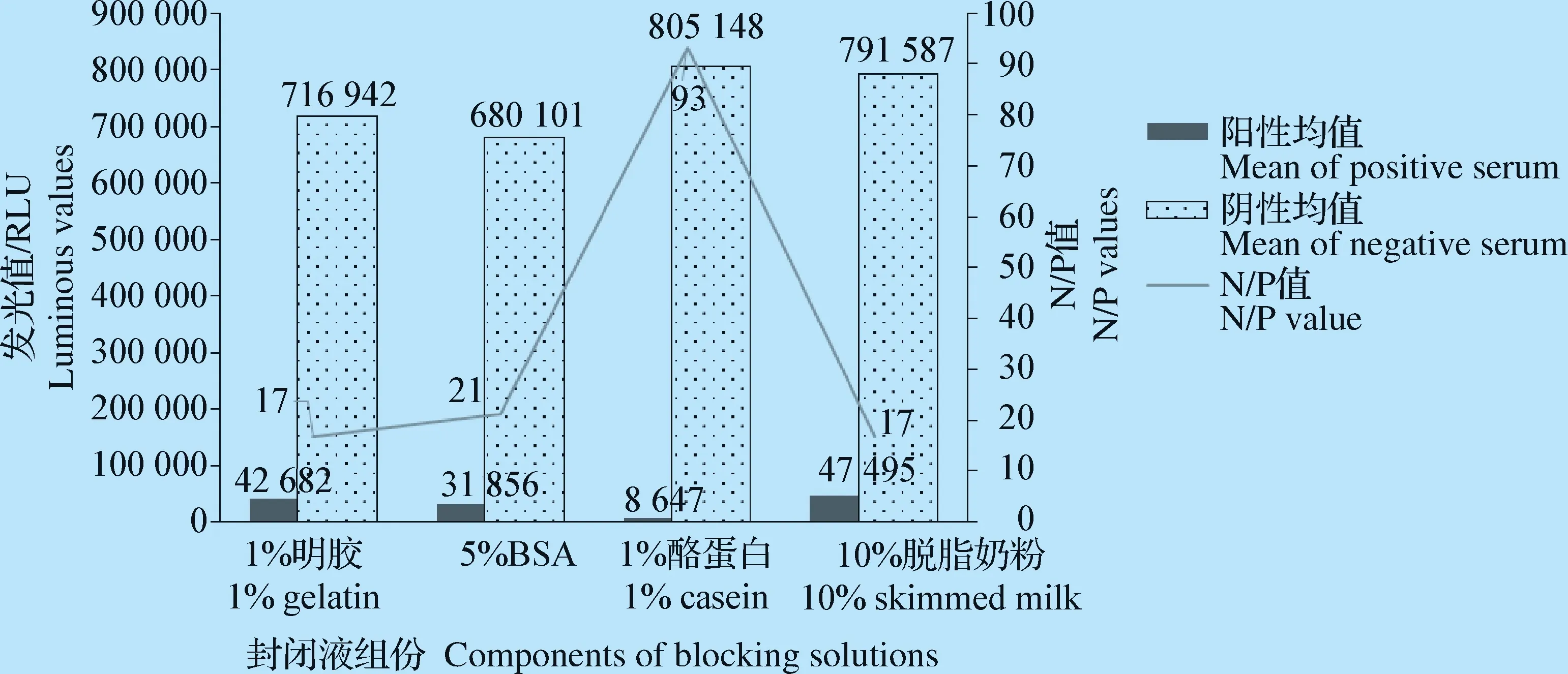
图4 封闭液组分的确定Fig.4 Determination for components of blocking solutions
2.2.3 最佳包被条件和封闭条件的确定 试验证明,包被蛋白在37 ℃环境中包被3 h,包被效果最佳(图5);加入封闭液后在37 ℃条件下封闭2 h,N/P值最大,封闭效果最佳(图6)。
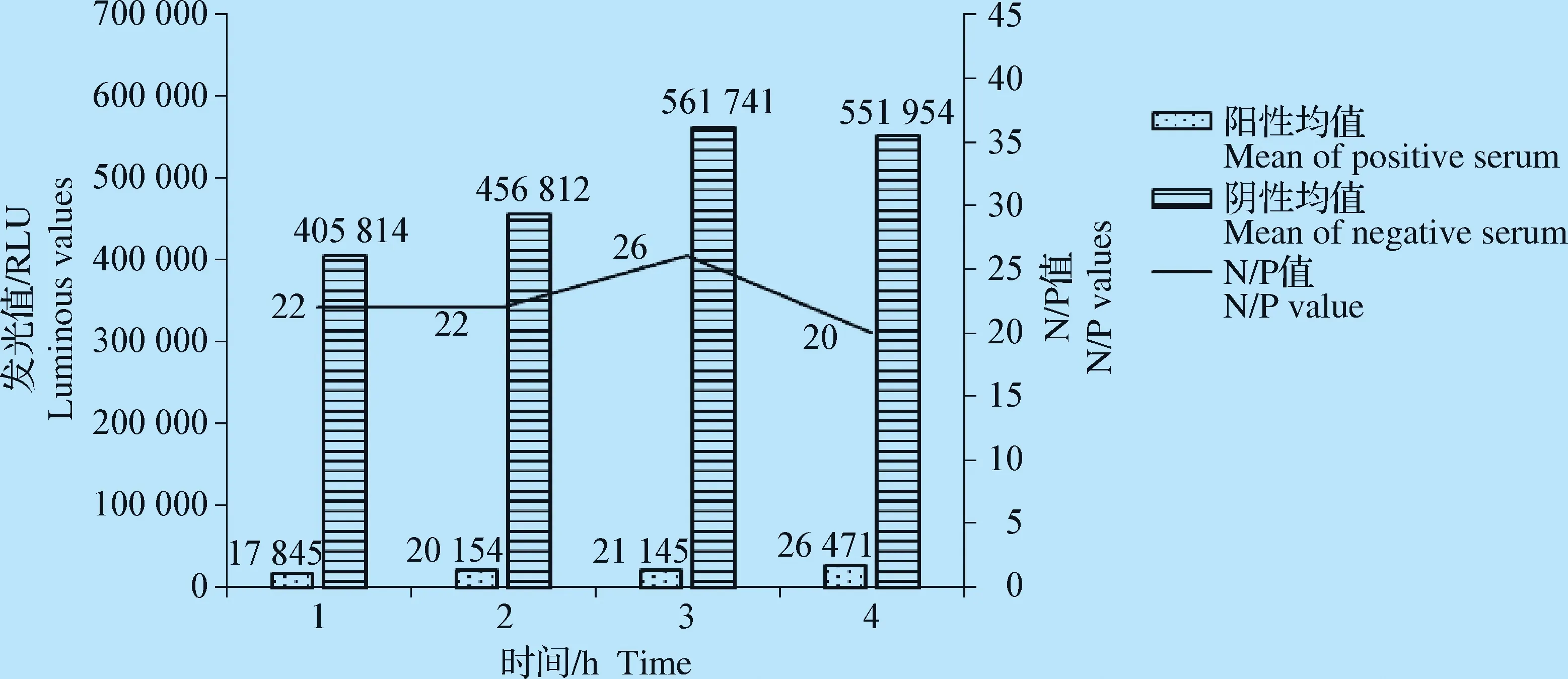
图5 抗原最佳包被时间的确定Fig.5 Determination of the best coating time
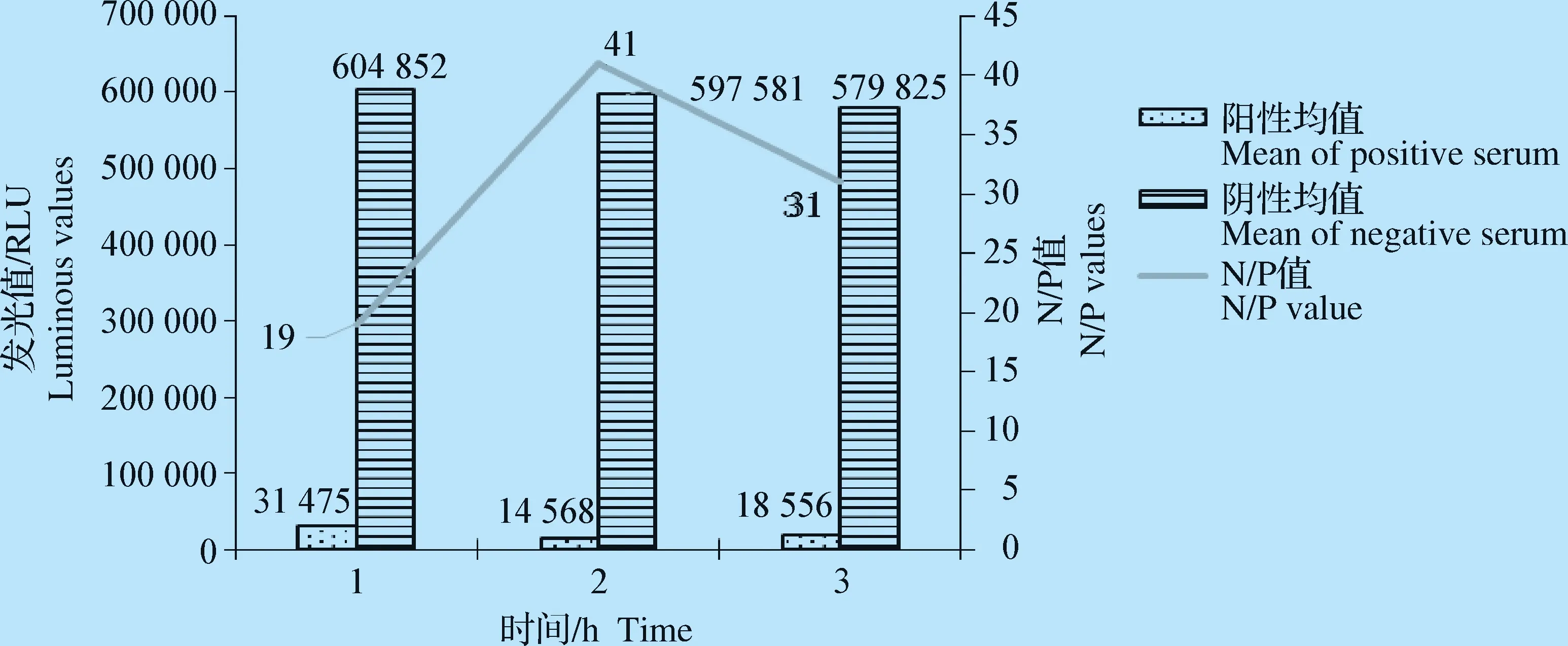
图6 最佳封闭时间的确定Fig.6 Determination of the best blocking time
2.2.4 抗原与待检血清/酶结合物和底物最佳反应时间的确定 通过优化试验证明,抗原与待检血清/酶结合物在37 ℃条件下作用30 min时,N/P值为最大(图7)。底物液作用5 min和10 min时,N/P值最大,因此确定5 min为底物最佳作用时间(图8)。
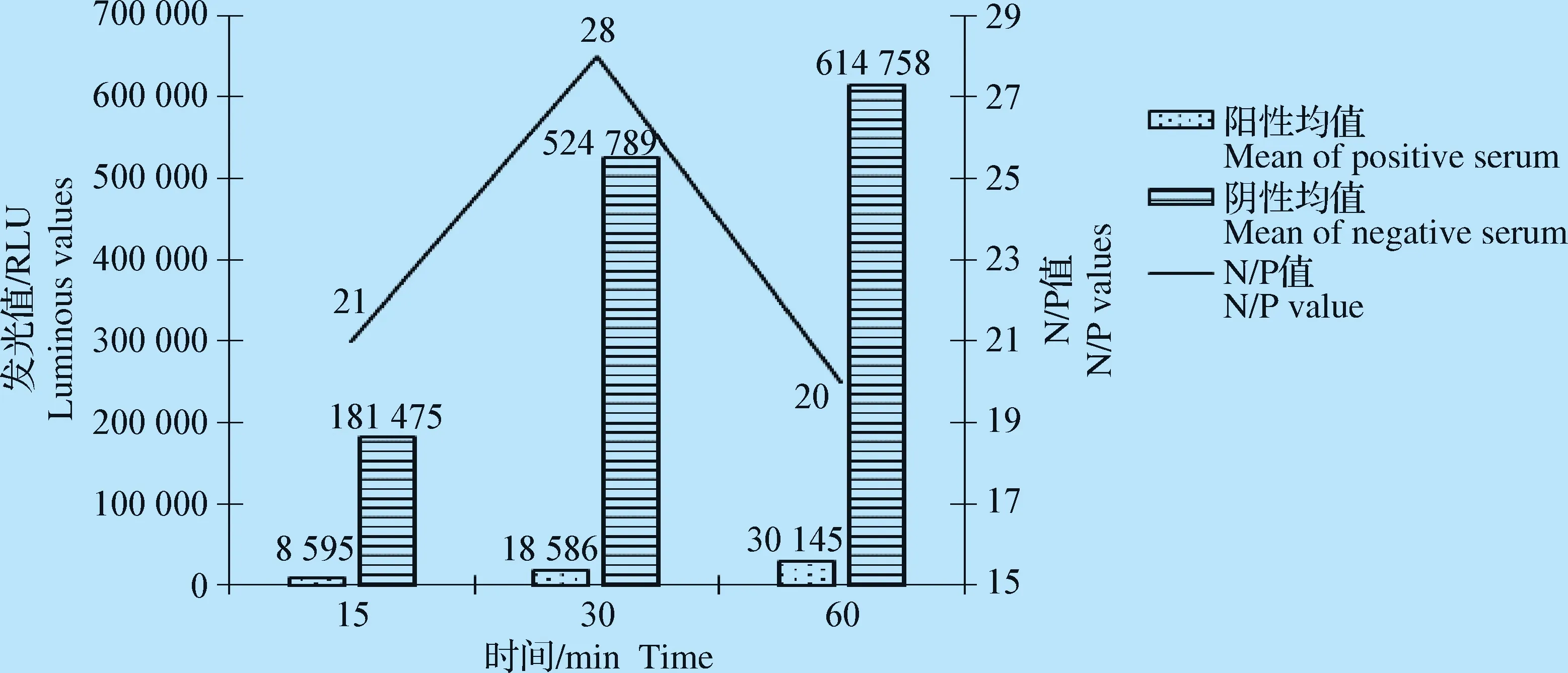
图7 抗原与待检血清/酶结合物最佳反应时间的确定Fig.7 Determination of the best time for antigen and serum/ McAb conjugate reaction
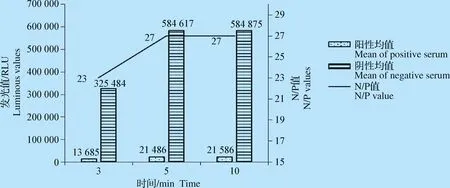
图8 底物最佳反应时间的确定Fig.8 Determination of the best time for substrate
2.3 临界值的确定 对501份质控血清进行检测,阴、阳性血清的抗体剂量值分布在不同的范围,但个别血清的抗体剂量值存在交叉(图9)。利用SPSS 16.0软件对检测结果进行数据分析,绘制ROC曲线,Youden指数最大值为0.933 472,所对应的抗体剂量值为20.04 NCU/mL。因此,将本方法的临界值确定为20 NCU/mL,最终将本方法判定标准定为:样本抗体剂量值≥20 NCU/mL时,为猪瘟抗体阳性;样本抗体剂量值<20 NCU/mL时,为猪瘟抗体阴性。在此判定标准下,此临界值对应的敏感性为96.67%,特异性为96.68%(图10)。

图9 阴、阳性质控血清样本的检测Fig.9 Antibody doses distribution of positive and negative sera

图10 ROC曲线和临界值确定Fig.10 ROC curve and cut-off value
2.4 交叉反应试验 用本方法分别检测PPV、BVDV、PRV、PCV-II、PRRSV阳性猪血清,所有血清的发光值均<20 NCU/mL,为猪瘟抗体阴性,说明本方法与上述猪常见猪病抗体无交叉反应。
2.5 与阻断试剂盒的比较 田间采集391份血清,采用本方法和阻断试剂盒同时进行检测,2种试剂盒共同检测出168份阳性和184份阴性,二者的符合率可达90.03%(表1)。
从表1中可以看出,2种试剂盒检测血清样本中,共有32份血清的检测结果是完全不符的,因此将这32份血清采用FAVN方法进行定性检测。2种方法与FAVN的符合情况见表2和表3。从结果中可以看出,化学发光方法和阻断试剂盒与FAVN方法的符合率分别为62.5%和37.5%,说明化学发光方法与FAVN的符合率更高。

表1 化学发光方法与阻断试剂盒符合率Table 1 The coincidence between CLIA method and blocking kit
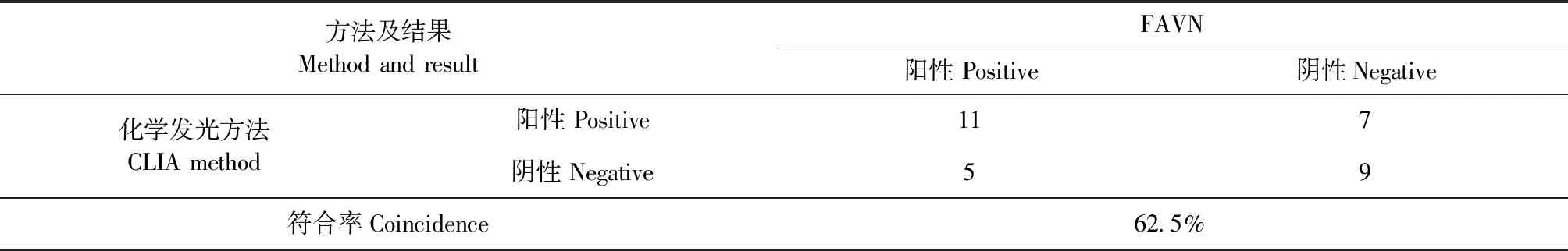
表2 化学发光方法与FAVN的符合率Table 2 The coincidence between CLIA and FAVN
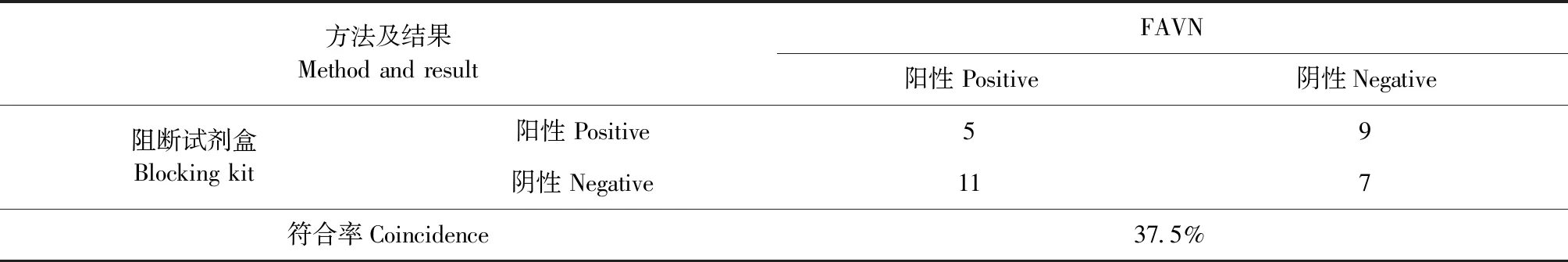
表3 阻断试剂盒与FAVN的符合率Table 3 The coincidence between blocking kit and FAVN
3 讨论
猪瘟抗体检测是评价猪瘟疫苗免疫效果的主要指标,是目前猪瘟疫病监测的主要参数之一。本方法通过对单克隆抗体的筛选,选择了1株具有适宜亲和力的单克隆抗体,使其能够与待检血清同时加入到反应孔中,与包被蛋白竞争结合,进行一步检测,大大缩短了检测时间,降低了检测强度。而使用范围最广的进口试剂盒也采用了E2蛋白和单克隆抗体,但以阻断原理为主,待检血清和单克隆抗体需分两步加入到反应孔中,检测时间和工作强度均高于本方法。
CLIA是一种集灵敏的化学发光分析和特异的抗原抗体免疫于一体的检测技术,具有特异性好、敏感性高、分离简便、快速、无毒无污染和安全稳定等特点[14]。目前该技术已经广泛用于多种疫病的检测[15-20]。崔辰等[21]用CLIA建立了检测猪O型口蹄疫病毒抗体的免疫检测方法,结果证明,该方法具有较好的特异性和重复性,且灵敏度高于传统的ELISA方法。但目前该方法尚未用于猪瘟抗体检测领域,本文建立的猪瘟病毒化学发光竞争ELISA抗体检测方法填补了这一空白。另外,本方法通过四参数拟合方法绘制出标准曲线,可以将发光值换算为抗体剂量值,不仅使抗体的检测结果实现相对定量,又能够避免检测的系统误差。因此,本方法适合于猪瘟的田间大规模普查,具有较好的应用前景。
