少年足球运动员运动性疲劳后的差异代谢物筛选*
2020-03-05王一民史银斌曹卫华池爱平
郭 飞, 向 茹, 王一民, 史银斌, 曹卫华, 池爱平, 曹 犇
((陕西师范大学体育学院, 陕西 西安 710119)
运动性疲劳产生的生理原因与能量消耗、代谢物堆积、自由基生成过多等有关[1]。合理的运动性疲劳能够进一步提高机体的运动机能水平,而通过合适的训练手段使机体达到合理的运动性疲劳状态,也是科学训练的目的之一。因此,对于运动性疲劳的科学检测,具有重要的实际意义。目前人们多采用常规的生理指标(如心率与血压等)、生化指标(如血尿素氮与血乳酸等)以及主观自觉用力程度分级量表(rate of perceived exertion, RPE)等用于运动性疲劳的检测[1],而较少对机体内小分子代谢物的变化进行监测。
足球运动项目对运动员的有氧运动能力和无氧运动能力均有较高要求,足球运动员的运动性疲劳产生必然与其机体的有氧代谢和无氧代谢水平有关。对于少年足球运动员而言,由于其机体处于生长发育阶段,具有能源物质代谢快、机体易疲劳等特点,因而其在运动性疲劳后代谢物的变化必然具有一定的特异性。代谢组学是检测机体小分子代谢物变化的一种常用方法,已有研究将其应用在运动人体科学研究领域[2]。因此,为了探索少年足球运动员在运动性疲劳后差异代谢物的变化特征,本研究模拟足球运动的能量代谢特点,建立少年足球运动员有氧运动和无氧运动相结合的运动模型,采用气相-质谱法(gas chromatograph-mass spectrometer, GC-MS),对其运动性疲劳后的尿液差异代谢进行检测与筛选,为少年足球运动员的科学训练提供理论依据。
1 对象与方法
1.1 研究对象
研究对象来自陕西省少年体校12名男性足球运动员,年龄14~16岁。研究对象均满足本实验的入选标准:① 身体健康,无任何疾病;② 参加专业训练年限3~4年,均达到我省足球预备队选拔要求;③ 运动前,通过RPE量表确定没有任何身体疲劳积累;④ 均无抽烟与饮酒习惯。在获得本人、学校和监护人的同意后,进入本实验流程。本实验方案与实验过程获得陕西师范大学学术与伦理道德委员会的许可与监督。
1.2 运动模型的建立与评定标准
在参考相关文献[3]的基础上,建立一个有氧运动+无氧运动的功率自行车复合运动训练模型,其中,有氧运动采用奥斯特兰德(Astrand-ryhmin)运动模式[4],即:运动员完成6 min踏骑运动(负荷:150 W,转速:60~65 r/min);无氧运动采用温盖特(Wingate)无氧运动模式[5],即:运动员完成30 s最大速度踏骑运动,负荷按照测试者体重设定;每组运动包含1次有氧运动和1次无氧运动,中间间隙休息时间为1 min;重复运动组数为3组,组间休息时间为3 min;运动方案见图1所示。
运动员在进行30 min的热身活动后开始上述重复的复合运动,同时佩戴polar表(RS800sd,芬兰)记录运动员不同时间点的心率;此外,记录运动员每组运动后的最大摄氧量(VO2 max)、平均无氧功率和RPE值。运动性疲劳的判定标准:运动后RPE量表达到 17~19级[6,7],并且测定运动当日晨、运动后3 h和次日晨的尿蛋白,确定测试者尿蛋白当日晨显阴性、运动后3 h显阳性且次日晨显阴性[1],确保运动员运动性疲劳的造模成功。
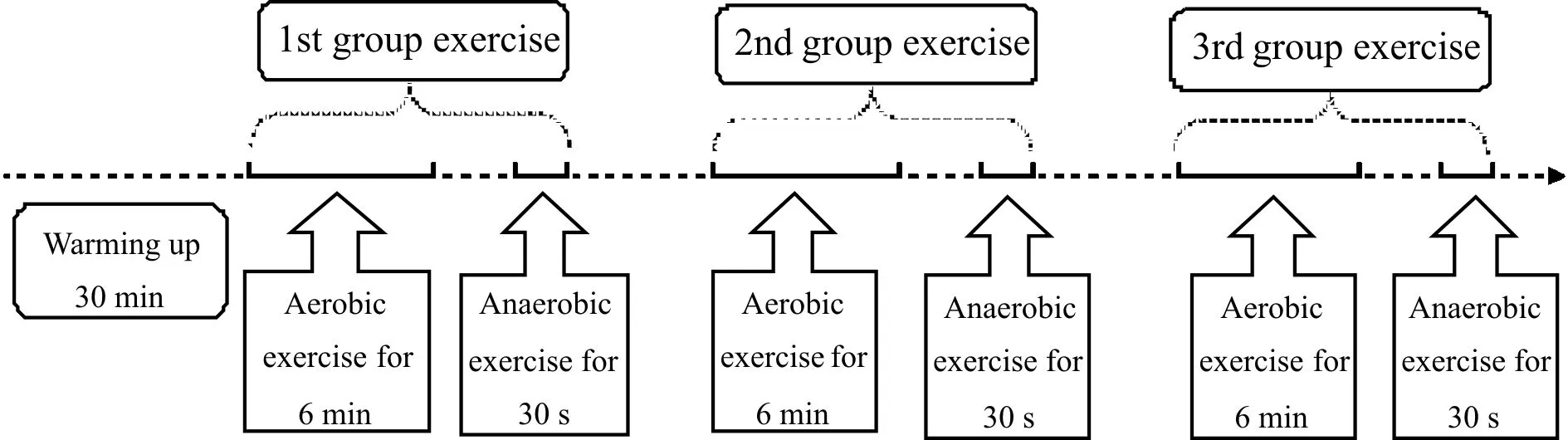
Fig. 1 Exercise protocol of teenage football players
1.3 尿样采集
为了避免饮食与体力活动等对代谢组学检测造成干扰,在实验前1 d开始,12名研究对象统一饮食、进行日常活动和非大强度运动。分别于准备活动前30 min和整个模型运动结束后3 h采集运动员的中段尿液1 ml,加入质量体积为0.5/1000(w/v)的叠氮钠防腐,之后置于-80℃保存待测。
1.4 GC-MS法检测
取100 μl尿液样本,每管加入L-2-氯苯丙氨酸20 μl(内标),离心10 min(10 000 r/min)取上,干燥后加入80 μl甲氧胺盐80℃孵育30 min;再加入100 μl的N,O-双(三甲基硅烷基)三氟乙酰胺 70℃孵育120 min后冷却至室温,再加入10 μl饱和脂肪酸甲酯标准混合液,混匀后上机检测。检测仪器为Agilent 7890气相色谱-质谱联用仪;测试条件:进样量1 μl,采用不分流模式;柱温50℃保持1 min,以10℃/min的速率增加到300℃,维持7 min;离子源温度220℃,扫描方式50~500 m/z。
1.5 统计学处理

2 结果
2.1 运动员在运动中的VO2 max和平均无氧功率的比较
少年足球运动员在3组运动中的VO2 max和平均无氧功率测试结果见表 1。

Tab. 1 Results of VO2 max and average anaerobic power after exercise n=12)
表 1 结果显示,测试对象在3组的运动中VO2 max值维持在一个恒定的水平,变化不明显;运动员在第1组和第2组运动的平均无氧功率值之间变化不显著,但是第3组运动后平均无氧功率值与第1组运动后相比较,呈显著下降趋势(P<0.05)。说明在本实验的3组运动中,运动员的有氧运动能力变化不明显,而其无氧运动能力有一定程度下降。
2.2 尿液差异代谢物筛选结果
2.2.1 尿液样本采集与GC-MS检测结果 通过对运动员进行3组运动末RPE量表的询问,结果均为18~19级;且所有测试者尿蛋白在整个运动模型结束后显阳性,次日晨11名测试者尿蛋白恢复至阴性,提示其运动性疲劳有较好的恢复;另外有1人次日晨尿蛋白依然显示阳性,提示其运动性疲劳没有很好的恢复,为了检测数据的准确性,对该运动员运动后的尿液样本不予GC-MS测试。样本经过处理后进行GC-MS的检测,得到的总离子流色谱图(total ion current, TIC)如图2所示。
图2是整个运动模型前后运动员尿液样本的GC-MS总离子流质谱图。运动前和运动后总计检测出635个代谢物的质谱峰,从样本代谢物的总离子流色谱图结果来看,两组代谢物的质谱峰群的差异性较明显,其中运动前的代谢物的质谱峰群较为密集,说明运动员在参与该运动模型后,机体内物质与能量代谢系统产生了较大变化。

Fig. 2 Total ion chromatograms of GC-MS detection
2.2.2 代谢物质谱峰数据的PCA和OPLS-DA分析 对上面得到的635个代谢物的数据进行标准化处理和过滤,再使用SIMCA软件对数据进行归一化后,对数据进行PCA分析和OPLS-DA分析。PCA分析和OPLS-DA分析的结果如图3所示。

Fig. 3 PCA and OPLS-DA analysis of urine metabolites
PCA得分图是对原始数据样品分布的一个总体呈现,从得分图(图3 A)可以看出,运动前的样本PCA得分分布在Ⅰ、Ⅲ、Ⅳ象限,运动后的样本PCA得分分布在Ⅰ、Ⅱ、Ⅲ象限,二者在第Ⅰ象限有重叠部分,因此,为了完全分开这两种情况下的差异代谢物信号,需进一步对数据进行OPLS-DA分析,过滤掉相关性不高的差异代谢物正交信号。OPLS-DA分析结果见图3 B所示, 运动前的OPLS-DA得分分布在Ⅱ、Ⅲ象限,而运动后的OPLS-DA得分分布在Ⅰ、Ⅳ象限,说明在OPLS-DA分析筛选后,两组差异代谢物的分离效果比较理想。
2.2.3 差异代谢物的筛选 将OPLS-DA分析后的代谢物数据信息输入KEGG数据库,根据代谢物的信息与KEGG数据库中对应的代谢物信息进行比对,依据代谢物的相似度大于700、代谢物贡献值VIP大于1和组间比较的t检验概率P值小于0.05作为差异代谢物的筛选标准,最终筛选到25个差异代谢物(表2)。

Tab. 2 Selected differential metabolites after exercise
被筛选的差异代谢物与氨基酸代谢有关。运动疲劳后,羟胺(hydroxylamine)、柠檬酸(citric acid)和山梨糖醇(sorbitol)这3个差异代谢物与运动前相比较,其信号强度呈现显著性升高(P<0.05,P<0.01),三者依次与氮代谢、三羧酸代谢、半乳糖代谢相关。其余22个差异代谢物的信号强度在运动后均不同程度显著性下降。
2.2.4 差异代谢物的代谢通路归属 上述25个差异代谢物所涉及的代谢通路较多,需要将其输入MetPA数据库进行代谢通路权重得分比较,才能确定这些差异代谢物所影响的主要通路。上述差异代谢物的代谢通路归属结果见图4。
图4结果显示,以差异代谢物在相应代谢通路中的权重影响力得分大于0.05作为其代谢通路归属的筛选标准,有5条代谢通路符合筛选标准,按照其权重影响力大小排序,依次是:甘氨酸-丝氨酸-苏氨酸代谢(glycine, serine and threonine metabolism)、三羧酸循环(tricarboxylic acid cycle)、酪氨酸代谢(tyrosine metabolism)、氮代谢(nitrogen metabolism)和甘油磷酯代谢(glycerophospholipid metabolism),这几条代谢通路归属于蛋白质代谢、三羧酸循环和脂代谢等通路。

Fig. 4 The impact score of the metabolic pathways
3 讨论
从物质与能量代谢的角度,足球运动是一项典型的有氧与无氧代谢相结合的复合性运动项目。优秀的足球运动员必须具备较好的有氧代谢能力和无氧代谢能力。本研究实验对象选取的少年足球运动员是陕西省足球队的预备队员,对其运动能力与训练监控研究对于提高我省足球竞技水平具有重要的意义。本研究通过功率自行车建立有氧运动和无氧运动结合的运动模型,模拟少年足球运动员在实战中的运动强度,最终达到运动性疲劳。实验结果显示,在该运动模型下,运动员均达到运动性疲劳的状态;在3组的运动训练中,运动员的最大摄氧量均维持在恒定水平,但其平均无氧功率呈现下降趋势。代谢组学是目前常用的生物检测手段。同时,国内外很多研究将其应用在运动训练中,包括有氧运动[10,11]、无氧运动[12,13]以及普通人群的体育锻炼中[14]。从运动模型的角度来分析相关的代谢通路,一般高强度间歇训练可检测到生物能量代谢通路的变化,例如脂代谢、蛋白质代谢、三羧酸循环等。而中等强度的持续性训练,则不会出现上述代谢通路的变化[15],因此,运动强度可能是引起运动员机体代谢通路出现变化的关键因素。本研究设计的运动模型是有氧运动和无氧运动结合的模型,属于大强度间隙训练,训练结束后运动员产生运动性疲劳。
本实验结果证实,少年足球运动员运动后出现显著变化的代谢与蛋白质代谢、三羧酸循环和脂代谢紊乱相关,这个结果与Shlomit等[16]的研究结果具有相似性。在大强度运动中,糖原是肌肉收缩的主要能源物质,随着运动时间的延长,一定量的蛋白质分解代谢会发生,其释放的能量来补充糖原供能的不足,随着运动型疲劳的产生程度,蛋白质代谢的程度也相应增加。本研究结果显示,在运动性疲劳后均明显降低的标记物有:甘氨酸-丝氨酸-苏氨酸代谢中的肌氨酸、L-别苏氨酸、肌酸、丝氨酸;酪氨酸代谢中的琥珀酸和4-羟基苯乙酸;而氮代谢中的羟胺含量反而明显增加,提示少年足球运动员发生运动型疲劳之后,其甘氨酸-丝氨酸-苏氨酸、酪氨酸代谢通路可能出现紊乱情况,同时氮代谢通路紊乱显示其存在“负氮平衡”的可能性。类似的研究也证明,举重运动员疲劳后,其组氨酸和甘氨酸相对含量降低,而耐力运动员组氨酸和酪氨酸含量降低[17];对于少年运动员有氧运动后代谢物变化的研究发现:甘氨酸-丝氨酸-苏氨酸、支链氨基酸等多种氨基酸含量降低[16]。上述研究结果说明不同运动类型引起的差异代谢物也不同,而对于少年运动员来说,运动型疲劳导致的氨基酸代谢紊乱以及“负氮平衡”依然是主要特征。
三羧酸循环是运动时能源物质代谢的中间环节,而琥珀酸和柠檬酸是该代谢通路中关键的代谢物。有研究表明,耐力运动员运动性疲劳后琥珀酸含量显著降低而柠檬酸含量显著增加,而力量运动员未发现同样的变化[17]。本实验结果显示,运动员运动后尿液差异代谢物中,琥珀酸显著降低而柠檬酸显著增加,说明有氧与无氧运动结合的复合运动模型导致的运动性疲劳与三羧酸循环紊乱有关。
众所周知,脂肪酸通常是长时间的中、低强度运动的主要能量来源[18]。目前研究发现,脂肪酸代谢系列中的甘油磷脂代谢,在剧烈运动后会受到明显的影响[19]。由于甘油磷脂是细胞膜的主要成分,对细胞膜识别蛋白质以及生物信号传导等功能发挥重要作用[20]。因此,推测剧烈运动引起的机体细胞传导功能紊乱可能与该通路紊乱有关。同样,本次实验的结果证实少年足球运动员在运动型疲劳后,其尿液样本代谢物中乙醇胺的含量显著下降,该物质也是甘油磷酯代谢通路中关键代谢物,提示乙醇胺可作为该运动模型下甘油磷酯代谢的一个生物标记物。
综上所述,本研究通过有氧与无氧运动结合的运动模型,筛选出少年足球运动员发生运动性疲劳后的差异代谢物,可能与机体的部分氨基酸代谢、甘油磷酯代谢以及三羧酸循环紊乱有关。上述代谢通路中发生显著变化的差异代谢物为肌氨酸、L-别苏氨酸、肌酸、丝氨酸、琥珀酸、柠檬酸、4-羟基苯乙酸、羟胺和乙醇胺,这些差异代谢物在后续的研究中,可通过靶标代谢组学的检测方法进行定量化研究后,有望成为评估少年足球运动员运动性疲劳的生物标记物。
