格列齐特对糖尿病大鼠心肌的保护作用及其机制*
2020-03-05潘文强王书凡丁伯平黄帧桧
潘文强, 王书凡, 丁伯平, 黄帧桧
((皖南医学院药理学教研室及中药药理国家三级实验室, 安徽 芜湖 241002)
近年来糖尿病发病率逐年上升,糖尿病心肌病(diabetic cardiomyopathy,DCM)是由糖尿病引起,与冠心病及微血管疾病发病机制不同的特异性心肌损害疾病[1]。DCM的发病机制较为复杂,目前认为氧化应激、炎症、心肌纤维化、细胞凋亡等参与该病的发生,主要表现为心脏舒缩功能障碍,最终发展为心力衰竭,与正常人相比,DCM患者发生心脏疾病的概率明显增加,是导致糖尿病患者死亡的主要原因之一[2-5]。
格列齐特(Glic)属于第二代磺酰脲类降糖药,临床上广泛用于治疗II型糖尿病,Glic可以促进胰岛素分泌降低血糖,同时能够降低血小板粘附力,改善血小板聚集,由于其独特的氮杂环结构,Glic可以清除氧自由基,因此Glic在降糖的同时,对糖尿病的并发症也有一定的改善作用[6-7]。格列本脲(Glib)同属于磺酰脲类降糖药,本品通过刺激胰岛β细胞释放胰岛素,其作用强度较强,因此所用剂量明显减少。盐酸法舒地尔(Fas)属于Rho激酶抑制物,可以抑制高血压和改善心肌肥厚[8]。目前关于Glic对糖尿病心肌病的研究较少,本实验通过建立糖尿病大鼠模型,分别给予Glic、Glib和Fas,通过与后两者的对比,探讨Glic对糖尿病大鼠心肌损伤的影响并探讨其机制,为临床治疗糖尿病心肌病提供理论依据。
1 材料与方法
1.1 实验动物
60只雄性SD大鼠,体质量(220±20)g,许可证号:SCXK(浙)2014-0001,购于南京青龙山繁殖场,温度(23±2)℃,动物自由饮水和进食。
1.2 实验仪器
EL-800多功能酶标仪(BIO-TEK,USA);-80℃冰箱(Thermo Fisher科技公司);Mini PROTEAN转模系统(美国BIO-RAD公司);BX-41型奥林巴斯显微镜(OLYMPUS公司);22R高速冷冻离心机(Beckman Coulter)
1.3 药物与试剂
格列齐特(施维雅制药有限公司);盐酸法舒地尔注射液(天津红日药业股份有限公司);STZ(源叶生物有限公司);血糖仪和血糖试纸(三诺生物传感股份有限公司);糖化血红蛋白(HbA1c)测定试剂盒、总胆固醇(TC)测定试剂盒(南京建成有限公司);TUNEL试剂盒(南京凯基生物科技发展有限公司);RhoA、ROCK1、eNOS抗体(Abcam公司);BCL-2抗体(Affinity公司);Bax抗体(北京博奥森生物技术有限公司)
1.4 模型的建立与给药
雄性SD大鼠60只,适应性喂养7 d,随机选10只喂养普通饲料作为正常对照组(NC组),其余50只喂养高糖高脂饲料4周后,禁食不禁水12 h,使用0.1 mol/L柠檬酸缓冲液配制1% STZ溶液,腹腔注射(45 mg/kg,pH 4.4)诱导糖尿病。注射72 h后,随机抽取测定FBG≥16.7 mmol/L作为糖尿病模型建立成功[9]。造模成功的38只糖尿病大鼠随机分为模型组(MC组,n=9)、格列齐特组(Glic组,80 mg/kg,n=10)、格列本脲组(Glib组,2.5 mg/kg,n=10)、法舒地尔组(Fas组,10 mg/kg,n=9)。Glic组和Glib组采取灌胃,Fas组进行腹腔注射,每天一次,NC组和MC组每天灌胃同体积的蒸馏水,连续8周,每周测定一次空腹血糖和体质量,按体重调整给药物剂量。
1.5 状态的观察和指标检测
观察各组大鼠皮毛、状态、精神情况等,每周测定一次体质量和血糖。实验结束时,使用10%水合氯醛(330 mg/kg)腹腔注射麻醉,腹主动脉取血,分离血清并按照试剂盒的要求测定血清HbA1c、TC、TG、HDL-C、LDL-C;按照试剂盒要求测定MDA含量和SOD活性。摘取心脏生理盐水冲洗干净后,测定心脏重量,按照公式计算心脏质量指数(HWI),HWI=心脏质量/体质量(mg/g)。
1.6 心肌组织的病理学观察
待大鼠麻醉后腹主动脉取血,快速取出心脏并用生理盐水冲洗,取心脏的三分之一心尖处置于10%甲醛溶液固定,梯度乙醇脱水后石蜡包埋切片,置于伊红水溶液中进行染色3 min之后,再次脱水封片,显微镜下观察心肌组织病理学的变化。
1.7 心肌纤维化的检测
腹主动脉取血后,摘取心脏生理盐水冲洗,切取心尖组织以10%甲醛溶液固定,梯度脱水后石蜡包埋后切片,然后进行梯度乙醇脱蜡,按试剂盒要求进行Masson染色。心肌胶原容积分数(collagen volume fraction,CVF)的计算,每组随机选用5个视野,使用分析软件Image-Pro Plus 6.0进行计算,CVF=胶原面积/视野总面积,取平均值。
1.8 心肌细胞TUNEL凋亡检测
取心脏的三分之一心尖处置于10%甲醛溶液固定,常规石蜡切片5 μm,取石蜡切片按照TUNEL凋亡试剂盒的要求加入TUNEL反应液,TUNEL阳性细胞核内可见棕黄色颗粒,阴性细胞呈现淡蓝色。在光学显微镜下拍照,每个切片至少观察20个不重叠区域,每组随机选取5个不同视野,计算每个视野凋亡率=TUNEL阳性细胞数/总细胞数×100%,取平均数。
1.9 Western blot检测心肌RhoA、ROCK1、eNOS、Bcl-2和Bax蛋白表达
按步骤测定ras同源家族成员A(Ras homolog gene family member A,RhoA)、Rho相关蛋白激酶1(Rho associated coiled coil forming protein kinase l,ROCK1)、内皮型一氧化氮合成酶(endothelial Nitric-Oxide Synthase,eNOS)、B淋巴细胞瘤-2基因(B-cell lymphoma-2,Bcl-2)和BCL2-Associated X(BCL2-Associated X,Bax)的蛋白表达。取心脏组织45 mg,RIPA裂解液(含磷酸酶和蛋白酶抑制剂)裂解组织,采用BCA蛋白测定法检测蛋白浓度,在电泳凝胶中电泳后使用PVDF膜进行转膜。转膜完成后将膜置于5%脱脂牛奶中孵育2 h,再次加入RhoA、ROCK1、eNOS、Bcl-2、Bax和GADPH抗体在4 ℃下孵育8 h以上。使用辣根过氧化物酶标记的二抗,室温下孵育2 h,在凝胶图像分析仪下加入发光液来分析目的条带的光密度,采用image-pro PLUS处理软件分析图像。
1.10 统计学处理
2 结果
2.1 各组大鼠的一般状态观察及血糖和体质量变化
NC组大鼠皮毛光亮,状态良好,血糖稳定,体质量逐步上升。MC组大鼠毛色枯黄,精神萎靡,血糖上升,体质量下降明显。与MC组比,Glic组上述情况有明显改善,血糖降低,体重增加(P<0.01,表1,表2),Glib组血糖降低,体重有所增加,Fas组血糖及体重无明显差别。与Glic组相比,Glib组和Fas组体重下降(P<0.01,表1,表2)。
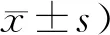
Tab. 1 Changes of fasting blood glucose (FBG) in each group (mmol/L,
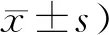
Tab. 2 Changes in body mass(BM) in each group (g,
2.2 各组大鼠的HW及HWI的变化
与NC组相比,MC组心脏质量指数增大(P< 0.01,表3);与MC组相比,Glic组和Glib组心脏质量指数降低,Fas组无明显改善;与Glic组相比,Glib组及Fas组心脏质量指数增大(P<0.01或P<0.05,表3),提示Glic和Glib可以改善糖尿病大鼠的心脏肥大,而Glic组改善更加明显(P<0.05,表3)。

Tab. 3 Changes of cardiac weight index in each
2.3 各组大鼠的血脂变化
与NC组相比,MC组大鼠HbA1c、TC、TG、LDL-C水平均有显著升高,HDL-C水平降低(P<0.01,表4);与MC组相比,Glic组HbA1c、TC、TG、LDL-C水平均有明显下降,HDL-C水平也有所提升(P<0.01,表4),Glib组HbA1c、TC、TG、LDL-C也有改善(P<0.01或P<0.05,表4),Fas组无明显变化。Glic和Glib可以调控糖脂代谢,改善血脂,而Fas不能。
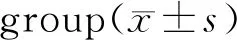
Tab. 4 Changes of blood lipid in rats of each
2.4 各组大鼠血清中SOD活性及MDA含量
与NC组相比,MC组大鼠血清中SOD活性明显降低,MDA水平增加;与MC组相比,Glic组SOD活性提高,氧化应激损伤物MDA含量明显减少,Fas组和Glib组SOD活力也有所提高,MDA含量减少(P<0.01或P<0.05,表5);与Glic组相比,Glib组及Fas组SOD活性下降,MDA含量增加(P<0.01,表5),提示各治疗组中Glic组改善氧化应激最为明显。

Tab. 5 SOD activity and MDA content in serum of rats in each
2.5 HE染色观察大鼠心肌组织形态学变化
NC组大鼠心肌细胞排列整齐致密,着色均匀且细胞结构清晰完整,MC组大鼠心肌细胞排列紊乱,可见大量心肌细胞肌浆溶解,MC组心肌细胞发生了明显损伤。与MC组相比,Glic组病变较轻,可见轻度的肌浆溶解,Fas组损伤有轻微改善,而Glib组未见明显改变(图1,见彩图页Ⅱ)。
2.6 Masson染色与TUNEL染色
Masson染色结果显示,NC组大鼠心肌组织中细胞排列整齐且细胞间质胶原纤维分布很少,染色面积少且染色较淡,MC组大鼠的心肌组织细胞分布杂乱且细胞间基质较多,被染色的面积明显增大。与MC组相比,Glic组和Fas组心脏组织细胞间隙减小且被染色的组织胶原也明显下降(P<0.01,图2,表6),Glib组纤维化有轻微改善(P<0.05,图2,表6)。Glic组与Glib组相比,前者改善心肌纤维化更加明显(P<0.01);Glic组与Fas组相比,两组之间无明显差异。提示Glic和Fas可以明显改善纤维化,而Glib有轻微改善作用(图2,见彩图页Ⅱ)。
TUNEL染色结果显示,正常细胞核呈淡蓝色,凋亡的细胞核呈棕褐色颗粒样(TUNEL阳性细胞)。NC组大鼠心肌细胞整齐且细胞核完整清晰,极少见阳性细胞,MC组中心肌细胞排列杂乱且细胞核呈褐色的阳性细胞明显增加,淡蓝色正常细胞显著减少,可见凋亡细胞数量明显上升(P<0.01,图3,表6)。与MC组相比:Glic组和Fas组阳性细胞数量明显减少(P<0.01),Glib组有轻微改善(P<0.05,图3,表6)。Glic组与Glib组相比,Glic能显著抑制心肌细胞凋亡(P<0.01);Glic组与Fas组相比,Glic抑制细胞凋亡作用更明显(P<0.05,图3,见彩图页Ⅱ)。

Tab. 6 Myocardial collagen volume fraction and apoptosis fraction in each
2.7 Western blot检测心肌RhoA、ROCK1、eNOS、Bcl-2和Bax的表达
与NC组相比,MC组大鼠心肌组织中RhoA、ROCK1及Bax蛋白水平显著升高,eNOS和Bcl-2表达明显减少(P<0.01,图4,表7)。给予Glic治疗之后,心肌组织中RhoA、ROCK1和Bax蛋白明显降低,eNOS和Bcl-2表达增加(P<0.01或P<0.05)。给予Glib治疗之后,eNOS及Bcl-2蛋白水平有轻微提高(P<0.05)。给予Fas治疗之后,RhoA、ROCK1、Bax蛋白显著降低(P<0.01),eNOS和Bcl-2蛋白表达升高(P<0.01或P<0.05,图4)。Glic组与Glib组相比,前者RhoA、ROCK1、Bax蛋白表达明显下降,Bcl-2蛋白表达升高(P<0.01或P<0.05);与Fas组相比,Glic组Bcl-2蛋白表达上调更加明显(P<0.05,图4,表7)。

Fig. 4 Expressions of RhoA, ROCK1, eNOS, Bcl-2 and Bax in myocardium in each group

Tab. 7 Quantitative analysis of the results of Western blot in each n=5)
3 讨论
糖尿病心肌病(DCM)作为糖尿病严重的并发症之一,早在1972年就曾提出,之后广泛运用于临床医学研究[10]。DCM的主要病理表现为心肌胶原纤维的大量沉积和心肌细胞异常凋亡,纤维化和凋亡共同作用导致心脏收缩功能障碍,最终引发心力衰竭。
为了评价Glic减轻氧化应激和抑制RhoA/ROCK信号通路减轻心肌损伤的作用,并与另一种磺酰脲类降糖药Glib和Rho激酶抑制剂Fas相比较,本实验通过采用高糖高脂饲料合并STZ建立糖尿病大鼠模型。MC组大鼠心脏质量指数增加,通过HE染色发现心肌细胞排列紊乱且细胞发生变形,可见心肌细胞肌浆溶解,Masson染色显示心肌细胞排列紊乱且被染色的阳性面积明显增加,TUNEL染色显示MC组大鼠心肌细胞大量凋亡,可以看出MC组心肌损伤严重,这些符合DCM的病理特征。
Rho蛋白属于小G蛋白Ras超家族,Rho激酶(Rho Kinase,ROCK)是RhoA的效应子,同属于丝氨酸/苏氨酸蛋白激酶家族成员,ROCK1蛋白主要在非神经中组织中表达,并在心血管功能中起调节作用,RhoA蛋白参与细胞的多种生理反应,当RhoA被相关受体激活时,可以调控细胞生长与凋亡以及胶原纤维的生成[11-12]。eNOS作为内皮型一氧化氮合酶是NO的主要生理来源,可以减少血小板聚集,增强心血管抗氧化的能力,维持正常的通透性,糖尿病大鼠缺乏eNOS时会导致心功能紊乱和心肌细胞的凋亡,因此eNOS在调节心血管功能中起到重要作用[13-14]。当RhoA被激活时,下游ROCK蛋白被活化,这种活化能够降低eNOS的mRNA稳定性,最终导致eNOS的表达减少[15]。RhoA/ROCK通路可以通过多种途径参与DCM的发生与发展中,在高糖环境下,RhoA/ROCK通路被激活,心肌中一氧化氮合酶(NOS)生成受阻,导致糖尿病大鼠的心肌抗氧化能力下降,直接或间接损伤心肌组织[16]。RhoA/ROCK信号通路还可以通过调控JNK(c-jun N-terminal Kinase)信号通路,增加Bax蛋白的表达,从而诱导心肌细胞凋亡增加[17]。高糖环境下,RhoA/ROCK通路异常活化可以激活并上调核因子κB(nuclear factor kappa B,NF-κB)的表达,并激活转化生长因子β1(transforming growth factor β1,TGFβ1)/Smad信号通路,最终导致纤维化的形成[18]。此外,氧化应激也是导致糖尿病大鼠心肌损伤和细胞凋亡加重的原因之一,长期的高血糖状态会损伤线粒体,增加活性氧的生成,并诱导体内抗氧化酶的糖基化,进一步加重体内抗氧化酶活性的下降甚至消失,心肌细胞的抗氧化能力下降,活性氧簇(ROS)直接损伤心肌细胞并导致细胞死亡[19]。
Glic作为第二代磺脲类降糖药物,广泛应用于II型糖尿病的临床治疗。糖尿病大鼠经Glic干预后,大鼠FBG、HWI、HbA1c、TC、TG、LDL-C显著降低,BM、HDL-C水平升高,大鼠血清中MDA含量降低,SOD活性升高,说明Glic可以改善糖尿病大鼠的氧化应激,增强心肌抗氧化能力。通过纤维化染色显示,模型组大鼠发生明显的心肌纤维化,而给予Glic可明显改善糖尿病大鼠的心肌纤维化。通过TUNEL染色可以看出,Glic治疗组心肌细胞凋亡数量显著下降,这一结果与本实验Western blot检测Bax和Bcl-2蛋白表达结果一致,Glic组上调Bcl-2蛋白表达,降低Bax蛋白水平,Glic可以使糖尿病大鼠心肌组织中RhoA及ROCK1蛋白水平明显减少,eNOS表达上升。
综上所述,糖尿病会造成大鼠心肌损伤,促使大鼠心肌RhoA/ROCK信号通路信号激活,导致糖尿病大鼠发生心肌纤维化和细胞凋亡,进一步加重糖尿病大鼠的心肌损伤。Glic可以通过降低血糖,改善心肌纤维化,缓解糖尿病所致的心肌损伤,还可以改善糖尿病大鼠氧化应激,调控RhoA/ROCK1/eNOS信号通路,减少细胞凋亡,从而对心肌起到保护作用。
