“反应热的测量”创新设计与观摩赏析
2020-03-04张金伟毛杨林
张金伟 毛杨林


摘 要:“反应热的测量”教学可以用中和反应热成像视频创设情境,引发学生自主测定中和反应前后溶液的温度变化,计算反应热,写热化学方程式,初步建构中和热的概念。然后渗透中和热测定的化学史,让学生自主发现测定误差,通过分析误差产生的原因,提出实验改进方法,并用改进后的实验装置重新测定中和反应的反应热,成功减小实验误差。最后学生自主提出酸、碱溶液的浓度与强弱对中和反应的反应热大小的影响,并用改进后的实验进行证实与证伪,深度理解和完善中和热的概念,建构定量实验方案设计的思维模型。
关键词:反应热测量;中和反应;定量实验
“科学探究与创新意识”是化学学科的核心素养之一,要求学生“认识科学探究是进行科学解释和发现、创造和应用的科学实践活动;能发现和提出有探究价值的问题;能从问题和假设出发,依据探究目的,设计探究方案,运用化学实验、调查等方法进行实验探究;勤于实践,善于合作,敢于质疑,勇于创新”[1]。“反应热的测量”是培养“科学探究与创新意识”素养的重要内容,但长期以来,很多教师都觉得这节内容很难上,因害怕反应热测不准而出现尴尬局面,因此常用视频实验一放了事。2019年9月20日,毛杨林名师网络工作室在衢州市菁才中学开展了主题为“化学课堂教学研究成果的展示与推广”的送教活动,我们欣喜地看到浙江师范大学附属中学吴文清老师展示的“反应热的测量”一课,颇具素养特质,让人眼前一亮,与会教师无不拍手叫好。现将这节课的创新设计及观摩赏析整理出来,以飨读者。
一、教学实录
【环节一】以热成像视频激发学生设计实验方案测定中和反应热,初步形成中和热概念
师:从壮观的热成像视频中我们清晰看到酸与碱反应会放出热量,请问:如果将50.0 mL 0.50 mol·L-1盐酸与50.0 mL 0.50 mol·L-1NaOH溶液混合,溶液的温度会升高多少度?如何测量呢?请大家思考。
生:用温度计先分别测盐酸、NaOH溶液的初始温度,再测反应后溶液的最高温度。
师:予以肯定。追问:在测量最高温度时应注意些什么呢?
生:测定过程要尽量避免热量散失,同时应多次测量取其平均值,以减少实验误差。
师:很好,为了保证测量时温度升高到最高,要用到量热计。(在幻灯片中展示简易量热计)
师:请同学们观察简易量热计的结构,推测相关组成部分的功能与作用。
生:容器筒用盖子盖起来,防止热量损失;内胆与外壳间填充泡沫塑料,起到保温作用,防止热量散失;温度计用于测量反应获得的最高温度;环形玻璃搅拌棒用玻璃制成,玻璃是热的不良导体,及时搅拌,促进溶液充分反应。
师:玻璃搅拌棒能不能改为铜棒?搅拌怎样操作呢?
生:不能用铜棒,因铜传热速度快,会导致实验误差大。应上下搅动。
师:同学们推测得很好,所有的设计及操作都是为了一个最终目的,即测量的精确性。
现在我给大家演示下简单的实验步骤。熟悉实验步骤后,请前后4位同学分为一组,1人负责量酸和碱温度,1人负责混合搅拌,1人负责读数记录,1人负责温度计清洗。请同学们严格按照规范要求进行操作,现在大家开始实验。(在幻灯片上展示实验步骤)
生:分组合作,测定中和反应前后的温度。
师:巡视,并不时与学生互动,或提问、或指导、或纠正。大约7min后,抽选3组同学汇报实验结果。
生:学生小组汇报数据记录。
师:定量实验一般至少需要测得3次实验数据,以减少误差。请分析表中3组数据是否都可以采用?
生:第三组的数据不可靠,应舍去。
师:第三组同学的中和反应,温度为什么几乎不升高呢?请分析原因。
生:我们小组离教室的立式空调最近,温度自然很难升高,也可能有其他影响温度升高的因素没控制好。
师:分析正确。请根据表中前两个小组的数据计算该反应放出的热量。
生:提问:根据Q = cmΔt,还需要知道溶液的比热容和密度,怎么计算?
师:因為酸、碱都是稀溶液,我们可以做近似处理,c(混)= c(水)= 4.18J·g-1·℃-1。
稀盐酸和稀NaOH溶液的密度也近似为1 g·mL-1。现在请同学们继续计算该反应放出的热量。
生:汇报结果:1.254×103 J。
师:从有效数字角度观察,这个结果是否合理?
生:根据本实验的条件和数据最多得到两位有效数字,结果应为1.3×103 J。
师:完全正确,为他鼓掌。
师:那么同学们能否根据该反应放出的热量写出该反应的热化学方程式呢?
生:板演:
师:同学们对这位同学写的热化学方程式有不同意见吗?
生1:除了H2O之外,其余物质的聚集状态应改为(aq)。
生2:中和反应为放热反应,应写成[Δ]H = -1.3 kJ·mol-1。
生3:应写成生成1mol水时的热化学方程式:
师:很好。在实际应用中,为了方便,通常用生成1mol H2O时的反应热来表示该中和反应的热化学方程式。(趁热打铁)我们把稀溶液中,强酸与强碱反应生成1mol H2O时放出的热量称为中和热。
【环节二】在化学史话中发现误差,激发学生分析成因改进实验,修正中和热概念
师:同学们测得的中和热为[Δ]H = -52 .0 kJ·mol-1,你觉得这个数据准确吗?下面,我们看看科学家测出的数据是多少?
1881年,法国化学家贝特罗(Pieltte Engene Marceiin Berthelot),在法兰西学院的实验室里,发明弹式量热计,精确测出中和热为-57.3 kJ·mol-1,即
H+ (aq)+ OH-(aq) =H2O(l) [Δ]H = -57.3 kJ·mol-1。
可见,两组实验小组得出的中和热数值偏低。其他实验小组有偏高的数据吗?
生:没有。
师:请同学们分析在实验中测得的中和热偏低的原因有哪些?
生:反应放出的热量有损失的原因:隔热效果不好;盖子盖得不够严实;搅拌棒与盖子间有孔隙且在上下搅拌时易掀开盖子;教室有空调。
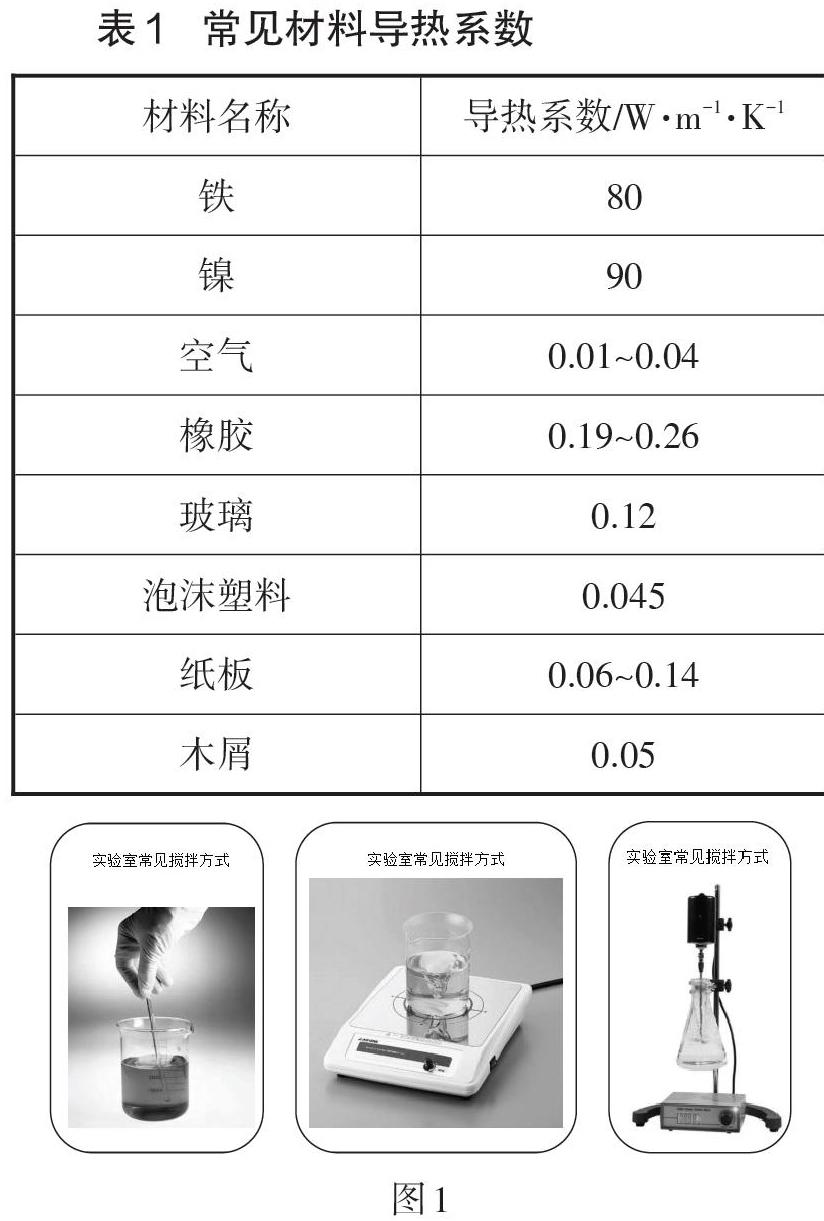
师:误差有系统误差和人为误差,固定的系统则系统误差无法降低,除非改变系统组成;人为误差通过规范的操作会减少但是仍然存在。这里提供了一些信息(见表1及图1)。
根据上述信息,你打算选择什么样的材料和搅拌方式进行改进呢?
生:选泡沫塑料、磁力搅拌(有利于密封,热量不损失)。
师:根据学生的改进意见,展示创新设计的“中和热的测定”实验装置:用泡沫盒直接做容器,并选用磁力搅拌方式。播放课前录制的微课:“中和热的测定”创新实验视频。从视频中可清楚地看到反应前后的温度变化及最终测定值,通过计算得到的中和热为[Δ]H = -55.2 kJ·mol-1,数值接近-57.3,系统误差减小了,这得益于我们系统的改进。还可能会有什么原因?
生:老师的操作更加规范。
师:精确定量实验对测量系统和规范操作都有较高的要求,同学们以后的实验操作尽可能规范到位。
【环节三】探究酸碱的浓度与强弱对中和反应热效应的影响,完善中和热概念
师:如果把本实验中的盐酸改为同体积同浓度的醋酸,反应热是否相同?
生:会变小,因醋酸是弱电解质,电离过程会吸收热量。
师:如果氢氧化钠溶液改为浓溶液,反应热是否相同?
生:会变大。浓度大的氢氧化钠溶液与盐酸混和稀释时,可能会放出热量。
师:如果用同体积同浓度的氢氧化钾溶液与硝酸反应,反应热是否相同?
生:相同。因氢氧化钾与硝酸都是强电解质,在稀溶液中已完全电离。
师:同学们的猜想是否正确呢?下面通过老师改进的实验装置进行验证。
(1)50.0 mL 0.50 mol·L-1醋酸与50.0 mL 0.50 mol·L-1氢氧化钠溶液反应。
(2)50.0 mL 0.50 mol·L-1盐酸与50.0 mL 5.00 mol·L-1氢氧化钠溶液反应。
(3)50.0 mL 0.50 mol·L-1硝酸与50.0 mL 0.50 mol·L-1氢氧化钾溶液反应。
生:根据上述实验中显示的温度变化,计算生成1mol H2O的反应热,分别是:
(1)ΔH = - 46.8 kJ·mol-1 ;(2)ΔH = - 61.8 kJ·mol-1;(3)ΔH = -55.2 kJ·mol-1。
师:实测结果,证明同学们的猜想完全正确。请同学们给中和热的概念下一个准确的定义。
生:稀的强酸溶液与稀的强碱溶液反应生成1mol H2O时放出的热量称为中和热。
【环节四】设计定量实验方案思维建模,探究其他反应热的测定方法
师:通过本堂课的学习,你认为设计一个定量实验方案应遵循什么样的思维模型?
生:讨论、汇报,师生互评,建构设计定量实验方案的思维模型:
明确实验目的→思考计算方法→确定要测量的数据→设计实验装置和操作步骤→实验获得数据→分析、处理数据→计算出结果→误差分析→发现问题、改进实验→探寻最佳方案。
师:是不是所有的反应热均可以通过实验测量呢?
2C(s)+O2(g)=2CO(g) ΔH = -221 kJ·mol-1,该反应的ΔH能否通过实验直接测定?请在课后通过预习课本或查阅资料提出解决该问题的方案。
二、亮点赏析
(一)教师的微表情活化了课堂氛围
教师的微表情在课堂教学中對学生具有引导效能、激励作用和评价功能。马卡连柯说:教师在教学中要善于使用各种微表情,活跃课堂气氛,提高学生学习兴趣[2]。吴老师在教学过程中始终面带微笑,用饱含激情的眼光关注学生的学习情绪,有意识地跟学生开玩笑活跃气氛。在重要关注点,使用重音,强调重点、提醒注意,吸引学生的注意力。在学生答错问题时,能微笑以对,态度和蔼,以疑问的眼神启发学生思考,以赞许的眼神、亲切的拍肩等肢体语言让学生获得探究学习的动力,表现出一位优秀教师的良好素质。尤其难能可贵的是,菁才中学实验室没有简易量热计,吴老师竟然自费购买了10套带到教室,微笑着分发给学生,让学生开展分组实验,学生对吴老师的这种敬业、爱生精神肃然起敬,大大激发了实验探究的热情。
(二)重构教学过程活化了教材内容
叶圣陶先生说过:“教材无非是例子”“教材只能作为教课的依据,要教得好,使学生受益,还要靠教师善于运用。”本课教材的内容很少,只有一个“活动与探究”:测定中和反应的反应热。没有提出“中和热”的概念,没有误差分析,更没有探究影响中和热的因素。吴老师并没有用教材教教材,而是独具匠心的处理教材,基于菁才中学学生掌握知识的逻辑起点和思维习惯,依据维果斯基的“最近发展区”理论和“素养为本”的教学理念,对教材中的实验进行必要的调整和补充,创造性地设计了一条拾级而上的学习通道:定性观察热成像→定量测定反应热→分析误差成因→改进实验→探究影响中和热因素→建构认知模型。让学生经历了“山穷水尽疑无路,柳暗花明又一村”的思维磨练,活化了教材,活化了学生知识的生长点,扫除了理解实验思路和设计实验方案思维上的障碍,成功地实现从低级思维向高阶思维进阶,使学生对“中和热”概念加深理解,各个维度的化学学科核心素养也相应发展。
(三)创新实验活动活化了创新思维
培养科学态度和创新精神是本堂课的重要教学目标。研究表明,任何一个有智力的人都有创造力,但并非任何一个有智力的人都能发挥出创造力[3] 。创造力犹如人的智力中的宝藏,需要我们去开发和采掘,学生创造力的提高需要我们通过课堂教学去训练和培养。本课教学过程经历3次实验创新活动,学生参与积极,灵动地迸发出创新思维的火花:(1)从中和反应热成像视频中提出问题,设计测定中和反应前后温度变化的实验方案,并通过亲自实验,获得数据,得出结论,初步生成“中和热”概念,形成创新设计、数据处理、分析归纳的能力和团队协作的精神。(2)从化学史中自主发现实验测定误差,开展了误差分析与实验改进的活动。通过改进后的实验得到更加准确的结果,修正了“中和热”概念,发展了科学精神和创新精神等素养。(3)从讨论影响中和反应反应热的因素入手,自主提出假設,自主设计实验方案,并通过实验证实假设,深度理解并完善了“中和热”的概念,形成宏观辨识与微观探析、变化观念与平衡思想、证据推理与模型认知等素养。三次实验创新的成功体验激励着学生不断发现问题、提出问题,在课后继续研究其他反应的反应热测量问题,形成可持续发展的学习动力。
三、两点商榷
1.在环节一,教师将实验步骤简单演示后,将实验步骤展示在白板上,让学生按部就班去做。此处,如果教师先做个简单提示,然后让学生自主去实施实验,自主发现问题、分析误差、找到解决问题的办法,学生在实验体验上会更主动、更真实。
2.法国科学家贝特罗1881年利用自己发明的弹式量热计测出了中和热。“发明千千万,起点是一问”,此时此刻,如果引导学生对此提出质疑与挑战:他测得的数据一定是最准确的吗?鼓励学生努力学习现代科学技术,创造出更精确的量热计,去测得更准确的中和热,这对培养学生的批判精神、科学态度与创新意识是有大有裨益的。
每一堂课都是师生人生中美好的记忆,都是不可重复的生命体验。吴老师这堂课具有有较强的示范性,让人回味无穷,难以忘怀,为我们工作室成员转变教学观念、实施新课程、研究新教法提供了生动、具体、可借鉴的宝贵资源。
参考文献:
[1]中华人民共和国教育部. 普通高中化学课程标准(2017年版)[M].北京:人民教育出版社,2018:6.
[2]庄岩.英语教学中教师表情的运用[J].教育科研论坛,2010(4):35.
[3]韩兴旺,沈兆良.在化学课堂教学中培养学生创新精神的探索[J].化学教学,2000(10):15-18.
