不同养殖密度下鱼粉水平对青鱼幼鱼生长及免疫的影响
2020-03-04刘艳莉田芊芊周建成
胡 毅 刘艳莉 田芊芊 石 勇 钟 蕾 周建成
(1. 湖南农业大学湖南省特色水产资源利用工程技术研究中心, 长沙 410128; 2. 水产高效健康生产湖南省协同创新中心, 常德415000; 3. 常德大北农饲料有限公司, 津市 415401)
青鱼(Mylopharyngodon plceus)是“四大家鱼”之一, 主要养殖区域为江苏、安徽、湖北和湖南等地,是我国重要的经济鱼类。随着水库限养、禁养政策的推进, 以及养殖技术的不断提高, 高密度集约化和工厂化养殖将成为养殖常态, 如何利用有限的水体获得最大的养殖效应已成为研究焦点。但养殖密度过高会产生大量的胁迫因子, 如营养、拥挤、环境恶化(包括氨氮、pH、亚硝酸盐等)等, 而拥挤胁迫则是网箱和工厂化养殖过程中的关键胁迫因子, 过高的养殖密度会导致鱼类生长、饲料利用率、免疫力以及成活率下降[1—3]。同时, 为了降低水产动物饲料中鱼粉用量, 降低饲料配方成本, 促使用廉价的植物蛋白源替代鱼粉已成为饲料配方师和研究人员关注的重点[4,5], 但如果盲目地降低饲料中鱼粉占比,易导致水产动物免疫力和抗应激下降[6—8]。目前, 对于急性胁迫[9—11]或慢性胁迫[12]所带来的负面影响主要是通过功能性添加剂来缓解, 且慢性拥挤胁迫的相关报道集中于高密度环境对水产动物造成的损伤研究。关于蛋白质营养与高密度养殖的研究在国内外虽有涉及, 但仅见蛋白质水平和密度之间的关系,如斑点叉尾鮰(Ietalurus punetaus)[13]和凡纳滨对虾(Litopenaeus vannamei)[14]等。但对饲料中鱼粉含量的提高是否有缓解高密度养殖所带来的生长、免疫力下降等相关研究尚未报道。
本实验室前期研究表明, 青鱼幼鱼(5.90±0.01) g配合饲料中鱼粉含量低于20%时, 其生长性能就会受到抑制[15]。但在实际生产中, 饲料厂为了降低成本, 养殖户为了追求养殖效益, 而盲目降低饲料鱼粉水平和提高养殖密度, 饲料和环境的双重胁迫易导致机体出现免疫应激反应。因此, 本试验在已有研究基础上和实际问题出发, 旨在探究鱼粉水平和养殖密度对青鱼幼鱼生长性能、抗氧化能力、免疫及抗应激能力等的影响, 以及高鱼粉水平是否能缓解高密度养殖带来的负面影响, 以期为青鱼的集约化高密度养殖提供理论依据。
1 材料与方法
1.1 实验材料
设置鱼粉含量分别为10%和20%的实验饲料。在饲料制备之前, 鱼粉和豆粕等饲料原料经先粉碎,过40目筛网, 再按配比从小到大逐级定量均匀混合;再将其进入V型搅拌机充分混合25min。随后将鱼油与已混好的干粉充分混匀, 再加入适量的水揉匀,将其加工制成1.5 mm直径的颗粒饲料, 晾干至饲料水分含量为10%左右, 置于-20℃冰箱中保存备用。基础饲料组成及营养水平见表1。
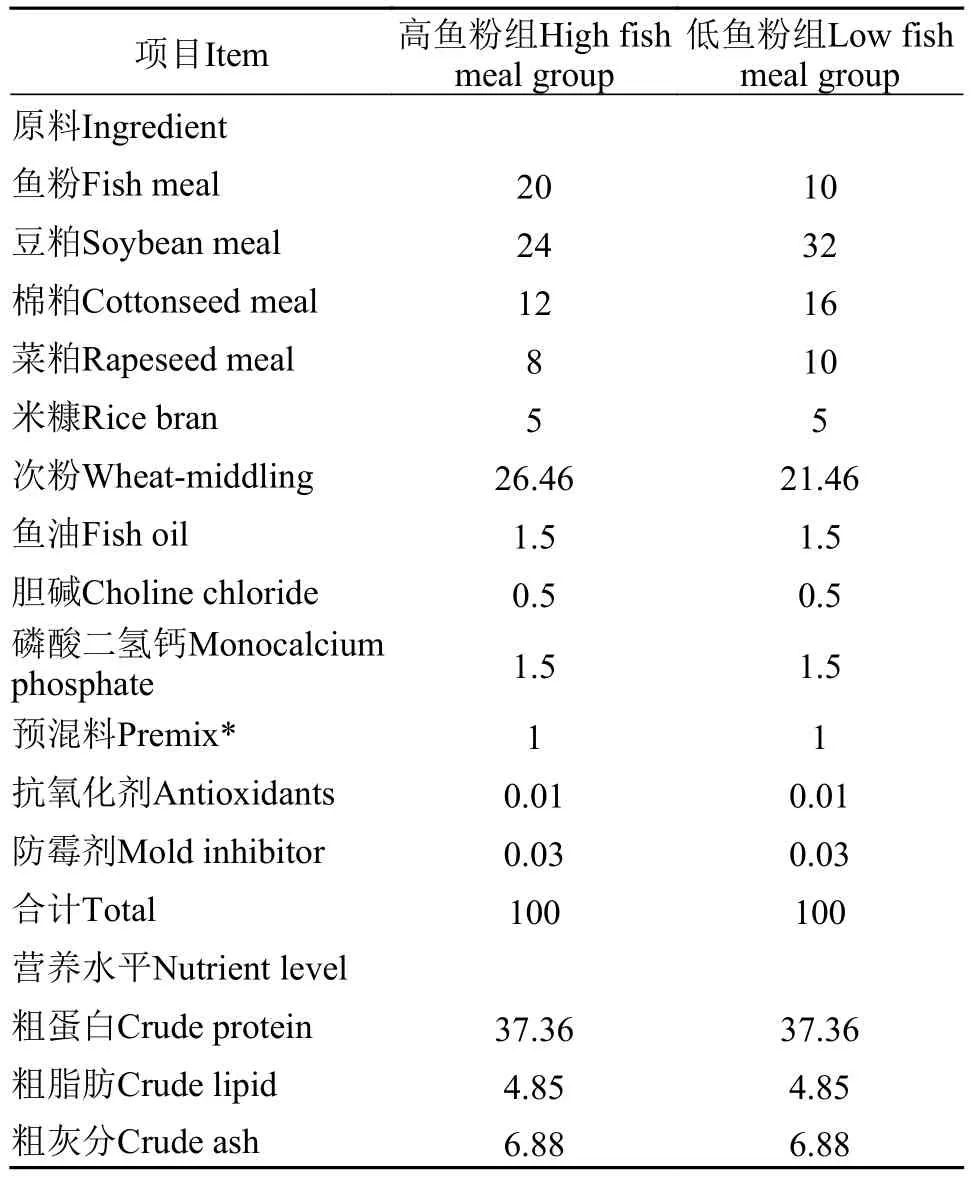
表1 基础饲料组成及营养水平(干物质基础, %)Tab. 1 Composition of the basal diet and nutrition level (DM basic, %)
1.2 实验方法
实验青鱼在湖南省水产科学研究所国家鱼类良种场购买, 为同批次人工孵化鱼苗。青鱼在网箱(5 m×5 m×5 m)中暂养28d, 暂养期间用高鱼粉组饲料日投喂3次, 正式养殖实验前停食24h。养殖实验在水库网箱(1.5 m×1.5 m×1.5 m)中进行, 采用双因素实验设计中的“2×3因子设计”, 以鱼粉水平和养殖密度为影响因素。其中, 鱼粉水平为20%和10%,养殖密度分为50、100和200尾/箱, 选取规格一致、体质健康的青鱼(2.50±0.02) g幼鱼随机分为6个组, 前期每组4个重复, 一个重复用于采样后补齐青鱼尾数, 养殖实验共持续16周。日投饵量为体质量的2%—5%, 日投喂3次(8:00, 12:00和17:00)。实验期间的水温为(26±4)℃。
1.3 采样与处理
实验第8周及第16周结束时, 禁食24h, 对各网箱中青鱼进行记数、称重, 计算生长指标。从各实验箱随机取5尾青鱼, 用1 mL注射器尾静脉取血, 将血液混合并置于无菌离心管中, 4℃静置过夜, 3000 r/min离心10min, 取上层血清置于-80℃冰箱保存备用。每网箱随机选取3尾青鱼测量体长和体重后,于冰盘迅速解剖并分离内脏团、肝脏和肠道, 然后称量肝重、内脏重, 进而计算形体指标; 并用冷冻的去离子水冲去剔除的肠道周围脂肪和内容物后取约2 cm前肠放入1.5 mL离心管中, 编号并标记,放入-80℃冰箱保存, 用于后续肠道消化酶活力测定。取5尾青鱼置于-20℃冰箱冰冻作全鱼样品, 用于体成分的测定。
1.4 检测指标和方法
生长、形体指标与体成分成活率(Survival,SR, %)=100%×实验结束时鱼尾数/实验初始时鱼尾数;
增重率(Weight gain rate,WGR, %)=100%×[终末平均体重(g)-初始平均体重(g)]/初始平均体重(g);
肥满度(Condition factor,CF, g/cm3)=终末鱼体重(g)/体长(cm)3;
肝体比(Hepatosomatic index,HSI, %)=100%×每尾肝脏体重(g)/每尾最终体重(g);
脏体比(Visceral index,VSI, %)=100%×每尾内脏体重(g)/每尾终末体重(g)。
鱼体常规成分测定参照文献的方法(AOAC)[16]。其中水分的测定采用105℃烘箱干燥恒重法(GB/T 6435—86)测定, 粗蛋白的测定采用凯氏定氮法(GB/T 6432—94), 粗脂肪的测定采取索氏抽提法(GB/T 6433—94), 粗灰分采用550℃灼烧法(GB/T 6438—92)测定。
生理生化指标胰岛素类生长因子-1(IGF-1)、生长激素(GH)、皮质醇(COR)、免疫球蛋白M(IgM)、分泌型免疫球蛋白A (S-IgA)用酶联免疫法进行测定; 总抗氧化能力(T-AOC)、超氧化物歧化酶(SOD)、丙二醛(MDA)、血糖(GLU)、溶菌酶(LSZ)等指标采用南京建成生物工程研究所试剂盒测定; 补体4 (C4)、免疫球蛋白M (IgM)采用浙江伊利康生物有限公司试剂盒测定, 所有指标均用酶标仪(Thermo-1510)进行检测。
肠道消化酶在测定前需将肠道样品解冻, 淀粉酶和脂肪酶用生理盐水进行匀浆, 胰蛋白酶用匀浆介质进行匀浆, 用离心机3500 r/min, 离心10min, 取上清液保存待测, 然后用南京建成生物工程研究所试剂盒进行测定, 仪器为分光光度计UV-5200型。
1.5 统计与分析
本实验结果利用软件SPSS19.0进行单因素和多因素分析, 差异显著(P<0.05)时, 则用Duncan’s法进行多重比较, 实验数据用“平均值±标准误(Mean±SE)”表示。
2 结果
2.1 养殖密度和鱼粉水平对青鱼生长及体成分的影响
由表2可知, 实验中期, 养殖密度和鱼粉水平对青鱼的成活率有交互效应(P<0.05), 鱼粉水平和养殖密度的同时增加使青鱼的存活率有下降的趋势(P>0.05); 养殖密度和鱼粉水平对青鱼的增重率无交互效应, 随密度的增加, 低鱼粉和高鱼粉组青鱼的增重率均有先上升后下降的趋势, 但差异不显著(P>0.05),在同一密度水平下, 高鱼粉组增重率有比低鱼粉组提升高的趋势, 其中H100组增重率显著高于L100组(P<0.05), H200组的青鱼增重率与L100组的增重率相当(P>0.05)。在实验后期, 养殖密度和鱼粉水平对青鱼增重率有交互效应(P<0.05)。在不同密度下, 低鱼粉饲料增重率差异不显著, 但降低了高密度组成活率(P>0.05), 高鱼粉显著影响了不同密度组的增重率, 随密度的升高, 青鱼的增重率呈下降趋势(P>0.05),H200组的增重率显著低于L200组和H50组(P<0.05), 且高鱼粉组的存活率均低于低鱼粉组(P>0.05)。
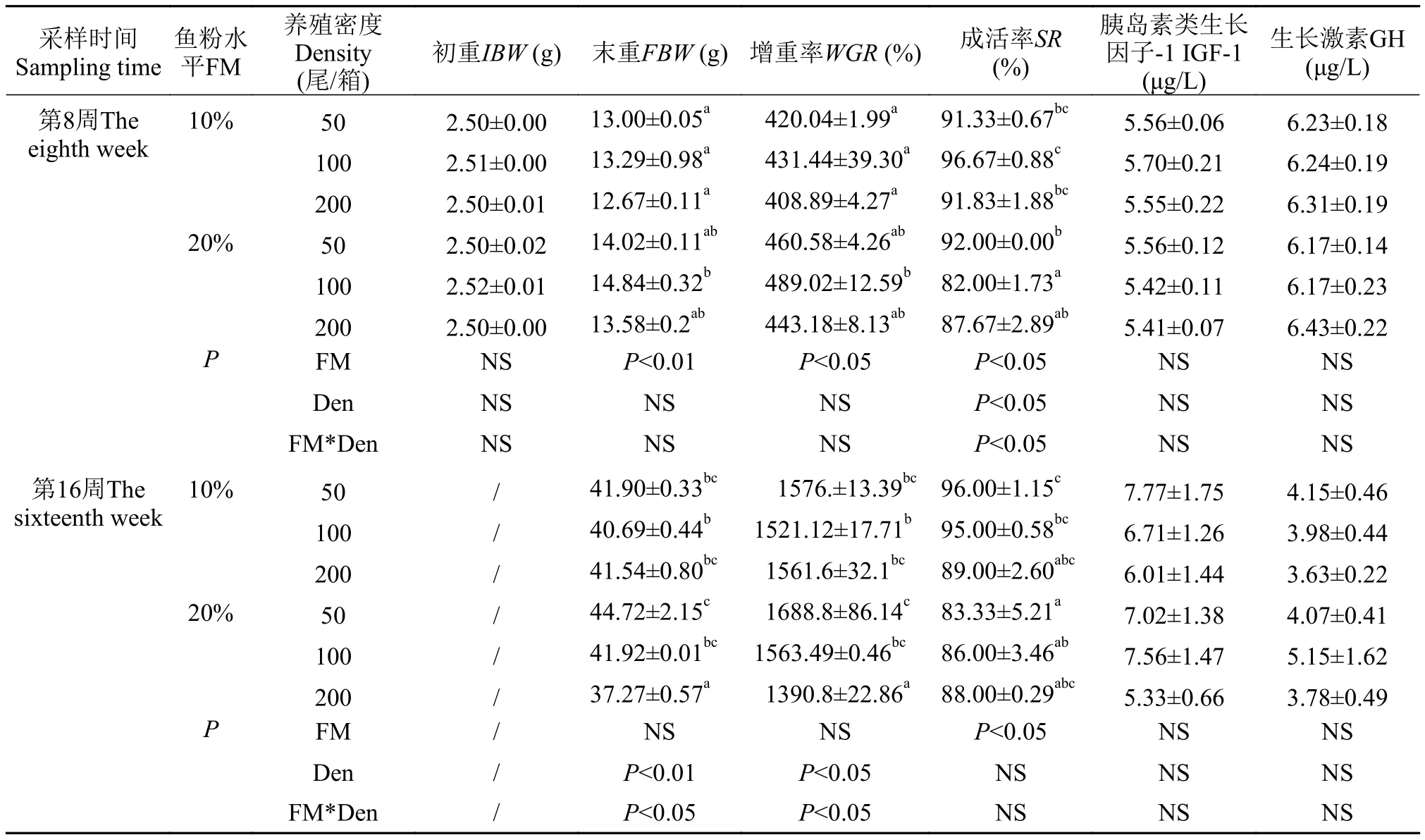
表2 不同养殖密度下鱼粉水平对青鱼幼鱼生长的影响Tab. 2 Effects of fishmeal level on growth in juvenile black carp at different stocking densities
由表3可见, 在整个实验期间, 鱼粉水平和养殖密度对青鱼形体指标和体成分无交互效应(P>0.05)。在实验中期, 随密度的增加, 低鱼粉组的VSI呈降低趋势; 高鱼粉组青鱼粗脂肪呈先上升后下降的趋势(P>0.05)。在同密度下, H200组的VSI、HSI、粗脂肪和粗蛋白含量均低于L200组(P>0.05)。在实验后期, 随密度的增加, 青鱼的粗脂肪和粗蛋白均呈先下降后上升的趋势(P>0.05)。在同密度下, H200组的CF、粗脂肪含量高于L200组,VSI和粗蛋白含量低于L200组(P>0.05)。
2.2 养殖密度和鱼粉水平对青鱼肠道消化酶活力的影响
由表4可见, 在实验中期, 养殖密度和鱼粉水平对青鱼的胰蛋白酶、淀粉酶均有交互效应(P<0.05); 随密度的升高, 低鱼粉组青鱼的脂肪酶、胰蛋白酶和淀粉酶均呈先下降后上升的趋势(P>0.05); 在同一密度下, H200组的胰蛋白酶活力显著低于L200组(P<0.05), 而脂肪酶和淀粉酶活力高于L200组(P>0.05)。在实验后期, 养殖密度和鱼粉水平对消化酶活力无交互效应, 各组之间的消化酶活力也没有产生显著差异(P>0.05)。
2.3 养殖密度和鱼粉水平对青鱼抗氧化及免疫应激指标的影响
由表5可见, 在实验中期和实验后期, 养殖密度和饲料中鱼粉水平不同未能引起青鱼T-AOC、SOD和MDA的含量产生显著性差异, 对青鱼抗氧化指标无交互效应(P>0.05)。
由表6可见, 在整个实验期间, 养殖密度和鱼粉水平对青鱼免疫应激指标无交互效应(P>0.05)。在实验中期, 随密度的升高, 高鱼粉和低鱼粉组青鱼的IgM呈下降趋势, GLU呈上升的趋势(P>0.05); 在同密度下, H200组青鱼的LSZ、C4、IgM、S-IgA和皮质醇含量均高于L200组, GLU低于L200组(P>0.05)。在实验后期, 随密度的增加, 高鱼粉和低鱼粉组青鱼的IgM和COR含量均呈下降趋势(P>0.05)。在同密度下, H200组青鱼的IgM和COR含量均高于L200组, GLU低于L200组(P>0.05)。
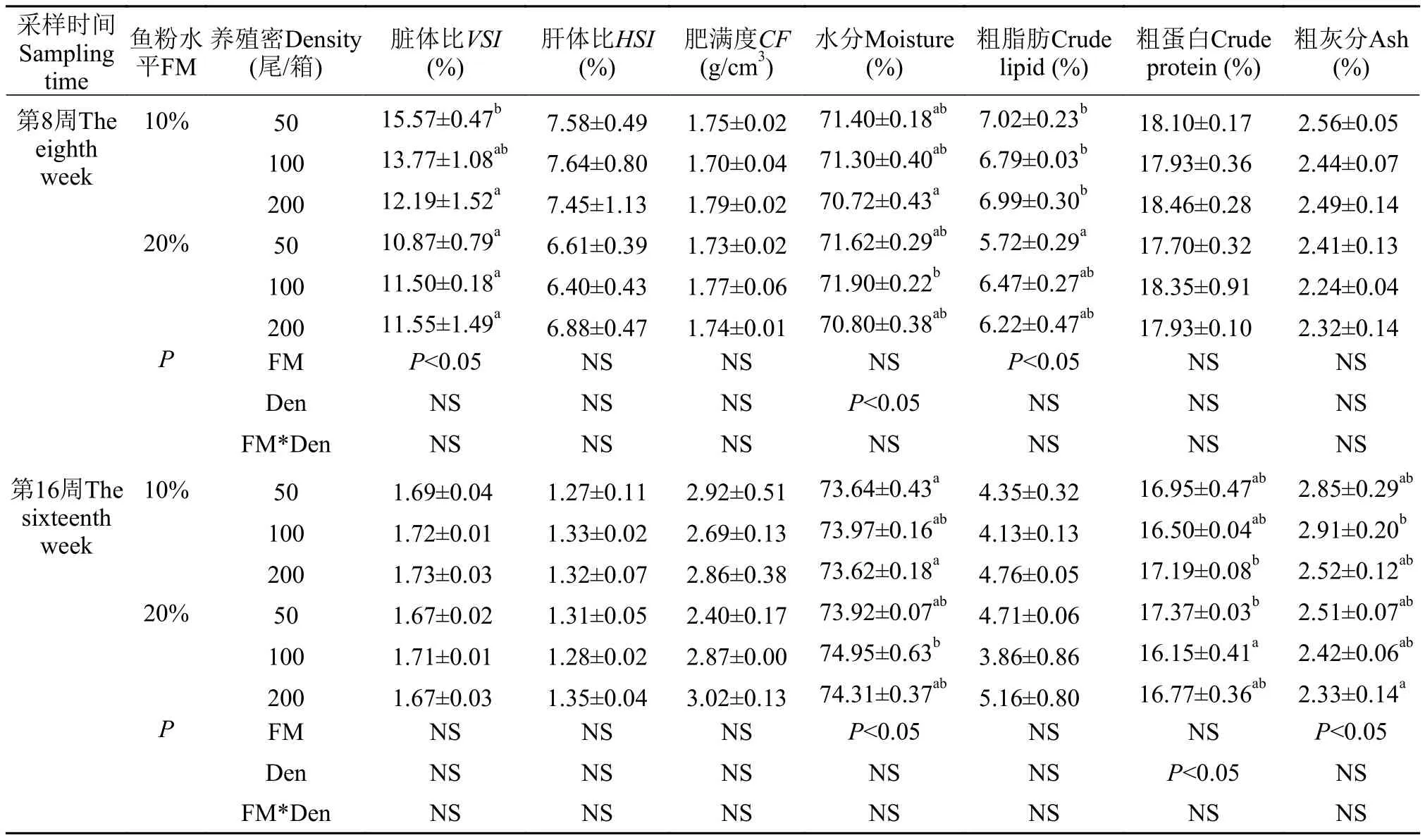
表3 不同养殖密度下鱼粉水平对青鱼幼鱼形体指标和体成分的影响Tab. 3 Effects of fishmeal level on the body composition in juvenile black carp at different stocking densities
3 讨论
3.1 养殖密度和鱼粉水平对青鱼幼鱼生长和肠道消化酶活力的影响
高密度作为慢性胁迫因子, 会导致鱼体损伤甚至死亡。有研究表明, 随养殖密度升高, 尾斑石脂鲤(Brycon insignis)[17]、牙鲆(Paralichthys olivaceus)[18]和虹鳟鱼(Oncorhynchus mykiss)[19]生长受到抑制。其原因可能是: 其一, 过高的养殖密度会加剧群内的竞争, 直接致使平均个体摄食量降低[20]; 其二, 密度过高会对鱼类造成一定程度的应激效应, 机体需要消耗更多的能量来应对胁迫, 以维持正常的代谢过程[21—23]。但本实验结果表明, 在低鱼粉水平下,高密度组青鱼的增重率有降低的趋势但不显著, 这与在军曹鱼(Rachycentron canadum)[24]和塞加内尔鳎(Solea senegalensis)[25]的研究结果类似, 其可能原因是鱼类的生长不仅受养殖密度的影响, 也与养殖品种、规格、饲料品质、鱼类集群行为等因素有关。在乌鳢(Ophicephalus argus)上的研究结果就表明, 用冰鲜鱼或配合饲料两种不同的饲料投喂, 乌鳢的最适养殖密度是不同的[26]。在养殖后期, 低鱼粉水平和高密度对青鱼的增重率未产生显著影响,但是在低鱼粉情况下高密度组的存活率相对于低密度组有明显的下降趋势, 这说明鱼粉水平较低和密度过高可能会加剧群内竞争导致青鱼存活率降低[20], 在低鱼粉水平下青鱼养殖密度少于100尾/箱为宜。同时, 在本实验条件下, 随饲料中鱼粉水平的提高, 在前期能提高青鱼幼鱼增重率, 但在实验后期, 鱼粉增加反而抑制了高密度组青鱼的增重率,且高密度组和中密度组增重率低于低密度组, 结果与凡纳滨对虾上的研究结果类似, 当饲粮中的蛋白水平过高时, 凡纳滨对虾的增重率和存活率反而降低[27]。本研究结果说明在前期养殖阶段提高鱼粉水平能够缓解高密度带来的慢性胁迫, 其原因可能是养殖中期青鱼对饲料蛋白质品质和鱼粉水平要求高, 但随着鱼体规格的增大, 青鱼对于鱼粉的需求量下降, 过高的鱼粉水平可能造成青鱼营养过剩,从而导致青鱼成活率、增重率降低, 刘昊昆[28]实验也证实不同生长阶段异育银鲫(Carassiusauratus gibelio)对鱼粉蛋白需求量不同。由此本实验得出在高鱼粉水平下, 养殖密度为50尾/箱更为合适。另外, 高鱼粉组的存活率与低鱼粉组相比有一定程度的降低, 这可能是因为高鱼粉水平饲料提高了鱼的增重率, 由于网箱容量的问题, 从而导致青鱼成活率降低, 具体原因则需要进一步的研究。
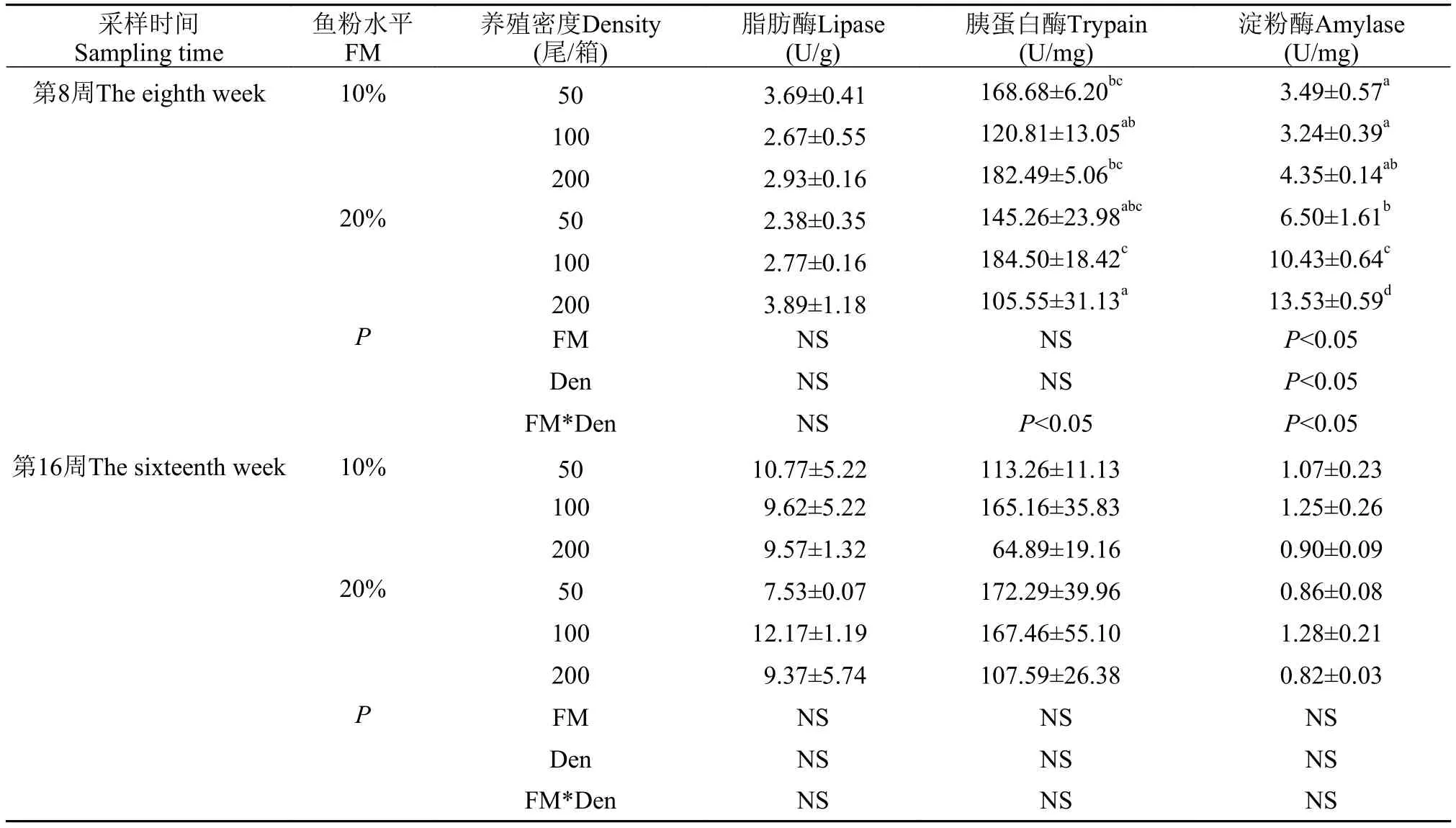
表4 不同养殖密度下鱼粉水平对青鱼幼鱼消化酶的影响Tab. 4 Effect of fishmeal levels on digestive enzymes in juvenile black carp at different stocking densities

表5 不同养殖密度下鱼粉水平对青鱼幼鱼抗氧化指标的影响Tab. 5 Effects of fish meal level on anti-oxidation indexes of juvenile black carp at different stocking densities
脏体比能反应机体的发育及健康状态, 脏体比的减少, 会使机体摄食与对饲料的利用降低[29]。在本实验中期, 低鱼粉组青鱼的脏体比随密度的增加而下降, 可能是因为机体需要消耗更多的脂肪来供应能量。而当鱼粉含量提高到20%时, 密度的增加使青鱼脏体比提高, 其原因是饲料中鱼粉含量充足时, 青鱼优先利用蛋白质, 更多的将脂肪储存在体内。当环境较好时, 虾类体内也主要贮存脂类[30]。与高鱼粉组相比, 低鱼粉饲料组青鱼粗脂肪含量升高, 与脏体比和肝体比的变化趋势一致, 说明低鱼粉组青鱼内脏中脂肪沉积, 但结果与建鲤(Cyprinus carpiovarJian)的研究结果不一致[31]。这可能是因为在一定的摄食条件下, 青鱼利用物质的能力和顺序不一致所致, 也有研究表明, 盐度、温度、饥饿及养殖密度等都会对鱼体的生化组分产生影响[32]。
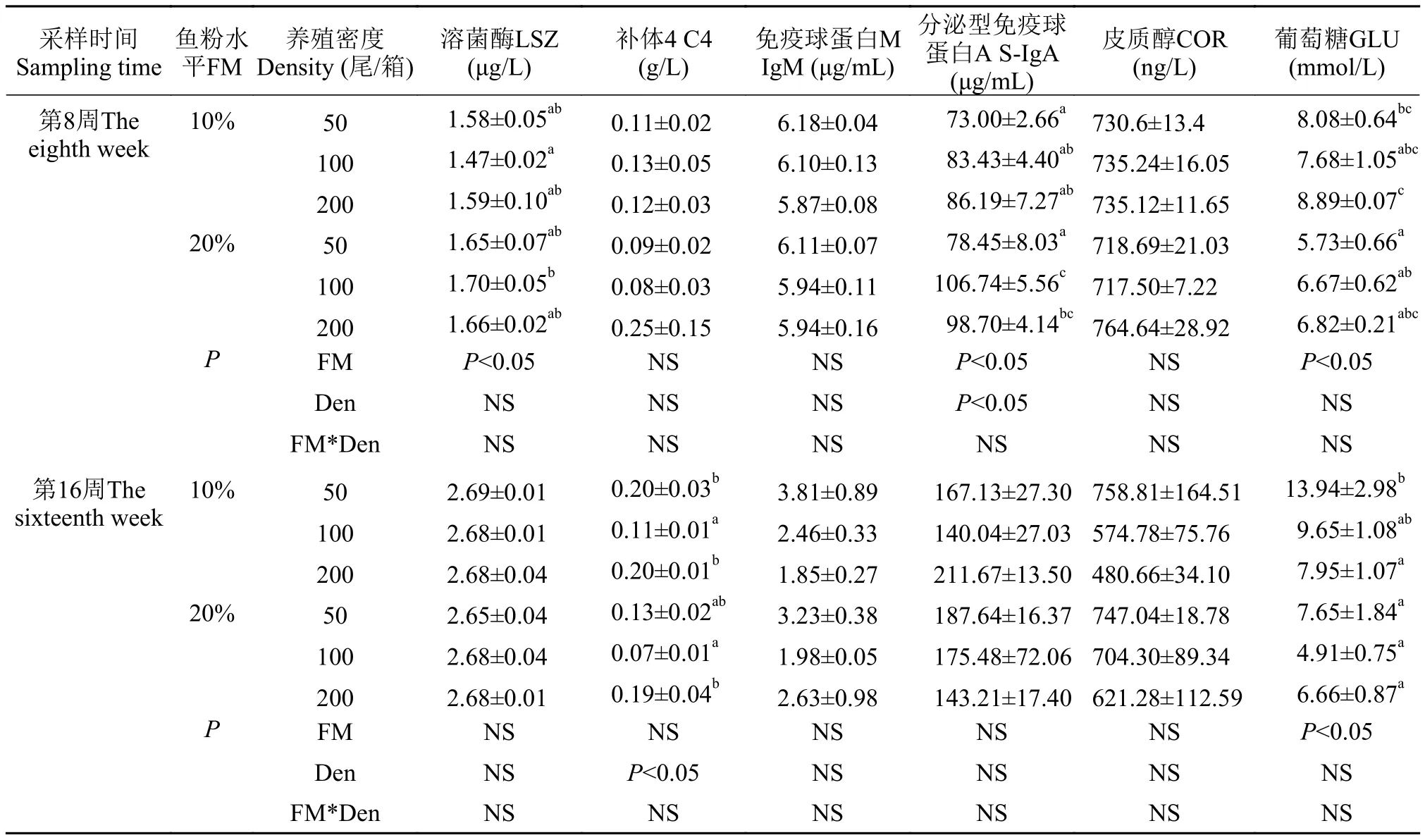
表6 不同养殖密度下鱼粉水平对青鱼幼鱼免疫应激指标的影响Tab. 6 Effects of fishmeal level on immunity indexes in juvenile black carp at different stocking densities
消化酶是鱼类消化过程中重要功能性物质, 对食物变化的适应能力和对营养物质的摄取有显著影响[33]。在本实验中期, 随鱼粉水平的升高, 青鱼淀粉酶显著提高, 与黄颡鱼(Pseudobagrus fulvidraco)上的研究结果基本一致[34], 原因可能与豆粕中抗营养因子损害了肠道结构[35], 从而抑制了淀粉酶活性有关。实验中期高鱼粉中密度组胰蛋白酶活性显著高于低鱼粉组, 与牛蛙(Rana catesbeiana)[36]上的结果相似, 但高密度组胰蛋白酶活性反而降低, 原因可能是高密度拥挤胁迫影响青鱼消化生理, 从而影响青鱼肠道胰蛋白酶活性, 具体原因有待进一步研究。在高鱼粉情况下, 密度的升高使青鱼的脂肪酶有上升的趋势, 原因与青鱼提高脂肪的消化吸收以给机体提供更多的能量有关, 这与机体的粗脂肪含量降低的结果是一致的。但在实验后期肠道消化酶活性并不会因为密度水平或鱼粉水平的不同而产生差异, 在黄颡鱼上的研究也得出鱼粉水平降低不超过20%时, 不会对其消化酶活力产生不良影响[34]。由此可见, 肠道消化酶并不是影响高密度组青鱼后期生长性能下降的关键因素。
3.2 养殖密度和鱼粉水平对青鱼免疫、应激的影响
免疫球蛋白M是鱼类主要的一种抗体, 能与相应的抗原结合, 抑制细菌增殖等。在本实验中, 随密度的升高, 高鱼粉和低鱼粉组青鱼的免疫球蛋白M均呈下降趋势, 与虹鳟[37]研究结果类似。Lin等[38]也证实养殖密度增加对鱼类非特异性免疫有负面影响。溶菌酶是生物体内重要的非特异性免疫因子之一, 在抵抗外来病原入侵中起重要作用[39], 而慢性胁迫会造成溶菌酶活性降低[40]。在高密度水平下, 低鱼粉组的溶菌酶活性低于高鱼粉组, 可能是因为豆粕含有抗营养因子[35], 会降低鱼类溶菌酶的活性, 对青鱼的免疫功能造成损伤, 这与异育银鲫[41]的研究结果相类似。但在实验后期, 密度水平与鱼粉水平均未能对青鱼免疫指标产生显著影响,具体原因是否与青鱼规格有关, 有待进一步研究发现。并且血清中抗氧化指标也能说明机体的免疫能力。其中总抗氧化能力的变化可以反映机体内自由基的代谢情况, 对判断机体的健康状况及抗氧化防御能力具有重要意义[42]。在本实验中, 青鱼血清中抗氧化指标并未因密度水平与饲料中鱼粉水平的不同而产生显著变化。
通常, 高密度应激下鱼类血清皮质醇水平会呈上升趋势, 而皮质醇短期的升高能够促进体蛋白分解, 加速脂肪的氧化, 糖类的合成增多, 从而促使机体获得足够的能量用以抵御胁迫所需。在本实验中养殖密度的升高对青鱼的皮质醇含量没有显著影响, 与鲫(Carassius auratus)在拥挤胁迫中血清皮质醇的变化不一致[40]。可能是因为皮质醇代谢途径改变, 具体原因有待进一步研究。在鱼类面对胁迫时, 血液中葡萄糖的变化可以作为代谢的重要响应指标之一。在本实验中期, 高密度组青鱼血糖含量高于低密度组, 与杂交鳢(Channa maculata×C.argus)研究结果一致[43]。这说明一方面, 胁迫使机体基础代谢水平升高, 需要消耗更多的糖用以供能;另一方面, 皮质类固醇可以提高体组织对葡萄糖的利用率, 同时促进肝脏糖异生[44]。在实验后期时,高密度组的青鱼血糖含量低于低密度组, 可能是因为长时间经受拥挤胁迫致使机体对糖的利用过度而造成血糖含量下降, 与牙鲆(Paralichthys olivaceus)的研究结果一致[18]。同时, 10%鱼粉水平下高密度组的血糖水平较低密度组提高10%, 而20%鱼粉水平下高密度组较低密度组提高19%, 高鱼粉饲料组血糖提高幅度高于低鱼粉组, 由此也说明, 高鱼粉水平和高养殖密度可能引起青鱼产生应激反应, 从而导致血糖水平发生变化。
4 结论
在本实验条件下, 高密度实验对养殖中期青鱼幼鱼生长性能和机体免疫、抗应激能力有负面影响, 提高饲料鱼粉水平对生长、免疫和抗应激能力有一定改善作用。在实验后期高密度降低了低鱼粉饲料组的成活率, 显著降低了高鱼粉组的增重率,将饲料中鱼粉水平从10%提高至20%对高密度养殖下青鱼生长性能和免疫功能无改善作用。
