丙泊酚联合BMSC移植修复对脊髓损伤大鼠运动功能及ERK1/2通路的影响
2020-03-04罗丽坤吴建江张丽
罗丽坤 吴建江 张丽
脊髓损伤(SCI)是一种中枢神经系统损伤,临床表现主要为四肢瘫、截瘫等症状,具有预后差、致残率高、致死率高等特点[1]。目前临床治疗SCI主要有手术、药物、康复理疗等方法,改善受损脊髓的缺血缺氧状态,抑制神经元坏死,修复受损神经元功能,但因脊髓神经细胞不能自我修复,因此临床疗效不佳[2]。随着组织工程技术的发展,研究者发现骨髓间充质干细胞(BMSCs)移植对SCI有较好的疗效,BMSCs作为一类特殊的干细胞,具有自我更新的能力,且在一定条件下可诱导分化为星形胶质细胞、神经元、少突胶质细胞等多种神经细胞,可恢复SCI受损神经功能,是治疗脊髓损伤的一种新方法[3,4]。丙泊酚作为临床常用的麻醉药物,具有抗氧化活性,能清除脊髓组织自由基,抑制氧化应激反应,改善神经功能,对治疗SCI具有一定的作用[5,6],另外联合BMSCs移植可进一步改善大鼠SCI症状,增强BMSCs的疗效[7],但其作用机制目前并不清楚。ERK1/2通路在SCI中起到重要的调节作用,通过抑制其活性,可促进损伤脊髓电生理功能的恢复,修复脊髓受损功能[8]。研究发现,ERK1/2通路参与介导BMSCs的分化[9],且丙泊酚可通过抑制p-ERK1/2降低大鼠脑缺血再灌注损伤[10],因此,可推测ERK1/2通路可能是丙泊酚联合BMSCs治疗SCI的作用靶点,本文通过建立SCI大鼠模型,对丙泊酚联合BMSC移植修复对SCI大鼠运动功能及ERK1/2通路的影响进行研究。
1 材料与方法
1.1 材料
1.1.1 实验动物:清洁级SD大鼠(动物合格证编号:11401300035796,北京华阜康生物科技股份有限公司),雄性,在清洁安静的环境下饲养,自由饮水、饮食,定期清理消毒鼠笼、更换垫料,温度保持在25℃左右,湿度保持在60%左右,保持通风良好,自然光照。
1.1.2 试剂与仪器:丙泊酚注射液(国药准字:J20040122,北京费森尤斯卡比医药有限公司);DMEM高糖培养基(货号:L0104-100,上海微科生物技术有限公司);胎牛血清、PBS缓冲液、胰蛋白酶-EDTA消化液、青链霉素混合液(货号分别为:11011-8611、P1022、T1300、P1400,Solarbio公司);SOD检测试剂盒(货号:IC-SOD-Ra,上海钰博生物科技有限公司);MDA检测试剂盒(货号:xy-30182,上海信裕生物科技有限公司);亲和素-生物素-过氧化物酶复合物染色法(Avidin-biotin-peroxidase complex,ABC)免疫组化试剂盒(批号:PK-6100,美国Vector Laboratories公司);GAPDH兔源一抗、ERK1/2兔源一抗、p-ERK1/2兔源一抗、羊抗兔二抗(货号分别为:ab181602、ab17942、ab223500、ab150077,英国Abcam公司);RIPA裂解液、BCA试剂盒(货号分别为:P0013K、P0011,碧云天生物技术研究所)等。KEYPOINT4诱发电位仪(南昌高腾科技有限公司);1659001蛋白电泳仪、Trans-Blot SD半干转膜仪、Model 680酶标仪(美国Bio-Rad公司);CKX53倒置相差显微镜(日本Olympus公司);1X70 倒置显微镜(日本Olympus公司);2500凝胶成像系统(上海天能公司);RM2235石蜡切片机(德国Leica公司);Centrifuge 5424R低温高速离心机(德国 Eppendorf 股份公司)等。
1.2 方法
1.2.1 大鼠模型制备及分组给药:参照文献中的方法[11],以3 ml/kg的剂量腹腔注射2%戊巴比妥钠麻醉SD大鼠,以俯卧位固定于操作台,定位T8~9棘突,备皮后消毒铺巾,以其中心做切口,逐层切开,暴露T7-10 棘突和椎板,以微型咬骨钳咬除部分椎板和T8~9棘突,暴露硬膜但使其保持完整,将10 g重物自2.5 cm高度自由落下,撞击大鼠硬膜及脊髓组织,消毒伤口后逐层缝合,之后每天2次轻压SD大鼠膀胱部位使其排空尿液,直至大鼠排尿反射恢复为止,观察大鼠当其出现双下肢瘫痪、尾巴痉挛摆动时,表明模型建立成功。共建立48只,随机分为模型组、丙泊酚组、BMSC移植组、丙泊酚+ BMSC移植组;另取12只大鼠作为假手术组,不做撞击,其他操作相同。参照文献中的方法[12],将4周龄SD大鼠麻醉后处死,取双侧股骨和胫骨,剪断两端骨垢端,培养基冲洗骨髓腔收集骨髓,采用密度梯度离心法、贴壁细胞培养法培养大鼠 BMSCs并鉴定;第四代BMSCs胰酶消化后,以0.9%氯化钠溶液重悬,混匀计数,调整密度为1×106个/ml,BMSC移植组大鼠每只尾静脉注射1 ml细胞悬液[13];丙泊酚组大鼠通过尾静脉留置针注射丙泊酚注射液[14]2 ml·kg-1·h-1,每天持续4 h;丙泊酚+ BMSC移植组大鼠每只尾静脉注射1 ml细胞悬液,同时通过尾静脉留置针注射丙泊酚注射液2 ml·kg-1·h-1,每天持续4 h;假手术组和模型组注射等体积0.9%氯化钠溶液,5组持续7 d。
1.2.2 大鼠运动功能检测:次给药24 h后,采用Basso-Beattie-Bresnahan(BBB)评分标准[15]及斜板实验评价5组大鼠后肢运动能力。BBB评分标准:观察大鼠关节活动次数,运动负荷、范围,肢体及尾巴的协调程度进行判定,从0~21分共分22级,0分为完全瘫痪,21分为正常,每只大鼠均评定3次,取其平均值。斜板实验:将大鼠垂直于板的垂直轴放置在光滑的木板上,逐渐增加斜板的角度,大鼠可停留5 s时斜板的最大角度,则为斜板实验功能值。
1.2.3 大鼠体感及运动诱发电位检测:末次给药24 h后,参照1.2.1中的方法麻醉大鼠,采用诱发电位仪检测体感及运动诱发电位。
1.2.3.1 体感诱发电位检测:将大鼠平放在水平面上,刺激电极固定在后腿,记录电极固定于头皮后肢皮质感觉区下(位于矢状缝和冠状缝愈合线的相交处),参考电极置于记录电极后0.5 cm处,直流方波电脉冲刺激大鼠,以其出现后肢轻微抽动为准,电流强度为5~15 mA、频率为3 Hz、波宽为0.2 ms,叠加次数为50~60次,记录体感诱发电位潜伏期及波幅。
1.2.3.2 运动诱发电位检测:在矢状缝旁2 mm、顶冠状缝前2 mm处的皮下大脑皮质运动区放置针状刺激电极,刺激强度为40 mA、频率为1 Hz、波宽为0.1 ms,扫描速度为5 ms/D,叠加次数为300~500次,灵敏度为5 μV/D,记录运动诱发电位潜伏期、波幅。
1.2.4 标本收集及大鼠脊髓组织SOD、MDA检测:运动及电生理功能检测完毕后,处死大鼠,解剖取出脊髓组织,剪取约1 g,以匀浆机制备为匀浆液,3 000 r/min,4℃离心20 min,取500 μl上清液以检测试剂盒分别测定SOD、MDA水平,具体参照说明书操作。剩余上清液置于-80℃储存备用,剩余的组织以生理盐水漂洗,经4%多聚甲醛固定、梯度酒精(低浓度到高浓度)脱水、二甲苯透明、石蜡包埋后,采用切片机做病理切片备用。
1.2.5 大鼠脊髓组织ERK1/2、p-ERK1/2蛋白表达情况检测:1.2.4中的病理切片,经脱蜡、梯度乙醇(自高浓度到低浓度)处理后,浸泡在蒸馏水中,ABC免疫组化试剂盒对ERK1/2、p-ERK1/2蛋白进行免疫组织化学染色,操作步骤参照说明书。
1.2.6 上清液(蛋白样品)在4℃下解冻,参照说明书,以BCA试剂盒测定总蛋白浓度,取相同质量总蛋白样品液进行SDS-PAGE凝胶电泳,转移蛋白至PVDF膜上,根据目的蛋白分子量截取条带,放置于小盒中,加入5%脱脂牛奶,室温封闭2 h,再经入相应一抗、羊抗兔二抗孵育后,以ECL显色,将条带置于凝胶成像仪中观察并拍照,以Tanon软件分析蛋白相对表达量。
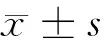
2 结果
2.1 5组大鼠运动功能评定结果 与假手术组相比,模型组大鼠BBB评分及斜板实验功能值均降低(P<0.05);与模型组相比,丙泊酚组、BMSC移植组、丙泊酚+ BMSC移植组大鼠BBB评分及斜板实验功能值均增高(P<0.05);分别与丙泊酚组、BMSC移植组相比,丙泊酚+ BMSC移植组大鼠BBB评分及斜板实验功能值均增高(P<0.05)。见表1。
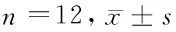
表1 5组大鼠运动功能评定结果
2.2 5组大鼠体感诱发电位、运动诱发电位的检测结果 与假手术组相比,模型组大鼠体感诱发电位及运动诱发电位潜伏期均增长(P<0.05),波幅均降低(P<0.05);与模型组相比,丙泊酚组、BMSC移植组、丙泊酚+ BMSC移植组大鼠体感诱发电位及运动诱发电位潜伏期均缩短(P<0.05),波幅均增高(P<0.05);分别与丙泊酚组、BMSC移植组相比,丙泊酚+ BMSC移植组大鼠体感诱发电位及运动诱发电位潜伏期均缩短(P<0.05),波幅均增高(P<0.05)。见表2。
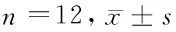
表2 5组大鼠体感诱发电位、运动诱发电位的检测结果
2.3 5组大鼠脊髓组织中SOD、MDA水平 与假手术组相比,模型组大鼠脊髓组织中SOD水平显著降低(P<0.05),MDA显著增加(P<0.05);与模型组相比,丙泊酚组、BMSC移植组、丙泊酚+ BMSC移植组大鼠脊髓组织中SOD水平均升高(P<0.05),MDA均降低(P<0.05);与丙泊酚组、BMSC移植组相比,丙泊酚+ BMSC移植组大鼠脊髓组织中SOD水平均升高(P<0.05),MDA均降低(P<0.05)。见表3。
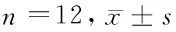
表3 5组大鼠脊髓组织中SOD、MDA水平的测定结果
2.4 5组大鼠脊髓组织中ERK1/2、p-ERK1/2表达的免疫组化检测结果 与假手术组相比,模型组大鼠脊髓组织中p-ERK1/2阳性细胞比例显著增加(P<0.05),ERK1/2阳性细胞比例无明显变化(P>0.05);与模型组相比,丙泊酚组、BMSC移植组、丙泊酚+ BMSC移植组大鼠脊髓组织中p-ERK1/2阳性细胞比例均降低(P<0.05),ERK1/2阳性细胞比例无明显变化(P>0.05);分别与丙泊酚组、BMSC移植组相比,丙泊酚+ BMSC移植组大鼠脊髓组织中p-ERK1/2阳性细胞比例均降低(P<0.05)。见图1,表4。
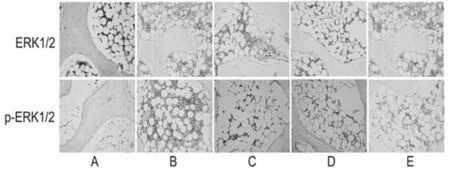
图1 各组大鼠脊髓组织中ERK1/2、p-ERK1/2的表达(免疫组化×400);A 假手术组;B 模型组;C 丙泊酚组;D BMSC移植组;E 丙泊酚+ BMSC移植组
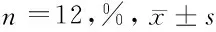
表4 5组大鼠脊髓组织中p-ERK1/2、ERK1/2表达的测定结果
2.5 5组大鼠脊髓组织中ERK1/2、p-ERK1/2表达的免疫印迹检测结果 与假手术组相比,模型组大鼠脊髓组织中p-ERK1/2的表达显著增加(P<0.05),ERK1/2表达无明显变化(P>0.05);与模型组相比,丙泊酚组、BMSC移植组、丙泊酚+ BMSC移植组大鼠脊髓组织中p-ERK1/2的表达均降低(P<0.05),ERK1/2表达无明显变化(P>0.05);与丙泊酚组、BMSC移植组分别相比,丙泊酚+ BMSC移植组大鼠脊髓组织中p-ERK1/2的表达均降低(P<0.05),ERK1/2表达无明显变化(P>0.05)。见表5,图2。
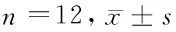
表5 5组大鼠脊髓组织中p-ERK1/2/ERK1/2表达的测定结果

图2 免疫印迹检测各组大鼠脊髓组织中ERK1/2、p-ERK1/2的表达;A 假手术组;B 模型组;C 丙泊酚组;D BMSC移植组;E 丙泊酚+ BMSC移植组
3 讨论
SCI是脊柱专科的危重症之一,发病机制极其复杂,其中以继发性损伤中的炎性反应、氧化应激损伤、神经元坏死等为主,本文采用改良Allen重物打击法制作SCI大鼠模型,该法以一定力量撞击脊髓后造成脊髓水肿、缺血,及继发的一系列损伤反应,较接近人类脊SCI的病理生理特点,在临床及基础研究中得到广泛应用[16]。本文模型组大鼠BBB评分、斜板实验功能值均降低,表明模型大鼠运动功能受损;体感及运动诱发电位检测可判断脊髓神经电生理功能,进而检测脊髓功能[17],模型组大鼠体感及运动诱发电位波幅均降低,电位潜伏期均升高,表明模型大鼠从头皮到后肢的电信号传导通路损伤,脊髓神经电生理功能减退;SOD是内源性超氧化物歧化酶,可清除体内自由基,MDA是细胞脂肪酸过氧化的产物[18],模型组大鼠脊髓组织中SOD水平降低, MDA水平表达增高,表明模型大鼠体内氧化应激反应增强,模型建立成功。 研究发现,BMSCs、丙泊酚均能改善脊髓受损症状,修复脊髓功能,对SCI具有一定的疗效,且联合应用效果更好[19],但其作用机制目前尚不清楚。ERK1/2通路参与介导SCI病理过程,抑制其磷酸化激活,可减轻脊髓炎性反应,恢复脊髓神经电生理功能,促进SCI大鼠运动功能的恢复[8,20],且丙泊酚可通过下调p-ERK1/2,保护脑缺血再灌注损伤大鼠脑组织;在BMSCs分化过程中,p-ERK1/2也可发生变化[9,10],因此,ERK1/2通路可能是丙泊酚联合BMSCs治疗SCI的药理机制。本文研究结果显示,5组ERK1/2蛋白表达基本无变化,其磷酸化水平5组之间变化明显,模型组大鼠脊髓组织中p-ERK1/2水平相比假手术组明显升高;而经丙泊酚、BMSC移植分别治疗后,脊髓组织中p-ERK1/2水平均降低;同时大鼠BBB评分、斜板实验功能值均增高,提示大鼠运动功能有一定恢复;体感及运动诱发电位潜伏期降低、波幅增高,提示大鼠从头皮到后肢的电信号传导通路一定程度上恢复畅通;损伤脊髓组织中MDA水平降低、SOD水平增高,提示大鼠氧化应激损伤减轻,提示p-ERK1/2水平高低与丙泊酚、BMSC移植对SCI大鼠的治疗作用相关;丙泊酚与BMSC移植联合应用时,分别与丙泊酚组、BMSC移植组相比,大鼠脊髓组织中p-ERK1/2水平均更加降低,同时其BBB评分、斜板实验功能值、体感及运动诱发电位波幅、脊髓组织中SOD水平均进一步增高,体感及运动诱发电位潜伏期、脊髓组织中MDA水平均更加降低,表明丙泊酚联合BMSCs治疗SCI的药理机制可能是抑制p-ERK1/2水平。 综上所述,丙泊酚、BMSC移植均可降低SCI大鼠脊髓组织p-ERK1/2水平、减轻氧化应激损伤,修复其神经电生理功能,促进大鼠运动功能恢复,两者联合使用具有协调作用,ERK1/2通路可能是其作用靶点,为临床SCI的治疗提供了新的思路。
