毛细血管密度对左心室肥大心肌纤维化的影响研究
2020-03-04李宇刘健磊郭爱林刘宗泓
李宇 刘健磊 郭爱林 刘宗泓
据WHO统计左心室肥厚(LVH)已经成为心血管疾病患者病死率的一个重要的预测因素及独立的危险因素,从而越来越受到大家的重视[1]。LVH是由心肌细胞大小增加引起的左心室形态的生长变化。LVH既可能是生理适应结果,也可能是继发于遗传性疾病或左心室超负荷的病理状态。病理性LVH是一种代偿性现象,并逐渐发展为左心室功能障碍甚至心力衰竭。有文献报道合并高血压使急性心肌梗死、充血性心力衰竭、猝死及其他心血管事件的发生率增加6~8倍[2]。压力超负荷是诱导心肌肥厚,心力衰竭的主要原因之一[3]。无论病因如何,心肌纤维化是心脏衰竭发病机制的重要决定因素。心脏纤维化是指胶原蛋白过多沉积在心脏细胞外基质(ECM)中,从而损害心脏的收缩和舒张功能[4]。在肥厚的心肌中,胶原蛋白通常沉积在小动脉的细胞间质和周围空间中[5]。这种胶原蛋白沉积既可能是区域性的,也可能分布更为分散[6-9]。同时肥厚型心肌细胞患者的磁共振成像(MRI)检测显示,心肌纤维化分布具有异质性[10]。纤维化区域与心肌壁增厚呈正相关,与区域收缩呈负相关[11]。虽然目前针对压力超负荷引起LVH形成的机制等研究较多,但是针对毛细血管密度与LVH的形成之间的关系却少有人研究。本实验通过压力超负荷诱发的LVH大鼠模型,探讨相同的压力超负荷下,左心室壁中各室壁心肌纤维形成能力不同,此种不同是否与毛细血管分布水平有关,从而探讨毛细血管密度是否是影响心室肥厚的一种因素,从而为压力超负荷诱发的LVH的早期诊断和预防提供了新的干预靶点。
1 材料与方法
1.1 一般资料
1.1.1 实验动物:6~8周大的雄性SD大鼠40只,许可证号:SCXK(京)2016-0006。在标准实验室条件下将大鼠圈养在聚丙烯笼中,大鼠可以随意进食标准饮食和纯净水。
1.1.2 实验仪器与试剂:复合凝胶(OCT,Leica,Germany公司);天狼星红染色试剂盒(Solarbio公司);WGA凝集素(WGA,Sigma公司);山羊抗大鼠CD31抗体(R&D,AF3628);小鼠抗大鼠波形蛋白抗体(Abcam,ab8978);兔抗大鼠胶原蛋白I(Abcam,ab34710)抗体;Alexa Fluor 488驴抗山羊二抗(Thermo Fisher,A-11055);Alexa Fluor 488山羊抗小鼠二抗(Thermo Fisher,A-11001);辣根过氧化物酶偶联的抗兔二抗(Cell Signaling Technology,8114);4’,6-二氨基二氨基-2-苯基吲哚二盐酸盐(DAPI,Sigma,D9542);苏木精(生工生物);超声心动机(Vivid 7 Dimension,GE)。
1.2 实验方法
1.2.1 LVH的诱导:①分组:将40只大鼠随机分为假手术对照组(n=20)和AAC组(n=20),对大鼠进行AAC诱导病理性心肌肥大。②模型建立:鼠麻醉后,自主呼吸的情况下,剪开胸骨上窝到胸骨第二肋骨,后分离皮下气管前筋膜和肌肉层,充分暴露气管,在中间分离胸腺至升主动脉,通过结扎使升主动脉根部直径缩小一半,其横截面积减少约70%。假手术的对照组进行了相同的手术过程,只是没有进行主动脉束带。肌内注射止痛地那辛(0.8 mg/kg)以减轻手术后的疼痛。从外科手术中存活的所有大鼠都包括在实验中,并且在研究终点存活。
1.2.2 心脏回波描记:所有动物均置于诱导室中,并以1.5%~2.5%异呋喃与0.8 L/min 100%O2混合进行麻醉。在主动脉绑扎手术后的第8、16、20、28和34周间隔,使用11.5 MHz传感器(Vivid 7 Dimension,GE)进行一系列超声心动图检查。通过二维模式短轴交叉测量舒张期室间隔深度(IVSD)、左心室后壁深度(LVPWD)、舒张末期容积(EDV)、每搏输出量(SV)、心率(HR)和射血分数(EF),心输出量(CO)为SV与HR的乘积。
1.2.3 组织获取:AAC手术后34周,所有大鼠均用10%35 mg/kg水合氯醛麻醉,并用10%氯化钾(2 ml/kg)安乐死。收集所有实验大鼠心脏,并从顶部到底部从中间横向切开。切断左右心房和右心室。将切除的左心室称重于电子秤上,然后在10%甲醛溶液中快速固定24 h。然后将心脏包埋在最适切割温度的复合凝胶(OCT,Leica,Germany)中,并切成系列切片,用于随后的染色。显微镜下观察心肌变化及纤维化程度。
1.2.4 胶原蛋白体积分数(CVF)的测量:在显微镜(Nikon,80i)下检查天狼星红染色的切片,并用SPOT FLEX拍照。通过左心室和右心室的相对位置识别不同的心室壁。CVF用ImageProPLus6.0(IPP6.0)软件测量,并以天狼星红阳性区域面积占切片总面积的比例来计算。
1.2.5 心肌细胞平均大小的测量:所有切片均用20 μg/ml FITC结合凝集素(WGA,Sigma,L4895)固定,37℃标记细胞膜1 h,共聚焦显微镜下观察。用IPP6.0软件采集左心室各部5个视野,计算各位300个细胞的平均大小。
1.2.6 天狼星染色:天狼星红染色在普通光学显微镜下,组织的胶原纤维呈现红色,肌纤维被染成黄色。10%甲醛用于固定,脱水包埋后切片。天狼星红染色液 常温染色1 h,自来水洗5~10 min,蒸馏水洗1次,常规脱水透明,中性树胶封固。在普通光学显微镜下观察。
1.2.7 免疫荧光染色:将切片用4%多聚甲醛固定并用2%牛血清白蛋白(BSA)封闭。然后,将切片与山羊抗大鼠CD31(R&D,AF3628),小鼠抗大鼠波形蛋白vimentin(Abcam,ab8978)或兔抗大鼠胶原蛋白I(Abcam,ab34710)抗体在4℃条件下孵育过夜。TBS缓冲液洗涤后,用Alexa Fluor 488驴抗山羊抗体(Thermo Fisher,A-11055),Alexa Fluor 488山羊抗小鼠(Thermo Fisher,A-11001)或辣根过氧化物酶偶联的抗兔抗体(Cell Signaling Technology,8114)分别在3℃下孵育1 h。复染4’,6-二氨基二氨基-2-苯基吲哚二盐酸盐(DAPI,Sigma,D9542)或苏木精指示核染色。在共聚焦显微镜(ECLIPSE Ti A1,Nikon)或光学显微镜(Nikon 80i)上用10倍目镜和20倍物镜检查所有切片。在每个壁上拍摄左心室各部分的至少3个视野。平均密度和毛细血管密度均通过IPP 6.0软件计算。
2 结果
2.1 AAC诱导大鼠心脏肥大 大鼠的心脏肥大通过超声心动图短轴横截面积测量心脏功能和心肌厚度。AAC组的CO显著高于假手术对照组,并且在手术后持续增加。与假手术组相比,AAC组的SV在16周内没有明显变化,但随后有所增加。同样的,AAC组的EDV前期并没有显著改变,但在实验终点前逐渐增加。与假手术对照组相比,AAC组的EF在AAC手术后16周明显增高,并且这种增加一直持续到术后28周。此外,术后34周测量同一AAC组的EF降低。术后34周,IVSD和LVPWD均明显增加。这种变化模式很好地关联了压力反应后心肌的代偿性变化和失代偿性变化。见表1。
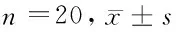
表1 2组心脏功能和壁厚比较
2.2 LVH心肌中的差异性胶原沉积 LVH心肌切片用天狼星红和特定的抗Ⅰ型胶原蛋白染色,以鉴定胶原蛋白含量和区域分布。AAC手术后34周,总LV心肌的胶原容积分数显著升高。过多的胶原蛋白主要沉积在心内膜和小动脉周围区域的间质中。左心室进一步分为4个部分:室间隔(IVS),前壁(AW),后壁(PW)和侧壁(LW)。后壁和侧壁的胶原容积分数显著增加,但其他部分的胶原容积分数没有明显变化。与上述结果类似,后壁和侧壁中Ⅰ型胶原蛋白的平均密度明显增加(P<0.05),而其他部分则没有显著变化。通过抗波形蛋白免疫荧光染色确定成纤维细胞分布,结果还显示后壁和侧壁成纤维细胞显著增加(P<0.05),而左心室的其他3个部分则没有明显变化。见图1、2,表2~5。
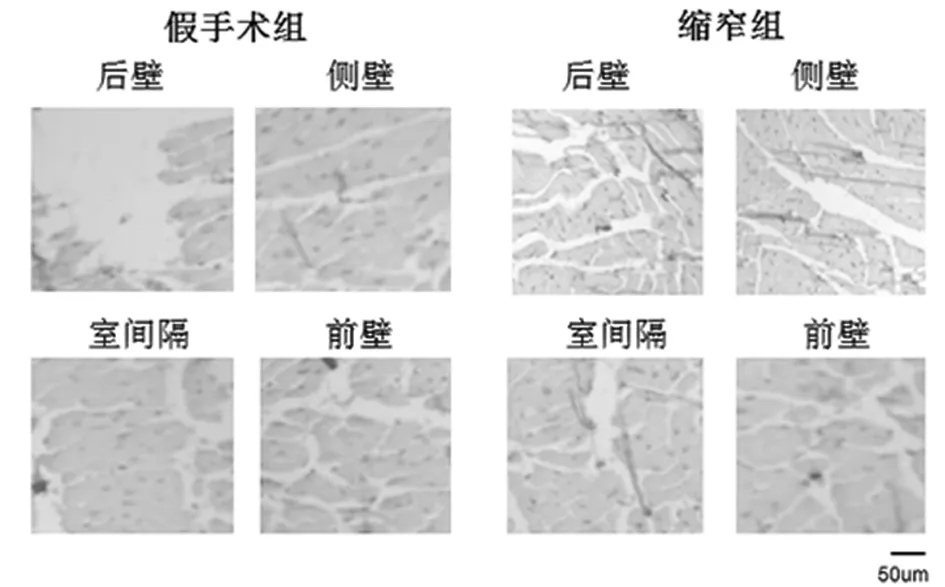
图1 左心室不同部位的心肌纤维化;左右分别为假手术组和缩窄组左心室壁四部分,间质及小动脉周围(天狼星红染色×200)
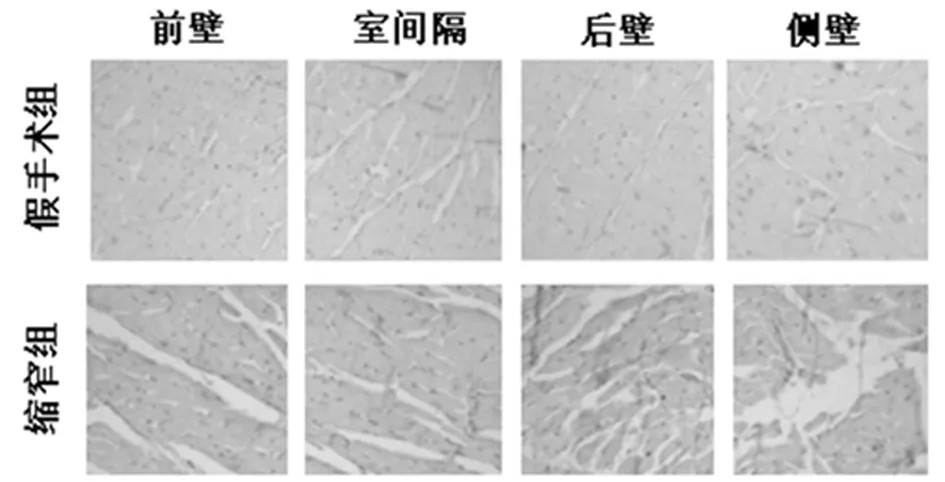
图2 左心室不同部位的胶原和成纤维细胞分布(免疫组化×200)

表2 2组总胶原蛋白体积分数比较

表3 2组不同左心室壁总胶原蛋白体积分数比较
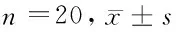
表4 左心室不同部位胶原蛋白平均密度比较
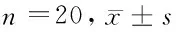
表5 抗波形蛋白平均密度比较
2.3 LVH心肌中心肌细胞的差异性 为了确定心肌细胞的大小,应用了荧光染色来显示心肌细胞的细胞膜。与假手术对照组相比,AAC组心肌细胞的平均大小有所增加。此外,AAC组侧壁和后壁中的心肌细胞明显大于假手术对照组,而在左心室的其他部位则无明显变化。见图3,表6、7。

图3 左心室不同部位的心肌细胞平均大小;膜用FITC标记(荧光染色×200)
表6 整体心肌细胞平均大小比较

表6 整体心肌细胞平均大小比较
组别心肌细胞平均大小缩窄组 4 872±123假手术组7 400±105
表7 左心室不同部位心肌细胞平均大小比较

表7 左心室不同部位心肌细胞平均大小比较
组别前壁室间隔后壁侧壁缩窄组 2 697±126.2 672±1132 899±372 974±63假手术组2 911±1302 735±1264 903±724 890±151
2.4 LVH心肌的毛细血管密度 使用抗CD31抗体通过内皮细胞的特异性染色来确定毛细血管密度。与假手术对照相比,LVH心肌的毛细血管密度显著降低。重要的是,在后壁和侧壁区域观察到最低的毛细血管密度,这与这些区域中大量胶原蛋白的广泛沉积非常吻合。见表8、9,图4。
表8 毛细血管平均密度比较

表8 毛细血管平均密度比较
组别毛细血管平均密度缩窄组 2 310±239假手术组2 016±211*
注:与缩窄组比较,*P<0.05
表9 不同壁间毛细血管平均密度比较

表9 不同壁间毛细血管平均密度比较
组别前壁室间隔后壁侧壁缩窄组 2 067±2602 118±2471 987±2171 894±212假手术组2 160±2232 199±3052 600±171*2 440±121*
注:与缩窄组比较,*P<0.05
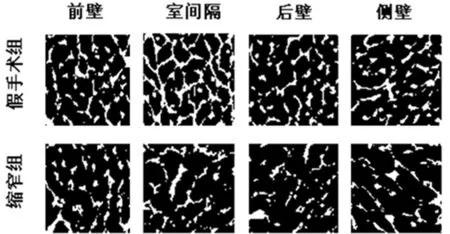
图4 左心室不同部位的毛细血管密度;抗CD31特异性抗体显示的毛细血管(免疫荧光染色×200)
3 讨论
一个世纪前,威廉·哈维(William Harvey)的一篇开创性的文章首次描述了左心室重构[12]。当时,人们认为左心室扩张预后不良,而心肌肥厚仅仅被视为缓解左心室扩张有害影响的补偿反应[13]。实验研究结果对这一观点提出了挑战,心肌细胞肥大的钝化并不会导致心功能障碍[14],这意味着LVS是一种常见的但不是强制性的适应。LVH常出现于心肌梗死后,由于血流动力学负荷增加而导致肥厚[15]。 在压力超负荷引起的心脏肥大中,心肌细胞早期开始变大,以帮助增加CO。一旦血液供应不能满足这些肥厚型心肌细胞的氧气需求,它们就会凋亡,并伴随着胶原蛋白的沉积过多,从而导致收缩和舒张功能受损[16,17]。我们的研究证明,在AAC手术造成的LVH大鼠模型中,EF在手术28周后显著增加,而在术后34周观察到后壁和室间隔增厚以及从同心到偏心肥大的过程后,模型的EF值出现了明细下降,表明心肌出现肥厚后期会出现代偿失调反应。 与心脏功能障碍有关的心肌纤维化已得到广泛研究[18,19]。最近的研究集中在区域性心肌纤维化,以及通过MRI检测减弱的区域收缩[20]。通过探索心肌纤维化的好发部位以及响应压力超负荷损伤,有助于了解心肌表皮纤维化的病理过程。在此研究中,SD大鼠分为对照组和AAC引起的心肌肥厚2组。手术后34周,将大鼠处死以获取心脏。随后处理心肌组织并切片,以检测胶原蛋白沉积、心肌细胞大小和血管相对密度。结果发现,在ECM中充满天狼星红和抗胶原蛋白I抗体的多余胶原蛋白,但大量的胶原蛋白成分主要分布在左心室后壁和侧壁,而非前壁和室间隔,这与成纤维细胞的累积情况相一致。心肌细胞在后壁和侧壁的肥厚水平高于左心室其他区域,这与差异性区域胶原积累具有相关性。所以我们发现在相同压力下,过多的胶原蛋白及成纤维细胞积累在LVH心肌的不同区域之间且分布不均匀,主要集中于左心室的后壁和侧壁。这种不同,与血液供应和氧气需求的不平衡有关。 在压力负荷刺激心肌肥厚的早期,新生心肌组织血管正常或增加,有利于维持心功能和维持代偿性心肌肥厚。随着压力负荷的不断增加,心室重构明显加重,心肌组织新生血管减少,导致心肌组织慢性缺氧,心肌细胞损伤,心功能下降。这种减少最终促进了代偿性肥大向失代偿性心力衰竭的转变[21]。因此,血管生成减少是导致心力衰竭发生的重要机制,但目前其确切的分子机制尚不清楚。 有临床研究中发现,心力衰竭患者的血管生成能力明显低于健康人[22]。根据先前的研究,压力负荷增加心肌细胞横截面积,增加心室的面积,使毛细血管密度的降低程度更加明显。血管内皮生长因子(vascular endothelial growth factor,VEGFA)是内皮细胞有丝分裂原,参与血管生成和血管生成[22]。我们的研究结果表明,在相同的压力超负荷影响下,左心室后壁和侧壁胶原细胞及成纤维细胞的积累较其他室壁更多,同时左心室后壁及侧壁的心肌细胞肥大较其他室壁明显,且这2个室壁的毛细血管密度最低。说明左心室后壁和侧壁更易受压力超负荷引起的心脏肥大后纤维形成的影响,可能原因是这些区域毛细管密度分布水平较低,而这与这2个区域的血管新生抑制有关。 综上,我们发现在通过AAC诱导的肥厚性心肌中,总毛细血管密度显著降低,而胶原蛋白显著增加。左心室侧壁和后壁的毛细血管密度显著降低,而其他区域的毛细血管密度没有明显改变。因此,我们认为AAC手术后血液供应的局部减少将是导致心肌纤维化发展不均衡的主要因素。而这可能是由于在相同的整体AAC压力下,左心室后壁和侧壁更易受心脏肥大后纤维形成的影响,可能与这些区域毛细血管密度分布水平较低有关。
