RhoA/ROCK-NF-κB信号传导通路介导内脂素诱导的心肌细胞炎性反应机制研究
2020-03-04常亮徐璐刘素云郭炳彦金鑫贾妍李拥军
常亮 徐璐 刘素云 郭炳彦 金鑫 贾妍 李拥军
据不完全统计,全球每年死于心血管疾病和卒中的人数约占所有死亡的1/3。如何通过有效的手段降低心血管疾病发病率与病死率,已经成为重大公共卫生问题[1]。病理性心肌肥大是心血管疾病发病率和病死率增加的独立性危险因素,可导致心肌重构,心肌收缩功能下降,在细胞层面主要表现为心肌细胞表面积增大,伴有细胞凋亡、心肌纤维化等不可逆过程,与心脏猝死、冠心病和心力衰竭关系密切。其具体病理机制仍有待进一步阐明。近年来有大量研究报道,炎症在循环系统疾病中发挥重要作用,多种效应的炎性细胞因子如肿瘤坏死因子(TNF-α)、白介素-10(IL-10)可诱导心肌肥大反应[2]。内脂素最初是从活化的外周血淋巴细胞中分离出来的,与B淋巴细胞的成熟相关,又称前B细胞克隆增强因子。内脂素不仅是脂肪细胞特异的蛋白,还是一个重要的前炎性因子。已有报道显示,肥胖、代谢综合征、糖尿病、高血压等疾病患者的血浆内脂素水平升高,且与促炎因子水平密切相关,体外实验证实,胞外内脂素可通过Nampt活性促进血管炎症[3]。闫伟等[4]研究认为,内脂素在肥胖、胰岛素抵抗、2型糖尿病等代谢性疾病中充当一种炎性标记物及致内膜损伤性物质,还参与心血管疾病的细胞增殖、单核巨噬细胞激活与招募、血管炎症及细胞外基质重构的病理过程,参与冠心病的发病过程,并与冠状动脉病变严重程度密切相关[4]。本研究前期表明,心肌细胞内脂素mRNA和蛋白表达在Ang Ⅱ诱导的心肌细胞肥大中的增加,并呈剂量和时间依赖性的增加[5]。炎性细胞因子级联反应在心力衰竭、动脉粥样硬化的发生发展具有重要作用。目前,笔者尚未见有关内脂素与心肌细胞炎性反应在心肌肥大中的研究。本实验拟通过体外实验观察外源性内脂素干预下的小鼠心肌细胞中炎性因子的变化,结果如下。
1 材料与方法
1.1 实验动物 清洁级2~3 d龄SD乳鼠,雌雄不限,河北医科大学实验动物中心提供。
1.2 主要试剂 多聚甲醛固定液、辛伐他汀,美国Sigma公司产品;多聚左旋赖氨酸,购自美国AMRESCO公司;重组大鼠内脂素为Abcam公司;NF-κB抑制剂SN50、ROCK抑制剂Y27632、Sirtinol,均为美国santa cruz公司产品;SP免疫组化试剂盒,美国Zymed Laboratories公司产品;DMEM培养基、Ⅱ型胶原酶干粉,为GIBCO公司产品;D-Hanks平衡盐溶液、胎牛血清,购自北京索来宝科技有限公司;胰蛋白酶干粉,为美国Hyclone公司产品;双抗培养基,美国英杰生命技术有限公司产品;5-溴脱尿苷、ROCK2兔抗鼠一抗、RhoA兔抗鼠一抗、IκBα兔抗鼠一抗、p65兔抗鼠一抗,均为SANTA CRUZ公司(美国)产品;总RNA提取试剂(Trizol法),购自北京SBS公司;琼脂糖,北京北方同正生物技术发展有限公司;四甲基偶氮唑蓝,美国HyClone公司;SYBR Green 核酸染料,美国复能基因有限公司。
1.3 主要仪器 NIKON倒置显微镜,日本/Nikon (尼康公司);恒温振荡器THZ-C,江苏太仓试验设备厂;TDL-16 台式高数离心机,上海安亭科学仪器厂;MCO175型CO2培养箱,日本SANYO公司;StepOne美国ABI StepOneTM实时荧光定量PCR仪,ABI公司。
1.4 方法
1.4.1 心肌细胞提取及培养:新生大鼠仰卧固定,75%乙醇皮肤消毒后,剪开皮肤,暴露皮下组织,在无菌条件下开胸摘取心脏。取心尖区心室肌组织1 mm3放入平皿中,加入4 ml 0.08%胰消化酶于恒温振荡器(35℃~37℃)搅拌5 min后,静置2 min,自然沉淀,弃上清。沉淀再次消化,反复2 次后,取上清于无菌离心管中,加入含有10%胎牛血清的低糖DMEM 4 ml终止胰酶作用,重悬后离心,弃上清。反复3 次。结束后,收集离心后的心肌细胞,充分重悬、过滤,转入培养皿中。利用差速贴壁法分离出心肌细胞,收集细胞悬液,常规使用5-BrdU抑制成纤维细胞的干扰。将上述方法得到的细胞悬液细胞计数后置于培养箱中37℃孵育90 min备用。
1.4.2 分组及干预方法:按上述方法心肌细胞原代培养48 h后,换无血清培养液体再培养24 h后,将细胞每6孔分为1组,换培养基的同时进行分组,分别加入不同的干扰因素进行实验。①正常对照组,10、50、100 ng/ml浓度的重组内脂素,干预24 h;②正常对照组,100 ng/ml重组内脂素分别干预12、24、48、72 h;③正常对照组、重组内脂素100 ng/ml、SN50(20 μmol/L)、SN50(20 μmol/L)+重组内脂素100 ng/ml,干预48 h;④正常对照组、重组内脂素100 ng/ml、Y27632(10 μmol/L)、Y27632(10 μmol/L)+重组内脂素100 ng/ml、辛伐他汀(1 μmol/L)、辛伐他汀(1 μmol/L)+重组内脂素100 ng/ml,干预48 h;⑤正常对照组、重组内脂素100 ng/ml、sirtinol (200 μmol/L)、sirtinol (200 μmol/L)+重组内脂素100 ng/ml,干预24 h。
1.4.3 Real-time PCR法检测心肌细胞TNF-α mRNA表达:分别吸取细胞培养板中培养液,Trizol裂解细胞提取心肌细胞总RNA,用分光光度计测定所抽提RNA 的浓度和纯度,使用前调整浓度为1 μg/μl。取上述总RNA 1~5 μg,按照说明书进行逆转录合成cDNA(42℃ 50 min,95℃ 5 min)。取逆转录转录产物按试剂盒说明书进行Real-time PCR反应。RT-PCR 产物4 μl,加上样缓冲液1 μl进行1.5 %琼脂糖凝胶电泳,凝胶成像后用凝胶图像分析系统进行吸光度扫描。结果分析以GAPDH为内参基因,采用相对定量2-ΔΔCt计算TNF-α mRNA相对表达量。
1.4.4 MTT法检测心肌细胞活力:吸去培养基,PBS洗3次,心肌细胞以1×105/ml密度种植于96孔细胞培养板中,每孔加入5 mg/ml MTT溶液,培养箱内继续孵育4 h,之后每孔加入150 μl的DMSO,震荡10 min。用Bio-Rad550型酶标仪,在490 nm波长检测其光吸收值(OD)。
1.4.5 Western blot法检测心肌细胞Sirt 1蛋白表达:收集胰酶消化的心肌细胞,用细胞裂解液于冰上裂解30 min,并抽提总蛋白,BCA试剂盒测定蛋白质含量。将蛋白加入2倍的上样缓冲液,100℃煮沸5 min,使蛋白变性12 000 r/min离心5 min,收集上清进行SDS-PAGE电泳,染色,电转至PVDF 膜,封闭液(5 g脱脂奶粉溶于100ml TBST)室温封闭1 h,分别加入特异性一抗,4℃孵育过夜,TBST洗膜,加相应二抗室温孵育2 h, ECL显色后扫描,拍照,用GDS-8000 凝胶成像分析分析目的条带的吸光度值,以GAPDH为内参。
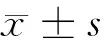
2 结果
2.1 TNF-α mRNA表达结果 24 h后心肌细胞TNF-α mRNA表达量随内脂素浓度(10、50、100 ng/ml)的升高而升高,100 ng/ml浓度时最高。随后,用100 ng/ml内脂素干预心肌细胞12、24、48、72 h,检测显示,心肌细胞TNF-α mRNA表达随着干预时间的延长而升高,且以干预48 h后达到峰值,72 h后较48 h时略有升高,但差异无统计学意义(P>0.05)。见表1、2。
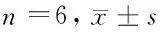
表1 不同浓度内脂素对心肌细胞TNF-α mRNA表达的影响
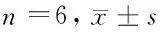
表2 100 ng/ml内脂素不同作用时间对心肌细胞TNF-α mRNA表达的影响
2.2 内脂素对心肌细胞活力的影响 用不同浓度(10、50、100 ng/ml)的内脂素干预心肌细胞24 h结果显示,OD值在内脂素浓度为10 ng/ml时最高,50、100 ng/ml时降低,且100 ng/ml时低于明显低于正常对照组(P<0.05)。用100 ng/ml内脂素分别干预心肌细胞12、24、48、72 h,检测显示,12 h组心肌细胞OD值与正常对照组比较差异无统计学意义,24 h后开始降低,与正常对照组比较差异有统计学意义(P<0.05)。应用SIRT 1特异性阻断剂sirtinol (200 μmol/L)预干预心肌细胞,24 h后检测显示,sirtinol (200 μmol/L)+重组内脂素干预组心肌细胞OD值明显低于正常对照组,高于100 ng/ml内脂素干预组(P<0.05)。见表3~5。
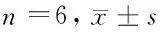
表3 不同浓度内脂素对心肌细胞活力的影响
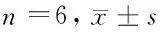
表4 100 ng/ml内脂素不同作用时间对心肌细胞活力的影响
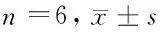
表5 Sirtinol对心肌细胞活力的影响
2.3 内脂素对心肌细胞SIRT 1蛋白表达的影响 心肌细胞Sirt 1蛋白表达随着内脂素浓度的增加和干预时间的延长升高,100 ng/ml内脂素干预48 h时最高,72 h时仍高于正常对照组,但较48 h组比较差异无统计学意义(P>0.05)。见表6、7,图1。
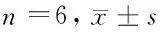
表6 不同浓度内脂素对对心肌细胞Sirt 1蛋白表达的影响
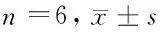
表7 100 ng/ml内脂素不同作用时间对心肌细胞Sirt 1蛋白表达的影响
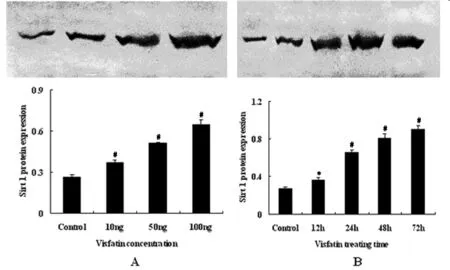
图1 内脂素对心肌细胞SIRT 1蛋白表达的影响 注:与正常对照组比较,10 ng/ml,50 ng/ml和100 ng/ml内脂素处理24 h心肌细胞中Sirt 1蛋白表达及100 ng/ml内脂素处理 12,24,48和72 h心肌细胞中Sirt 1蛋白表达,*P<0.05,#P<0.01
2.4 RhoA/ROCK2和NF-κB通路在内脂素诱导的心肌细胞炎性反应中的作用 分别应用辛伐他汀、Y27632和SN50预干预心肌细胞,随后应用100 ng/ml内脂素干预心肌细胞48 h后,检测心肌细胞TNF-α mRNA水平。结果显示,加用SN50、辛伐他汀和Y27632预干预组的心肌细胞TNF-α mRNA水平明显低于单纯内脂素干预组,高于正常对照组(P<0.05)。见表8、9,图2。
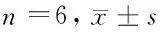
表8 SN50对心肌细胞TNF-α mRNA的影响
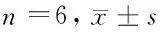
表9 辛伐他汀、Y27632对心肌细胞TNF-α mRNA的影响
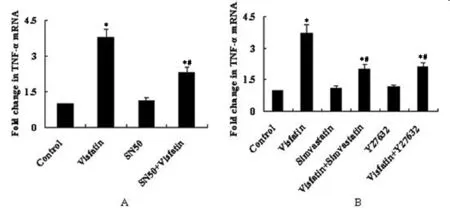
图2 RhoA/ROCK2和NF-κB通路内脂素诱导的心肌细胞炎性反应的影响;与正常对照组比较,*P<0.01;与内脂素组比较,#P<0.01
3 讨论
内脂素是由内脏脂肪细胞分泌的一种脂肪细胞因子,是由Fukuhar等[6]于2005年发现,人体内脏白色脂肪组织含有大量巨噬细胞,巨噬细胞是参与炎性反应的主要细胞。因此,有研究认为内脂素可能是一个重要的前炎性因子,在炎性反应中发挥重要作用。高浓度的IL-6参与了炎症的发生发展,冠状动脉的粥样硬化的病理特征是冠状动脉管壁的慢性炎症反应,IL-6是其发生发展过程的重要促炎因子,冠心病患者血浆IL-6水平与内脂素水平正相关[7]。肥胖是通过脂肪细胞分泌的促炎细胞因子如TNF-α、IL-6与全身性炎症密切相关。在肥胖和2型糖尿病(T2DM)患者中,在内脏和皮下脂肪组织都有强烈的促炎活性因子。内脂素可显著诱导单核细胞中CD-80、CD40以及ICAM-1 (CD54)的表达,从而激活T细胞,来诱导和调节免疫功能[8]。庞欣欣[9]研究显示,肠黏膜炎症疾病中有大量内脂素的表达,推测内脂素作为炎性介质可能参与肠黏膜损伤的过程,从而影响肠黏膜屏障。且LPS刺激时,沉默TLR4、TLR2和IL-1R1同样会引起炎性因子的表达下降,进一步说明LPS介导的炎性反应中,内脂素的表达与TNF-α、IL-1β和IL-6等炎性因子表达有关[9]。Heo等[10]用内脂素处理HepG2细胞后,通过实时聚合酶链反应(RT-PCR)和HepG2细胞的免疫细胞化学染色评估炎性细胞因子IL-6,TNF-α和IL-1βmRNA的表达,结果显示,200和400 ng/ml,浓度干预的HepG2细胞中IL-6,TNF-α和IL-1βmRNA的表达显著增加,进一步检测显示内脂素能通过HepG2细胞中的STAT3和NF-κB途径诱导促炎性细胞因子IL-6,TNF-α及IL-1β生成。最新研究已经表明,炎症是动脉粥样硬化发生的基础,而内脂素在炎症和动脉粥样硬化中起作用。Darabi等[11]检测结果显示,升高的血清内脂素可能通过促进炎症参与ACS的发病机制,在急性冠脉综合征中其水平与炎症状态相关。心肌肥大已被公认为是猝死、心力衰竭等心血管事件强有力的独立危险因素。介导心肌肥大的信号转导通路有多条,各个通路之间可能存在错综复杂的联系。TNF-α是炎性细胞因子之一,具有多种效应,已经被证实在心肌肥大和重构过程中具有重要作用[12]。据报道,TNF-α能够通过激活的PI3K-IP3、R-Ca2+途径、抑制细胞内钙及钙调节的钙调蛋白激酶诱导乳鼠心肌肥大[13]。在本研究中发现,内脂素可以诱导心肌细胞TNF-αmRNA表达增加,并有剂量和时间依赖性升高。推测内脂素可以直接诱导心肌细胞炎性反应。 NF-κB是细胞内重要的核转录因子,几乎存在于所有细胞中。通常情况下,NF-κB以p50-p65异二聚体的形式与其抑制性蛋白结合存在于细胞浆内呈非活化状态,但其可以被多种刺激因子刺激活化,一旦激活,从细胞浆进入细胞核内,与一些炎性细胞因子基因的启动子结合,启动这些细胞分子的基因转录,进而产生一系列炎性反应。因而,NF-κB也是炎性因子转录调控的主要因子。IL-6和ICAM-1基因启动子上均含有NF-κB结合位点,NF-κB是其表达的直接调控因子。NF-κB参与了病理性心肌肥厚的形成,能够放大炎症信号、激活凋亡因子、诱导动脉粥样斑块生成[14]。四逆汤可以有效改善由异丙肾上腺素诱导所致的病理性心肌肥厚,其机制可能与抑制TLR4/NF-κB炎症信号通路,下调TNF-α、IL-6炎性因子有关[15]。检测显示,不稳定性心绞痛患者外周血白细胞NF-κB活性显著增强,并能促进TNF-α、IL-1的表达水平[16]。RhoA/ROCK通路参与细胞肌动蛋白骨架的调节、细胞的收缩、黏附、增生、分化及基因的表达等,近年来越来越多的证据表明,其在动脉粥样硬化的发生发展中起着重要作用,包括内皮细胞的结构功能改变到斑块的形成与破裂。动脉粥样硬化炎性反应多个阶段均有RhoA/ROCK通路的参与。在糖尿病引起的心肌纤维化中,RhoA/ROCK通路通过调控其下游效应分子,直接或间接激活巨噬细胞及TNF-α等炎性因子的表达及成纤维细胞,导致动脉粥样硬化、加重心肌缺血损伤后内皮细胞的炎性反应,或导致心室壁僵化加速心肌纤维化[17,18]。本部分研究发现,分别应用RhoA/ROCK-NF-κB信号通路抑制剂SN50、辛伐他汀和Y27632预干预内脂素作用的心肌细胞,检测显示,预干预组的心肌细胞TNF-αmRNA表达明显低于100 ng/ml内脂素干预,因此推测RhoA/ROCK-NF-κB信号通路介导内脂素诱导的心肌细胞炎性反应。 TNF-α对心肌细胞具有负性肌力作用,会降低心肌细胞的活力。细胞内钙稳态调节是影响心肌正常兴奋-收缩耦联功能的最重要因素。而TNF-α能够抑制肌浆网Ca2+-ATP酶活性及收缩期细胞内钙水平的增高,导致心肌细胞内Ca2+离子水平下降,从而使心肌细胞收缩力降低。在心肌缺血再灌注损伤中,血清TNF-α水平的表达与心肌收缩功能呈明显负相关,高水平的TNF-α可激活肽水解酶及蛋白水解酶降解关键性收缩蛋白,包括肌钙蛋白,导致缺血后心肌功能不良[19]。TNF-α可以诱导心肌内NO产物增多,而高浓度的NO能直接损伤心肌细胞,抑制心肌收缩力。TNF-α还可以促进炎性细胞因子IL-1、IL-6的表达,产生间接的负性肌力作用。本研究发现,10 ng/ml内脂素干预心肌细胞24 h,心肌细胞MTT产物的OD值在内脂素浓度最高,之后降低,100 ng/ml内脂素干预心肌细胞24 h后心肌细胞OD值明显下降,而且随着干预时间的延长,越来越低,心肌细胞出现功能异常。提示较低浓度的内脂素可以引起心肌细胞的活力增加,心肌细胞在高浓度、长时间的内脂素干预活力的下降。心肌细胞在低浓度内脂素干预下不仅炎性因子表达明显增加,但心肌细胞活力降低,这一结果说明,还有一些活性物质具有提高心肌细胞活力,减弱炎性因子负性肌力的作用。 Sir2基因家族是一类NAD+依赖型组蛋白去乙酰化酶,在各种物种、组织和细胞均有表达,通过参与转录沉默、DNA修复等生物过程,在心血管系统疾病、衰老及能量代谢等疾病中发挥作用。目前研究发现,哺乳动物有SIRT1~SIRT7共7种Sir2同源蛋白,其中,Sirt 1与糖尿病、阿尔茨海默病、冠心病等病理机制相关。动物实验证实,结扎冠状动脉导致的心脏心力衰竭、左心室失代偿性肥大狗模型,Sirt 1表达上调,加速心肌病的发展。Sirt1的激活可能参与异丙肾上腺素诱导的小鼠心肌肥大。高血压大鼠模型中SIRT1 表达量较正常大鼠增高,且左心室肥大发生与心肌组织SIRT1mRNA 量正相关。本实验也发现,心肌细胞Sirt 1蛋白水平随着内脂素干预浓度的增加和干预时间的延长明显升高。结上分析,内脂素可能是通过增加心肌细胞Sirt 1的表达来诱导心肌细胞肥大。但Sirt 1还是内源性的凋亡抑制因子,对哺乳动物β细胞的胰岛素分泌有正向调节作用;可以抑制PPAR-γ活性,抑制脂肪细胞分化,降低脂肪沉积;能调节FOXO1 活性促进血管形成及缺血后新生血管形成。由此可见,Sirt 1在糖尿病心肌病、动脉粥样硬化等病理过程中发挥保护作用。Sirt 1还能调节细胞能量变化和细胞氧化还原状态,可抑制线粒体解偶联蛋白表达,降低线粒体功能障碍,增加ATP生成,减少细胞损伤,从而减弱心脏重构引起的心功能减退[20]。NF-κB的活性受Sirt1的调节,Sirt1可使NF-κB赖氨酸残基去乙酰化,减少其与核内炎性基因结合[21],进而降低TNF-α、IL-1β等炎性因子的产生而发挥对心血管保护作用。由此可见,Sirt1的调节作用具有复杂性和矛盾性,在促进心肌细胞肥大作用的同时,又有心肌保护作用。过高表达的Sirt 1对心肌细胞保护性作用丧失,导致心肌细胞肥大和心肌细胞凋亡,而适度的表达能促进心肌细胞能量合成,保护心脏[22]。研究显示,Sirt 1单倍剂量不足的情况下可以减轻压力超负荷诱导的心肌肥厚,而上调Sirt 1会加重心肌肥厚。因此本研究中可以推断,低浓度的内脂素干预心肌细胞时没有出现明显的活力下降,可能是由于内脂素导致Sirt 1合成增加,进而促进心肌细胞能量合成增加所致。而50 ng/ml内脂素干预时后心肌细胞活力降低,可能与高浓度的Sirt 1表达促进心肌细胞能量合成作用减弱,且TNF-α水平升高有关。100 ng/ml内脂素干预12 h心肌细胞活力未见明显变化,可能为Sirt 1促进心肌细胞能量合成增加,抑制TNF-α的负性肌力作用。而应用Sirt 1特异性阻断剂sirtinol预干预心肌细胞后,sirtinol预干预组心肌细胞活力较正常对照组明显下降,但高于单纯内脂素干预组,间接证实了Sirt 1过高表达可损害心肌细胞。 综上可见,内脂素可以直接诱导心肌细胞发生炎症反应,而RhoA/ROCK-NF-κB通路在其中发挥重要作用。此外,内脂素诱导的Sirt 1适度表达具有降低炎性因子对心肌细胞损害的作用。
