血管超声成像之高级功能的技术特点与临床应用∗
2020-03-03杜宜纲李双双章希睿桑茂栋向兰茜林穆清陈志杰何绪金
杜宜纲 朱 磊 李双双 章希睿 桑茂栋 向兰茜 王 彦 林穆清 陈志杰 何绪金
0 引言
临床上常用的超声血流成像主要是彩色多普勒和脉冲多普勒,前者可以结合灰阶图像(B 图像)对血管做定性分析,后者主要做血流的定量测量并进行相应的临床诊断,二者对血流成像均存在一定角度依赖。传统多普勒还包括能量多普勒与连续多普勒,其特点是高速血流成像和定量测量时不会发生混叠[1],且能量多普勒的角度依赖性较小。
传统多普勒方法存在一定技术缺陷:首先,速度的直接测值是沿超声传播方向的速度分量,不是实际速度大小;其次,速度的实际方向无法直接得到,需要根据血管走势进行相应判断;如此,在做定量测量时需要角度校正,容易造成测量误差。再次,当血管结构较为复杂时,例如,颈动脉分叉等,无法判断血流的实际方向,也就意味着不能做角度校正,因此无法间接得到速度的实际大小[2]。再者,虽然连续多普勒可以克服混叠问题,但它无法对测量结果进行空间定位。
此外,彩色多普勒主要应用于定性分析,混叠对其进行临床诊断的影响不大。彩色多普勒成像效果的主要评价指标是灵敏度,它与自相关算法中的包大小(采样个数),也就是血流速度计算时采用的信号长度直接相关,还与脉冲重复频率(Pulse repetition frequency, PRF)以及所测血流速度的大小都有一定关系[2]。灵敏度过高会导致将组织移动识别为低速血流,出现血流溢出的现象;灵敏度太低则无法识别出低速血流。再者,灵敏度还与血流成像的壁滤波器及对应的截止频率有很大关系。
脉冲多普勒做定量测量时需要将采样门放置到血管中血流速度最大的位置进行测量。但在实际应用中,最大速度不一定始终在血管的中心位置,这使得脉冲多普勒采样门所放位置的血流速度很可能不是沿直径的最大速度[3],从而进一步影响血流速度定量测量的准确度。
以上总结了传统多普勒血流成像的几个弊端,包括速度大小和方向测量的技术局限、混叠问题、灵敏度问题和脉冲多普勒测量位置的选取问题。本文将阐述当前血管超声成像的多个高级功能,分析这些可用于解决或改进以上所述传统方法主要弊端的新技术,并结合临床应用进行一个综述性的总结。
1 高级功能及其技术特点
近年来,血管超声新技术发展迅速,传统多普勒的很多技术局限得以被克服。本段共分为3 节内容,重点阐述基于新技术的血管高级血流成像功能以及不同技术的优缺点。其中,第一部分着重介绍向量血流成像(Vector flow imaging, VFI)并结合文献阐述不同实现方式的特点,该技术解决了定量测量速度大小和方向的局限;第二部分全面介绍其他超声血流相关的新技术,阐述混叠、灵敏度和脉冲多普勒测量位置等问题对应的新技术解决方法;第三部分介绍血管弹性相关的测量分析新技术。
1.1 超声向量血流成像技术
为了解决传统多普勒只能测量超声传播方向速度分量的问题,近年来很多研究尝试了各种不同的方法,并试图直接测量出血流速度的实际大小和方向,即血流的向量速度,这种直接测量血流向量速度的方法可以统称为向量血流技术。早期的研究采用了散斑跟踪法,得到不受角度依赖的血流成像结果[4]。基于多角度结合多普勒的方法是最早的向量速度测量雏形[5],但当时的研究是基于多个单阵元探头实现的。交叉波束[6]和横向波振荡法(Transverse oscillation, TO)[7]实现了基于多阵元探头的向量血流成像,前者可以看作是多个角度的多普勒血流分别成像,通过不同角度的拟合重建得到向量速度;后者是通过不同角度的同时发射或不同孔径和变迹实现的不同接收角度,先制造出横向振荡的声场,从而计算得到血流的横向速度,然后再与传统多普勒得到的纵向速度合成向量速度。
随时间的发展,这两种方法有了更多的研究进展,其中TO经历了十几年不断的演化和发展[8−10],不仅实现了产品化,而且还开展了三维向量血流成像的深入研究[11−12],先后在32×32 阵元的面阵探头和行列寻址的面阵探头上实现了基于TO方法的三维超声向量血流成像。TO 方法的扫描方式可与传统彩色多普勒(彩超)十分相近。通过接收变迹处理实现横向振荡。TO 与彩超相比,除向量速度计算这一环节之外,仅波束合成有所不同。实现产品化对于系统软硬件的要求相比彩超并没有明显的提高。这种方法相当于兼顾了成本与技术创新,但其计算精度单指TO而言理论上并不具备非常大的可提升潜力,因为得到的回波信号始终与传统彩超几乎是相同的。虽然有研究结合定向波束合成[13]通过自校正提升了TO 的计算精度,但这种定向横向波振荡方法(Directional transverse oscillation, DTO)也使TO 波束合成的效率下降了90%以上[10]。而交叉波束法通过进一步的改进和演变,实现了基于平面波多角度发射接收组合的高帧率向量血流成像[14]。过往研究证实了由于向量速度可以基于多个不同角度的速度分量合成得到,计算精度可进一步的提升(角度越多,精度越高)[15],但同时也会消耗更多的软硬件资源,增加发生混叠的概率。高帧率向量血流结合新的动态显示方式,可以更加直观地显示出血流的流动效果[14]。该技术也实现了产品化[16−17],使高帧率动态向量血流成像走向临床[18−19]。下面具体阐述该技术的产品化应用特点。
高帧率动态向量血流成像(V Flow)作为一个血流成像的高级功能,可在迈瑞彩色多普勒超声诊断系统Resona 7 上使用。如前所述,该技术采用了多角度发射和接收,每个不同角度都可以得到一个对应的速度分量,通过角度拟合得到最终的向量速度[14,16]。相比传统的彩色多普勒和脉冲多普勒,V Flow 最大的技术特点是它可以直接测量血流速度在成像平面上的实际大小和方向。图1为一例颈动脉血流V Flow 与传统彩超的成像结果对比(图像通过Resona 7 采集得到)。其中,流入颈外动脉的血流和颈动脉窦的涡流(图1空心箭头所指),两处血流的流向彩超只能以不同颜色(红色)区分,而V Flow的向量箭头则更加清楚地显示出血流方向。其次,V Flow 采用了交替发射扫描技术[16,20]。其中,平面波发射使得显示帧率可达每秒数百帧;聚焦波发射确保了组织结构B图像的空间分辨率。动态血流结合B 图的连续显示方式[14,16,20−21],使其可以捕捉到毫秒级时间内的血流形态变化过程[19]。但由于每个角度的速度分量仍然是根据传统多普勒原理计算得到的,因此V Flow同样也会受到混叠的限制,可测量的最大速度与PRF 成正比、与探头的中心频率成反比,此外还与探头表面和实际速度方向的夹角有一定关系。可测量的最小速度一般用灵敏度来衡量,正如引言部分所述,它与PRF、包大小(采样个数)和壁滤波器有关。其中,采样个数与灵敏度成正比,当采样个数不变时PRF与灵敏度成反比,而壁滤波器在某种意义上对于灵敏度的影响最大。因为改变采样个数和PRF 虽然可以实现更低流速的测量,但同时也会引入组织运动。这种高灵敏度会对血流成像效果起到负面作用。下面将介绍一些其他超声血流相关的新技术,包括解决血流混叠问题的新方法、更高级的血流壁滤波器以及图像处理技术。
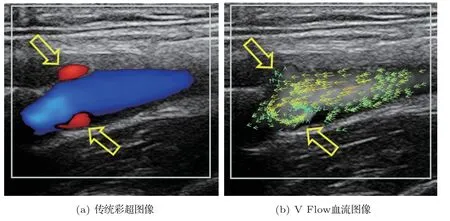
图1 正常成人颈动脉血流Fig.1 Carotid blood flow in a normal adult
1.2 超声血流新技术
对于高速血流,尤其是定量测量,混叠是当前最主要的一个问题。Muth等[22]通过图像后处理对彩超图像进行了去混叠,但混叠对于主要做定性分析的彩超实际上并没有太大影响。Posada 等[23]采用不同PRF交错发射,用于突破传统自相关法混叠的限制,实现更大的可测量速度。但混叠不仅与PRF和探头的中心频率相关,还受限于物理声速。后者一直以来可称之为一个无法逾越的鸿沟,然而在最新的研究中,Jensen[24−25]提出了一种组合方法,借助交替扫描结合互相关法(而不是传统的自相关法),使得最大可测量速度在PRF 为5~10 kHz时达到了3~7 m/s 甚至更高的可测范围。该技术的交替扫描使合成孔径成像(Synthetic aperture imaging, SAI)有效的PRF 比起传统SAI 提高了N倍,这里的N可看作一帧高空间分辨率SAI 图像的复合次数。但这种交替扫描还不能克服物理声速的限制,仍需平衡扫描深度与PRF的关系。互相关法真正打破了传统的混叠限制,更有效地实现了去混叠。该方法属于比较新的研究成果,产品化应用还需更多相关技术的积累和时间的沉淀。
传统多普勒超声血流成像的壁滤波常采用无限脉冲响应(Infinite impulse response, IIR)或有限脉冲响应(Finite impulse response, FIR)高通滤波器。为了更好地区分组织运动和低速血流,近年来许多研究采用了更高级的血流壁滤波器,例如,基于奇异值分解(Singular value decomposition, SVD)和低秩理论的壁滤波器[26−27]。这类新型壁滤波器可以较好地识别出微小血流,明显提升了血流的灵敏度,同时也需要非常大的运算量[28]。然而,对于慢速血流的探测,超声造影成像具体先天的优势。一方面其成像机制建立在微泡的强散射回波基础上,较其他血流成像手段具有更高信噪比的优势[29];另一方面就幅度成像方法论而言,超声造影主要采用脉冲反转(Pulse inversion, PI)、幅度调制(Amplitude modulation, AM)和幅度调制脉冲反转(Amplitude modulation pulse inversion, AMPI)等脉冲序列技术来提取微泡信号的幅度信息,并最终用于成像[30−31]。所谓的幅度成像方法论,就是仅仅基于回波的幅度信息进行成像,无需借助频移、相位等与速度相关的物理量。由此可见,造影是一种唯幅度域的成像模式,因而对血流速度几无要求,可以观察到极慢速甚至几乎静止的血流。而基于高级壁滤波器的血流成像,有研究称其最小可识别的血流速度在每秒毫米级水平[26]。
血流可通过传统多普勒、向量血流、造影等技术进行定性和定量的分析与测量。在最新的彩色多普勒成像中,还引入了立体血流显示,该技术是一种新的血流图像处理技术。它通过滤镜使血流图像产生立体光照效果,从而更清晰地显示出流速差异。这种情况下,用户可以更加准确直观地判断出最高流速的位置(如图2(b)空心箭头所示),从而可以解决脉冲多普勒测量位置的选取问题(如图2(c)空心箭头所示),提高脉冲多普勒定量测量的准确性和可重复性。

图2 血流速度的定量测量Fig.2 The quantitative measurement for blood flow velocities
1.3 血管弹性新技术
血流与血管之间存在千丝万缕的微妙关系。血管发生病变(例如,动脉粥样硬化)会导致血流动力学的改变,而异常的血流动力学也会使血管结构逐渐发生一些变化[32]。前面两节主要介绍和论述了血流测量的新技术,而血管也可以借助一些其他高级成像模式进行相关的测量和疾病的诊断,例如,颈动脉可以通过检测血管壁内中膜厚度(Intimamedia thickness, IMT)实现病变程度的诊断[33],还可通过弹性成像(Elastograhy,包括剪切波弹性和应变弹性)评估动脉粥样硬化、测量斑块的硬度、分析斑块的成分和检测易损斑块[34−37]。IMT是较为成熟的测量技术,而剪切波弹性血管临床应用还存在一定局限。因为不同厂家超声仪器的测值可能存在一定差异,且目前还没有基于弹性成像建立起来的关于斑块诊断的量化阈值[34]。此外,斑块随动脉壁的搏动是否影响剪切波的测值,较小的斑块剪切波成像的空间分辨率能否满足要求,都有待进一步的验证和深入研究。另外,应变弹性在一些基础研究中已被证实,可以有效分析颈动脉斑块的特点,并与磁共振成像(Magnetic resonance imaging, MRI)结果进行了对比验证[36−37]。但与MRI 相比,超声弹性成像仍受限于2D 图像的精度,难以全面的考虑到整个斑块以及三维每个方向上的应变。根据脉搏波成像和脉搏波传导速度(Pulse wave velocity,PWV)判断血管壁的硬度[38],是目前动脉粥样硬化临床诊断与研究的主流方法。该技术根据血管内径和血压变化测量间接推导出脉搏波的传导速度[39],而该速度值与动脉壁的硬度是正相关的,即,速度值越高表示动脉硬化程度也越高[40]。PWV 广泛应用于血管弹性相关的临床研究和辅助诊断。但目前基于超声成像系统的PWV商用测量功能并不多见。
2 高级功能的临床应用
超声向量血流成像技术已经广泛地应用在临床研究中,应用范围涵盖了颈动脉、动静脉瘘、心脏、腹部等主要血管中的血流测量与临床分析[19,41−46]。以迈瑞V Flow 为例,Goddi 等[41]分别采用了传统彩超、脉冲多普勒和V Flow成像对颈动脉分叉进行临床研究(图3[41])。其中,颈动脉窦部的非层流血流(包括涡流等复杂血流形态),只有在V Flow 模式下才能直观且清楚地显示出来。此外,Goddi 等[19]还对60 个健康人的颈动脉分叉分别做了V Flow 和传统彩超的超声检查,并做了相应的定性与定量的分析和对比。结果显示:比起传统彩超,V Flow 可以得到更大的复杂血流面积(V Flow:45.5 mm2,彩超:29.5 mm2)以及更长的湍流时间(V Flow:380 ms,彩超:352.5 ms)。Meyer等[46]通过V Flow 研究颈动脉分叉的返流情况,在25 个颈动脉分叉中,发现了13 个存在血液从颈外动脉向颈内动脉返流的现象(图4[46])。其中,较长的返流可能导致斑块栓子由颈外动脉流入颈内动脉[46]。这种现象以往通过传统多普勒成像是很难直接观察到的。
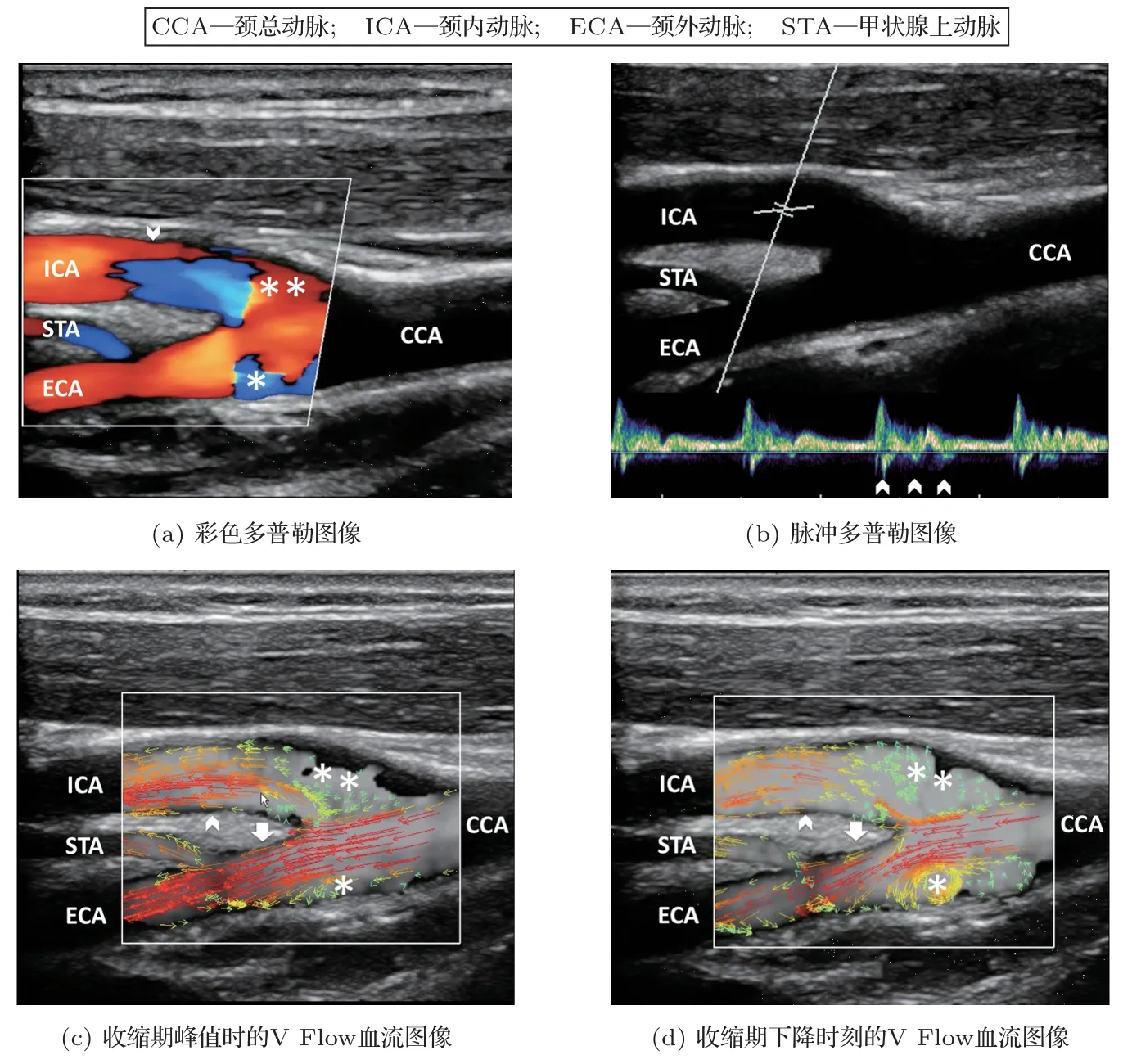
图3 颈动脉分叉处基于不同技术的多普勒超声血流图像[41]Fig.3 Ultrasound flow images for the carotid bifurcation based on different Doppler techniques[41]
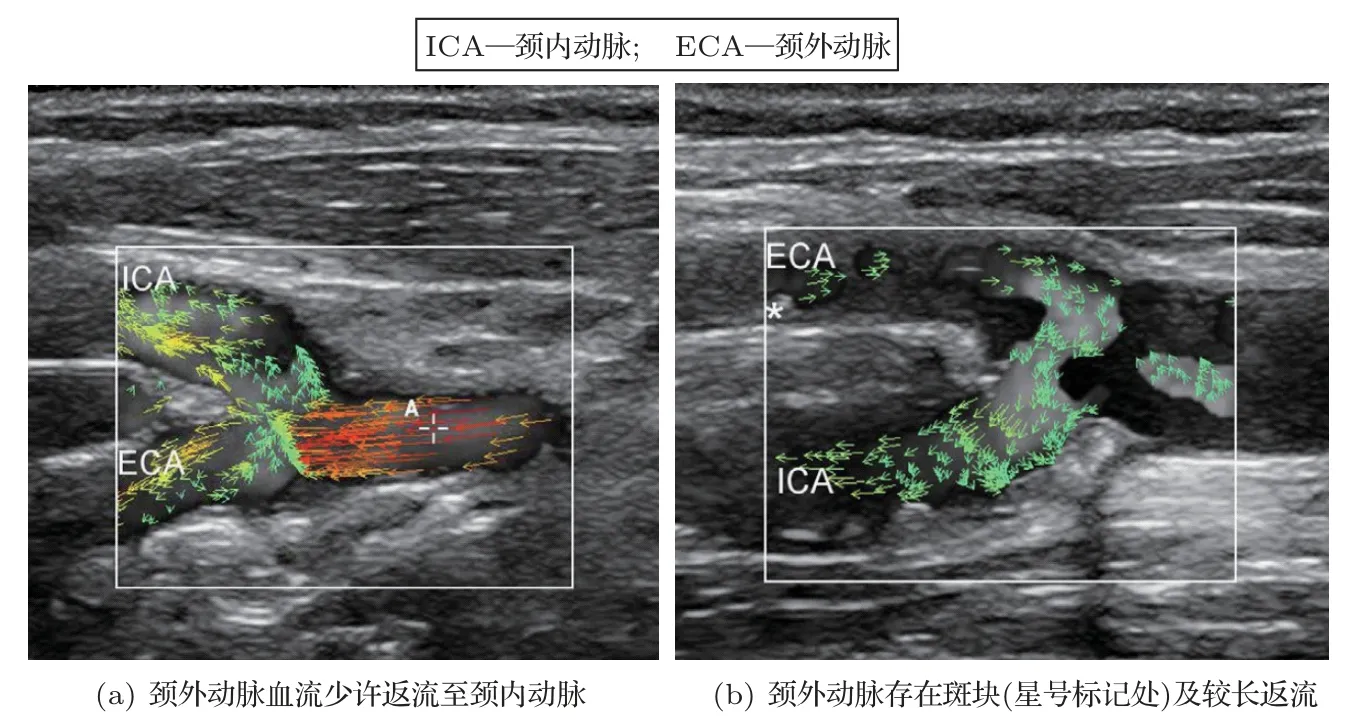
图4 血流由颈外动脉流向颈内动脉的两个临床实例[46]Fig.4 Two clinical examples for the blood flow reversal from the external carotid artery into the internal carotid artery[46]
V Flow 与基于TO 的向量血流成像都已经应用到动静脉瘘的超声临床研究[42−43]。然而,比起颈动脉分叉,动静脉瘘附近的血流形态更加复杂。多数动静脉瘘与周围的动脉和静脉都不在同一平面上,这给超声检查带来了巨大的挑战。此外,有些狭窄的动静脉瘘会导致附近的血流速度升高,有时可达4 m/s 以上,这会造成向量血流的速度测值发生混叠,影响最终的测量结果。总之,向量血流对于动静脉瘘的临床研究还存在一定缺陷且有很多需要改进的地方,例如,提高最大可测量速度和实现三维的向量血流成像及速度测量。
除了实现高速血流的测量,低速血流同样对于临床诊断也有着很大意义。有研究指出,斑块内新生血管可通过超声造影成像进行有效识别[47−48],这对判断和分析斑块的类型和特点有一定帮助[47]。通过超声造影技术评估斑块内新生血管中不同时刻微泡的大小,可了解颈动脉斑块组织学特点,进而区分未破裂的、破裂的以及愈合的斑块[48]。此外,超声造影成像配合常规的B 图像还可以更加精确地检测到斑块的大小和位置[49],但该研究也指出需要制定相应的分级标准才能有效地提高检查的可靠性并减少技术的异质性。再者,注射造影剂不仅麻烦还有可能存在一定风险。近年来,新技术超微血流成像发展的非常迅猛,它最主要的一个特点就是利用了新型的壁滤波器(如1.2 节所述)。有研究将其与造影在斑块内新生血管的研究中做了对比分析[50],发现超微血流和造影显示存在局限性极低回声区的斑块内均可见新生血管。此外,超微血流还适合应用在肾动脉等低速血流且血管较细需要高灵敏度血流成像的检查部位[51]。如果能够结合立体血流显示,肾动脉各级分支,包括段动脉、叶间动脉、弓形动脉等血管结构还可以更加清晰、生动且更有层次感地展现出来(图5)。
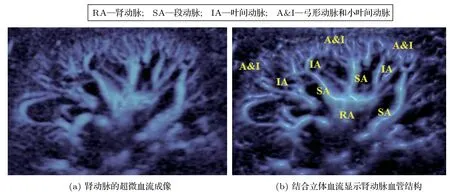
图5 正常成人肾脏血流图像Fig.5 Blood flow image in kidney for a healthy adult
眼部血管不但血流较细,还需要更低的超声发射能量。目前已有利用传统彩色多普勒进行的眼部血管的血流动力学研究[52],还有针对眼部扫描的声输出安全标准,通过最小方差的合成孔径方法实现的高质量眼部超声成像[53]。超微血流以其高灵敏度和高信噪比为主要优势,如果可以将更加严格的眼部扫描安全标准考虑进去,那么超微血流很可能更加适合应用到眼部血流的超声检查。
3 总结与展望
超声血流成像技术经过几十年的发展,传统多普勒已非常成熟并且广泛应用在日常的超声检查和诊断中。基于此,虽然已有很多指南和诊断标准陆续建立起来[54−55],但传统方法仍然存在很多难以避免的弊端和局限。本文介绍了多个血管和血流超声成像的高级功能,它们可以解决当前遇到的各种不同问题。文中展示的超声血流图像都是通过迈瑞彩色多普勒超声系统Resona 7 得到的,该系统同时提供了多个血管和血流相关的高级功能,包括向量血流V Flow、造影成像、弹性成像、立体血流、超微血流、内中膜厚度及脉搏波速度的测量等,均可在同一台商用机上完成超声检查。血管超声的高级功能为实现无角度依赖和高灵敏度的血流成像、精确的血流定量测量以及结合多参数的医学诊断提供了更加完备的解决方案。图6总结了不同技术在血管超声中的临床应用场景及其限制,描绘了血管超声高级功能的临床应用价值。血管高级功能作为针对不同限制对应的解决方法可以看出,向量血流、弹性、IMT 和PWV 均可提供不一样的血流动力学参数和血管弹性指标的定量测量。而立体显示、超声造影和超微血流则进一步成就了血流测量精度的提升和高灵敏度的精细显示。精准定量是未来血管超声发展的主要方向。为了得到更加完整的血管和血流信息,面阵探头也是非常有必要使用的。因为实现流入和流出二维成像平面血流的测量是保证最终计算结果精度的基础。
混叠始终是血流成像中最难解决的问题。正如图6所示,颈动脉分叉处斑块可致颈内动脉重度狭窄,并产生高速血流(峰值流速可达2~3 m/s 以上)。脉冲多普勒和向量血流成像,作为血流定量测量技术,需尽可能避免混叠的发生。前文介绍的几种方法,在一定程度上确实可以破除混叠的限制。针对成人心脏的超声扫描,在极端情况下,15 cm的扫描深度(整个心脏)以及7 m/s的最大检测速度(射流)当前只能采用连续多普勒[25]。而交替扫描结合互相关的新方法[24−25]则使这种具有位置信息的高穿透力心脏高速血流的测量成为可能。然而,新技术的应用范围还需要进一步探讨。虽然交替扫描确实可以应用到不同的向量血流成像中(例如TO 和DTO)[24],但对于脉冲多普勒和向量血流成像,如何打破声速的限制,如何结合互相关法和变PRF 发射实现这两种血流速度定量测量的去混叠,未来仍需做进一步的研究与探索。
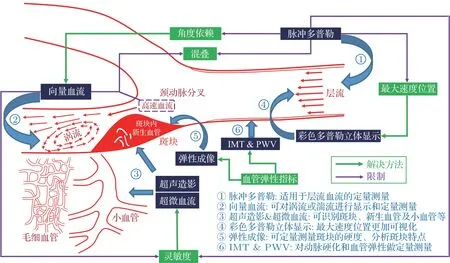
图6 不同临床应用场景下的血管超声技术解决方法Fig.6 Vascular ultrasound solution for different clinical applications
