昆虫多巴胺及其受体的研究进展及展望
2020-03-03叶恭银
徐 刚, 叶恭银
(1. 扬州大学园艺与植物保护学院, 江苏扬州 225009; 2. 浙江大学昆虫科学研究所, 水稻生物学国家重点实验室/ 农业农村部作物病虫分子生物学重点实验室, 杭州 310058)
在脊椎动物和无脊椎动物中,多巴胺(dopamine, DA)是一种重要的儿茶酚胺神经递质(catecholamine neurotransmitter)。在哺乳动物中,DA与多种神经性疾病有关,如帕金森综合症(Parkinson’s disease)、精神分裂症(schizophrenia)、阿尔茨海默氏症(Alzheimer’s disease)以及药物成瘾(drug addiction)等(Kleinetal., 2019)。在昆虫中,DA参与调控取食(feeding)、学习(learning)、记忆和遗忘(memory and forgetting)、求偶与交配(courtship and copulation)、睡眠与觉醒(sleep and arousal)和相变(phase change)等多种行为(Verlinden, 2018)。
1957年,Kathleen Montagu通过纸色谱分析法在人的大脑中首次鉴定到了DA,之所以命名为多巴胺,是因为它是单胺(monoamine),且合成前体为左旋多巴;1958年,Arvid Carlsson和Nils-Åke Hillarp在瑞典国家心脏研究所的化学药理学实验室首次确定了多巴胺具有神经递质的功能(Benes, 2001)。Arvid Carlsson在2000年被授予诺贝尔生理学或医学奖,因其证实了DA不仅是去肾上腺素(norepinephrine)和肾上腺素(epinephrine)的合成前体,其本身也是一种神经递质。
在生物中,DA在多巴胺神经元(dopaminergic neurons, DANs)中合成,并释放到突触间隙,通过特异性地激活位于突触后膜上的多巴胺受体(dopamine receptors, DARs)来发挥作用(Verlinden, 2018)。基于结构、药理学和生化特性,脊椎动物有两大类DARs,即D1-like DARs和D2-like DARs;其中D1-like DARs包含D1和D5受体,它们被激活后,偶联Gs型蛋白,引起胞内环腺苷酸(cyclic adenosine monophosphate, cAMP)含量的升高;D2-like DARs包含3种DARs,即D2, D3和D4,它们被激活后偶联Gi型蛋白,导致胞内cAMP含量的降低(Beaulieu and Gainetdinov, 2011)。在昆虫中,至今为止有4种DARs被克隆得到,参照脊椎动物DARs的分类方法,昆虫DARs可分为D1-like DARs, D2-like DARs和多巴胺/蜕皮激素受体(dopamine/ecdysteroid receptor, DopEcR)(Srivastavaetal., 2005; Verlinden, 2018);其中D1-like DARs包含两种亚型即DOP1和DOP2,D2-like DARs只有一种亚型DOP3,而DopEcR可以同时被DA和蜕皮激素激活。近年来,随着组学技术的快速发展,以及CRISPR/Cas9技术已经在多种昆虫中被成功地应用(Sunetal., 2017; Taningetal., 2017; Pietrantonioetal., 2018),这些都将推动DA在昆虫中生理功能与行为调控的研究以及昆虫DARs的药理学与生理学研究等。尤其在模式昆虫黑腹果蝇Drosophilamelanogaster中,借助丰富的遗传学操作手段有大量DA的相关研究(Karametal., 2019)。本文结合DA最新的研究进展,主要从昆虫中DA的调控,多巴胺神经元,以及DARs的信号转导、进化、药理学特性与生理学功能等方面进行综述。
1 DA的调控
1.1 DA的合成、转运和降解
DA作为神经递质,在生物中的浓度是被严格调控的,首要手段是控制其合成速率。昆虫生物胺中,DA、章鱼胺(octopamine, OA)和酪胺(tyramine, TA)的合成底物均为酪氨酸(tyrosine),是含有邻苯二酚的胺类产物,因此又可称为儿茶酚胺(catecholamine)(吴顺凡等, 2013)。酪氨酸在酪氨酸羟化酶(tyrosine hydroxylase, TH)作用下生成左旋多巴(L-3,4-dihydroxyphenylalanine, L-DOPA),TH是DA合成的限速酶,L-DOPA在多巴脱羧酶(DOPA decarboxylase, DDC)的作用下生成DA(Nohetal., 2016b)(图1)。

图1 昆虫中DA的合成和降解 (改自吴顺凡等, 2013)
DA一旦合成后,在囊泡单胺转运体(vesicular monoamine transporter, VMAT)的作用下,从细胞胞质(cytoplasm)转运到突触囊泡(synaptic vesicles)储存(Yaffeetal., 2018)。DA先被储存在囊泡内,直至动作电位(action potential)触发囊泡与细胞膜融合继而通过胞吐作用(exocytosis)将DA从突触前末梢(presynaptic terminal)泵出到突触间隙(synaptic cleft)(Gainetdinovetal., 2018)。一旦被释放到突触间隙,DA便会特异性地结合位于突触后细胞(postsynaptic cell)膜上的DARs,引起信号从突触前细胞传播到突触后的神经元中,引起下游的生理反应,这个过程是相当短暂的;位于突触前末梢质膜上的多巴胺转运体(dopamine transporter, DAT)将突触间隙的DA再吸收(reuptake)到突触前细胞内,可以终止其过度反应(Wangetal., 2015)。当DA被转运到突触前细胞的胞质后,便会被VMAT重新组装到囊泡中储存(Lawal and Krantz, 2013)。
在脊椎动物中,DA的降解主要是3种酶的作用,单胺氧化酶(monoamine oxidase, MAO)、乙醛脱氢酶(aldehyde dehydrogenase, ALDH)和儿茶酚胺-氧位-甲基转移酶(catechol-O-methyl transferase, COMT)。在脊椎动物中,DA在MAO的脱氨基作用下生成3,4-二羟基苯乙醛(3,4-dihydroxyphenylacetaldehyde, DOPAL),ALDH催化DOPAL生成3,4-二羟基苯乙酸(3,4-dihydroxyphenylacetic acid, DOPAC),进一步在COMT的作用下氧位甲基化生成高香草酸(homovanillic acid)(Eisenhoferetal., 2004)。在无脊椎动物中,还未克隆到MAO(Kutchko and Siltberg-Liberles, 2013)。昆虫DA的降解主要依赖于N-β-丙氨酰化、N-乙酰化和氧化脱氨基作用等酶解途径。DA在N-β-丙氨酰多巴胺合成酶(NBAD synthetase, ebony)的催化作用下生成N-β-丙氨酰多巴胺(N-β-alanyl dopamine, NBAD),但这个过程是可逆的,NBAD可以在N-β-丙氨酰多巴胺水解酶(NBAD hydrolase, tan)作用下重新生成DA(Nohetal., 2016b; Rebeiz and Williams, 2017)。DA也可在芳香烷基胺-N-乙酰转移酶(arylalkylamine N-acetyltransferases, aaNATs)催化下生成N-乙酰多巴胺(N-acetyl dopamine, NADA)(Nohetal., 2016b)(图1)。另外,DA也能被漆酶2(laccase2)氧化成多巴胺醌(dopaminequinone)进行降解(Nohetal., 2016b)(图1)。
1.2 DA代谢酶和转运体的生理作用
TH和DDC是DA合成过程中的两个重要酶,已在多种昆虫中被克隆分析。TH被发现参与调控表皮的硬化(sclerotization)与着色(pigmentation)(Liuetal., 2015; Pentzoldetal., 2018; Zhang HHetal., 2019; Zhang Yetal., 2019)、翅鳞的颜色(Matsuoka and Monteiro, 2018)、蛹的鞣化(tanning)和免疫能力(Qiaoetal., 2016; Chenetal., 2018)等;另外,通过CRISPR/Cas9将TH基因敲除可引起幼虫致死(Yangetal., 2018)。DDC参与调控表皮的鞣化(Sterkeletal., 2019)、翅斑的形成(Luetal., 2019)、蛹的黑化(melanization)和翅鳞的颜色(Matsuoka and Monteiro, 2018)等。
ebony将DA降解成NBAD,而tan可将NBAD重新生成DA。ebony参与调控昆虫翅斑的颜色(Perezetal., 2018)、蛹壳的黑化(Bietal., 2019)和胸腹的着色(Johnsonetal., 2015; Miyagietal., 2015; Signoretal., 2016; Telonis-Scott and Hoffmann, 2018)等。tan调控雌性颜色的二型(dimorphism)(Yassinetal., 2016)以及胸腹着色的可塑性(Gibertetal., 2016; De Castroetal., 2018; Endleretal., 2018)等。
aaNATs催化DA降解成NADA,在昆虫中参与调控表皮硬化(Mehereetal., 2011; Longetal., 2015)、着色(Zhanetal., 2010; Nohetal., 2016a)、颜色图案(Daietal., 2010; Matsuoka and Monteiro, 2018)以及脂肪酸酰胺的合成(Andersonetal., 2018; O′Flynnetal., 2018b)等。Laccase2是一类酚氧化酶(phenoloxidase, PO)基因,可以催化DA降解成醌类物质;在西方蜜蜂Apismellifera中,蜕皮激素能调控laccase2的表达,而Laccase2参与蜜蜂成虫外骨骼的分化(Elias-Netoetal., 2010);在白纹伊蚊Aedesalbopictus中,Laccase2参与调控其卵壳的硬化和着色(Wu XSetal., 2013);在中华按蚊Anophelessinensis的化蛹过程中抑制Laccase2的表达,严重损害了其表皮鞣化和对病原物的抗性(Duetal., 2017)。
DAT和VMAT都是具有12个跨膜结构域的跨膜蛋白,DAT将DA从突触间隙再吸收,而VMAT可将DA转运到囊泡中储存。DAT是精神类药物安非他命(amphetamine)的作用靶标(Pizzoetal., 2014),DAT也参与调控昆虫的运动和睡眠等(Uenoetal., 2012; Hamiltonetal., 2013)。VMAT的果蝇突变体表现出睡眠上升的表型,抗生素类药物利福平(reserpine)是VMAT的小分子抑制剂,也可以导致睡眠的上升(Nall and Sehgal, 2013);VMAT还参与调控运动和求偶等(Freybergetal., 2016; Martin and Krantz, 2014)。
2 多巴胺神经元
DA在多巴胺神经元(DANs)中合成和释放。在果蝇的脑中,大概有300个DANs,至少可以分成13个簇(Asoetal., 2014)。在果蝇研究中,可以利用各种GAL4驱动子去驱动果蝇脑中不同类型的DANs,从而明确不同DANs的功能(Xieetal., 2018)。DANs属于调节输入型神经元(modulatory input neurons),其中有两个重要的多巴胺神经元簇,即protocerebral anterior medial (PAM)和protocerebral posterior lateral 1(PPL1)(表1)。PAM和PPL1将轴突末梢投射到蘑菇体(mushroom body, MB)的特定区域,传递奖赏和惩罚等信号到MB引导学习(Asoetal., 2014)。PPL1簇的每种DANs有1或2个细胞,而PAM簇的不同类型DANs最多有大概20个细胞(Asoetal., 2014)。不同类型的DANs参与调控不同的生理与行为过程,如PAM-γ5调控求偶学习(Kelemanetal., 2012)、PAM-γ3调控糖奖赏(Yamagataetal., 2016)、PAM-β’1调控遗忘(Shuaietal., 2015)、PPL1-γ1pedc调控厌恶记忆和长期记忆(Placaisetal., 2017; Kimetal., 2018)、PPL1-α’2α2调控嗅觉学习(Cervantes-Sandovaletal., 2017)等。
3 多巴胺受体
DA是通过特异性地结合其相关的多巴胺受体(dopamine receptors, DARs)来发挥生理作用,DARs属于G蛋白偶联受体(G protein-coupled receptors, GPCRs)中类视紫红质(rhodopsin-like)家族,具有七跨膜的典型结构域(Venkatakrishnanetal., 2013)。参照脊椎动物体内DARs的分类方法(Beaulieu and Gainetdinov, 2011),以及昆虫DARs的研究进展(Srivastavaetal., 2005),昆虫中的DARs可被分为D1-like DARs, D2-like DARs和DopEcR。其中D1-like DARs包含两种亚型即DOP1和DOP2,D2-like DARs只有一种亚型DOP3;DOP2被认为是无脊椎动物特有的DARs,又被称为无脊椎动物型多巴胺受体(invertebrate-type dopamine receptor, INDR)(Verlinden, 2018)。
3.1 DARs的进化分析
从系统发育上看,昆虫DOP1的同源受体与脊椎动物的D1和D5受体聚在一起,组成了D1-likeDARs的分支,与其他DARs相比,D1-like DARs与章鱼胺受体(β-adrenergic-like octopamine receptors,OA2)在进化关系上更加靠近(图2),这两类受体均偶联Gs蛋白,引起cAMP上升。昆虫无脊椎动物型多巴胺受体DOP2与章鱼胺受体(α1-adrenergic-like octopamine receptors, OA1)在进化上靠近(图2),且均能偶联Gs和Gq蛋白,引起cAMP和Ca2+浓度的上升。昆虫DOP3的同源受体与脊椎动物的D2, D3和D4受体组成了D2-like DARs的分支,并与酪胺受体(tyramine receptor, TA1)和章鱼胺受体(α2-adrenergic-like octopamine receptors, OA3)的分支更加近缘(图2),它们均偶联Gi蛋白,导致cAMP下降。DopEcR偶联Gs蛋白,且DA引起的cAMP上升可以被蜕皮激素E和20E抑制,在进化关系上与其他受体均较远(图2)。之前有研究提出设想,在生物胺GPCRs的进化过程中,新进化的受体需要新的配体;由于结构的限制,一种获得配体的方式是从相近的系统中“借”,这就引起了在受体家族间所谓的“ligand-hops”(Hauseretal., 2006; Beggsetal., 2011; Troppmannetal., 2014)。
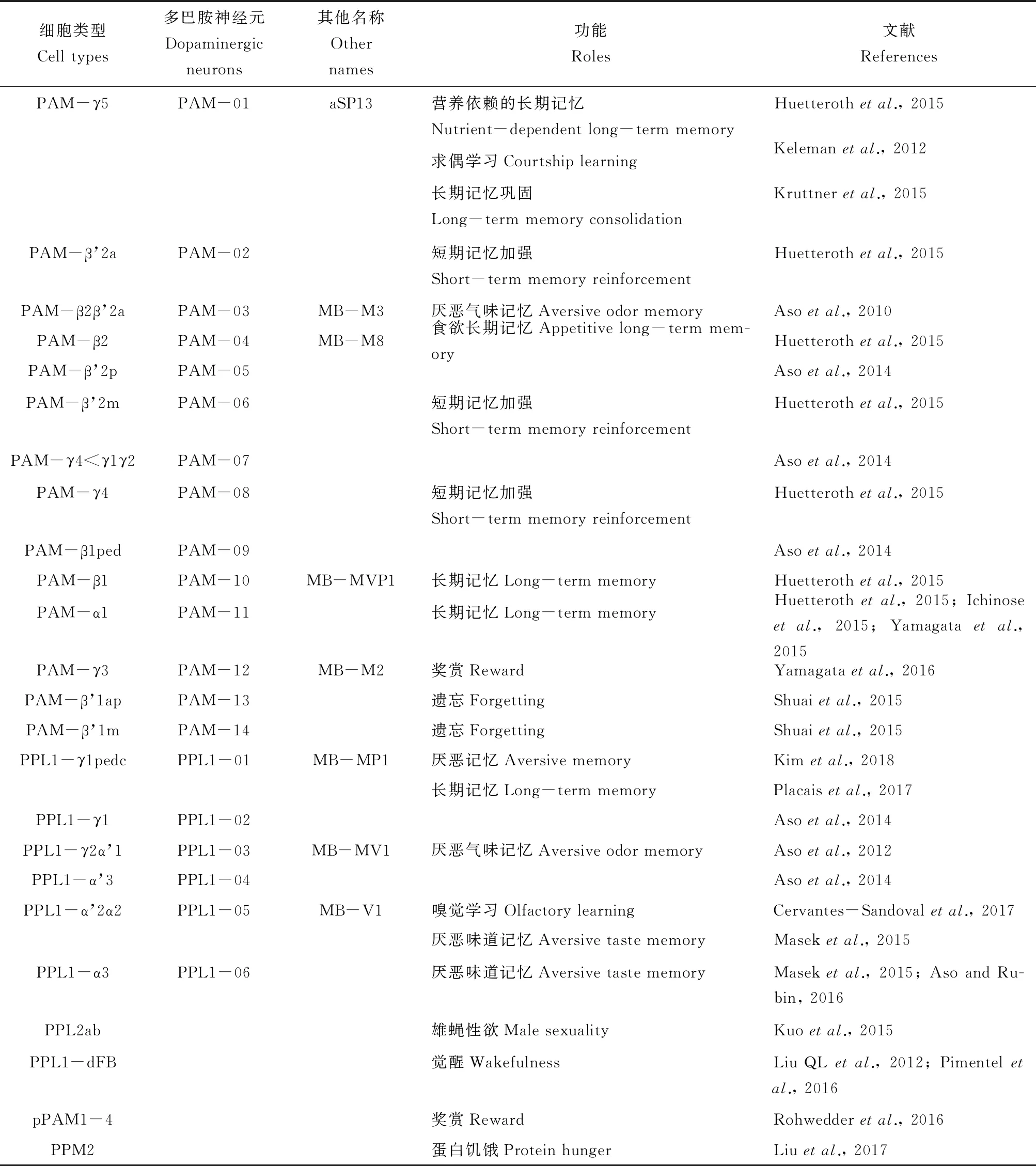
表1 果蝇多巴胺神经元及其功能
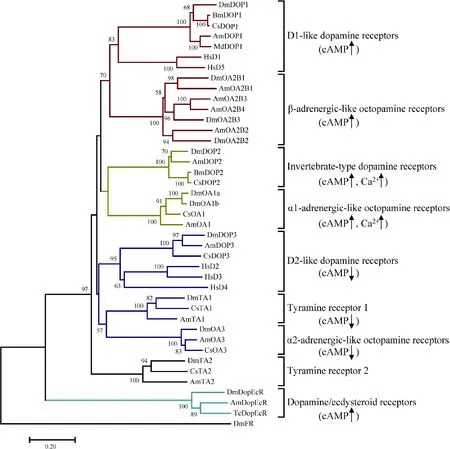
图2 昆虫3种生物胺受体的系统进化分析
3.2 DARs的信号转导
与脊椎动物的D1-like DARs一样,昆虫中的D1-like DARs和DopEcR被激活后,偶联Gs蛋白,活化的Gαs亚基与质膜上的腺苷酸环化酶(adenylyl cyclase, AC)相互作用,引起AC活性的上升,导致ATP生成cAMP(图3)。cAMP浓度的上升随后能激活cAMP依赖性蛋白激酶(cAMP-dependent protein kinase),又叫蛋白激酶A(protein kinase A, PKA)。PKA将丝氨酸或苏氨酸残基磷酸化,改变了各种底物分子的特性,包括细胞溶质蛋白、配体门控离子通道和电压门控离子通道等(Blenau and Baumann, 2001)。与脊椎动物的D2-like DARs一样,昆虫的DOP3被激活后,偶联Gi蛋白,活化的Gαi亚基与AC相互作用,抑制了AC的活性,从而引起胞内cAMP含量的降低(图3)。另外,与偶联Gs蛋白相比,D1-like DARs中的DOP2受到低浓度的DA刺激时,主要是偶联Gq蛋白,活化的Gαq亚基可以结合并刺激磷脂酶C(phospholipase C, PLC)的活性,引起胞内Ca2+浓度的上升(Himmelreichetal., 2017)。PLC可以水解一种膜结合底物-磷脂酰肌醇二磷酸(phosphatidylinositol 4,5-bisphosphate, PIP2),生成2种第二信使,即三磷酸肌醇(inositol 1,4,5-trisphosphate, IP3)和二酰基甘油(diacylglycerol, DAG)。IP3可以自由地扩散并结合位于内质网(endoplasmic reticulum, ER)膜上特异的IP3受体,它们是第二信使门控Ca2+通道(图3)。当IP3结合到这些受体上之后,离子通道孔被打开,Ca2+释放到细胞质中,Ca2+可以通过控制酶或离子通道的活性在许多细胞功能调控中发挥关键的作用。与IP3相比,DAG仍与膜结合,可以激活蛋白激酶C(protein kinase C, PKC)。与PKA一样,PKC也可以磷酸化蛋白的丝氨酸和苏氨酸残基,从而改变这些蛋白的功能(Blenau and Baumann, 2001)。DopEcR除了可以被DA刺激引起cAMP上升,激活磷脂酰肌醇3-激酶(phosphoinositide 3-kinase, PI3K)通路,其被DA诱导的cAMP反应也可被蜕皮激素(ecdysone, E)和20-羟基蜕皮激素(20-hydroxyecdysone, 20E)抑制(图3),导致丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)通路的快速激活(Srivastavaetal., 2005; Evansetal., 2014)。
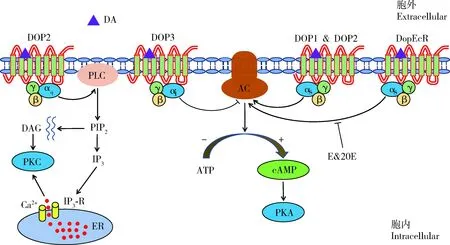
图3 昆虫多巴胺受体的信号转导途径 (改自吴顺凡等, 2013)
3.3 DARs的药理学特性
DARs的药理学研究主要是构建DARs的真核表达载体将其在HEK-293, CHO和Sf9等细胞系中表达,利用配体结合试验来研究DARs的药理学特性。对昆虫DARs药理学特性的研究,将为以昆虫DARs为作用靶标开发高效选择性杀虫剂提供重要依据。本文整理了目前已发表的昆虫DARs的药理学数据(表2)。
3.3.1激动剂:昆虫DOP1, DOP2和DOP3均能被DA能很好地激活,但对DA的敏感度不同,DOP1被DA诱导cAMP反应的EC50值属于纳摩尔(nmol/L)级别,而DOP2和DOP3属于微摩尔(μmol/L)级别(Verlindenetal., 2015; Xuetal., 2017);而DopEcR是在forskolin处理下, 被DA激活(Srivastavaetal.,2005)。DOP1, DOP2和DOP3均能被激动剂6,7-ADTN激活,其EC50值在微摩尔左右(Verlinden, 2018)。Bromocriptine被认为是DOP3的强效激动剂,在DmDOP3和CsDOP3中cAMP反应的EC50值均能达到纳摩尔(nmol/L)级别;bromocriptine也可激活DOP1受体,但对DOP2受体没有激动效应(Ohtaetal., 2009; Troppmannetal., 2014; Xuetal., 2017)。肾上腺素受体的激动剂epinephrine和norepinephrine对DOP1, DOP2和DOP3均存在激动活性(Hearnetal., 2002; Meyeretal., 2012; Nussetal., 2015)。蜜蜂蜂王信息素(queen mandibular pheromone, QMP)的关键组分高香草醇(homovanillyl alcohol, HVA)可以选择性地激活AmDOP3,对AmDOP1和AmDOP2均没有效果(Beggs and Mercer, 2009)。有趣的是,赤拟谷盗Triboliumcastaneum的TcDOP3受体可以被保幼激素(juvenile hormone, JH)激活,且JH诱导的cAMP反应的EC50值比DA更低(Bai and Palli, 2016);另外,TcDOP3也可以被高浓度酪胺和5-羟色胺激活(Hearnetal., 2002; Verlindenetal., 2015)。

表2 昆虫多巴胺受体的药理学特性
续表2 Table 2 continued

受体ReceptorsGenBank登录号GenBankaccession no.信号转导/表达细胞系Signal transduction/Expression cell lines激动剂AgonistsEC50(μmol/L)拮抗剂AntagonistsIC50(μmol/L)文献References致倦库蚊Culex quinquefasciatusCqDOP2KM262648Gs, cAMP↗DA2.1Asenapine0.0008Nuss et al., 2015Gq, Ca2+↗Epinephrine80.8Flupenthixol0.002HEK-293Norepinephrine52.2Amitriptyline0.0033Chlorpromazine0.0074Doxepin0.0083Butaclamol0.172Amperozide0.248SCH 233900.745二化螟Chilo suppressalisCsDOP1KP784317Gs, cAMP↗DA0.00195SCH 233900.0073Xu et al., 2017HEK-293Bromocriptine0.0404Butaclamol0.257Chlorpromazine0.467Flupenthixol0.475Phentolamine0.705Propranolol2.673CsDOP2KP784318Gs, cAMP↗DA7.248Xu et al., 2017HEK-2936,7-ADTN6.024CsDOP3KP784319Gi, cAMP↘DA1.178Xu et al., 2017HEK-293Bromocriptine0.00082黑腹果蝇Drosophila melanogasterDmDOP1P41596.2Gs, cAMP↗DA0.3Gotzes et al., 1994;Sf96,7-ADTN0.5Sugamori et al., 1995HEK-293Norepinephrine7DmDOP2NP_733299.1Gs, cAMP↗DA0.35Han et al., 1996Gq, Ca2+↗S2DmDOP3AAN15955.1Gi, cAMP↘DA0.5Hearn et al., 2002HEK-293Bromocriptine0.0015Serotonin1.3Tyramine3.8Epinephrine2.1Norepinephrine2.2DmDopEcRAAF47893.1Gs, cAMP↗DA0.0066Ecdysone (E)0.00015Srivastava et al., 2005Sf920E0.0015PoA0.000012美洲大蠊Periplaneta americanaPaDOP2HG794355Gs, cAMP↗DA0.1633Chlorpromazine0.0027Troppmann et al., 2014HEK-2936,7-ADTN0.0764Flupenthixol0.00656-Chloro-APB0.3819Butaclamol0.326SCH 233901.786赤拟谷盗Tribolium castaneumTcDOP3EFA02832.1Gq, Ca2+↗DA0.64Verlinden et al., 2015Gi, cAMP↘6,7-ADTN2.8CHOBromocriptine1.2HEK-293Tyramine60.4DA (cAMP)6
上箭头和下箭头分别表示浓度上升和下降。The upward arrow and downward arrow indicate increase and decrease in concentration, respectively.
3.3.2拮抗剂:SCH 23390被认为是D1-like DARs的选择性拮抗剂,SCH 23390对蚊子DOP2受体(AaDOP2和CqDOP2)的抑制效应只是人类的D1(HsD1)受体的0.2%(Nussetal., 2015);另外,高浓度的SCH 23390可以抑制DOP3的激活(Xuetal., 2017)。Flupentixol被认为可以抑制哺乳动物的DARs、5-羟色胺受体、肾上腺素受体和组胺受体,对昆虫DOP1, DOP2, DOP3和DopEcR也均有抑制效应,但对DOP2的拮抗效果可达到纳摩尔(nmol/L)级别(Mustardetal., 2003; Troppmannetal., 2014; Nussetal., 2015)。Butaclamol也可以拮抗4种DARs(Verlinden, 2018)。Chlorpromazine和chlorprothixene是结构上相近的拮抗剂,对DOP1, DOP2和DOP3均有抑制效果,且对DOP2的拮抗效应更好(Troppmannetal., 2014; Nussetal., 2015)。Methiothepin是哺乳动物和昆虫5-羟色胺受体非选择性的拮抗剂(Qietal., 2017),但同时对DOP2也有很好的拮抗效应(Hilletal., 2016)。另外,Amitriptyline, asenapine和doxepin是蚊子DOP2受体(AaDOP2和CqDOP2)的强效拮抗剂,均达到纳摩尔级别,但对HsD1受体只有较弱的效应(Nussetal., 2015)。DopEcR因既能被DA激活,也可被E和20E抑制而得名,其被E和20E拮抗的效果达到纳摩尔级别,DopEcR也是目前唯一可以被昆虫蜕皮激素拮抗的膜受体(Srivastavaetal., 2005; Bai and Palli, 2016)。
4 DA及其DARs的重要功能
DA是昆虫许多生理与行为过程中的关键神经激素,主要是通过特异性地结合其相应的DARs发挥作用。本文简要地总结了昆虫DARs的功能(表3),并对其中一些调控过程进行概述。
4.1 取食
能量缺失对任何动物来说都是有风险的,因此饥饿控制着昆虫的大部分其他需求或行为,而DA在昆虫应对饥饿状态中起着重要作用(Grunwald Kadow, 2018)。在果蝇中,MB整合饥饿和饱感信号以调控觅食行为,这种调控被6种DANs(PAM-β’2a, PAM-β2β’2a, PPL1-γ2α’1, PPL1-α’2α2, PPL-α3和PPL1-γ1pedc)介导;通过操纵这些DANs可以抑制饥饿果蝇的觅食行为或促进已饱果蝇的觅食行为,这些DANs的功能被在球形细胞(Kenyon cells, KCs)和MB输出型神经元(mushroom body output neurons, MBONs)中的DOP2受体控制(Tsaoetal., 2018)。另外的研究发现,饱感状态依赖的环路汇聚在MB中表达DOP1的KCs,神经活性能促使饱感状态下的觅食(Landayanetal., 2018)。果蝇在蛋白饥饿的状态下会激活DA-WED神经元,导致通过DOP2持续增加对下游FB-LAL神经元的刺激促使对蛋白不断摄取,同时信号通过DOP1到PLP神经元诱导糖摄取的瞬时抑制(Liuetal., 2017)。在蜜蜂中,持续的觅食行为诱导了DOP2和DopEcR转录水平的上调,这可能与取食的奖赏有关(Singhetal., 2018)。
4.2 学习
DA在昆虫学习行为过程中扮演着关键角色。在果蝇中,DOP1受体在MB神经纤维网(neuropil)中高表达,在巴浦洛夫条件反射试验中,DOP1被认为是调控厌恶和食欲学习的关键受体(Kimetal., 2007)。通过人为地激活MB的aSP13神经元,果蝇的学习经验可以被模拟,这些特异DANs的突触传递对于求偶学习十分重要,而在aSP13神经元表达的DOP1受体参与了调控自然和人为的求偶学习(Kelemanetal., 2012)。另外,在果蝇MB中激活DOP1受体,可以挽救由睡眠缺失引发的学习损害(Seugnetetal., 2008)。在GABA神经元中干扰DOP3影响了果蝇的厌恶嗅觉学习(Zhouetal., 2019)。埃及伊蚊Aedesaegypti可以通过学习回避防御性寄主的气味,通过药理学干预、RNAi和基因编辑影响DOP1受体的表达抑制了它们的学习能力,DA在介导蚊子学习行为诱导的可塑性中扮演着关键角色(Vinaugeretal., 2018)。DopEcR受体在厌恶学习试验中蜜蜂的脑中高表达,而在食欲学习试验中蜜蜂的脑中相对低表达,表明DopEcR在食欲和厌恶学习性状中的潜在作用(Lagiszetal., 2016)。在双斑蟀Gryllusbimaculatus中,DOP1被沉默,其厌恶学习受到了损害而食欲学习表现正常;DOP2被沉默,其厌恶学习和食欲学习均表现正常,由此可见DA通过DOP1受体调控双斑蟀的厌恶学习(Awataetal., 2015, 2016; Mizunami and Matsumoto, 2017)。

表3 昆虫多巴胺及其受体调控的功能
4.3 记忆与遗忘
记忆可帮助动物适应外界环境,记忆形成的分子机制被认为与神经元之间的突触传递有关(Takemuraetal., 2017)。记忆获取和巩固之间的平衡决定了记忆的长短,而DA信号在昆虫不同记忆过程中发挥重要作用(Davis and Zhong, 2017)。研究发现果蝇不同类型的DANs参与调控不同的记忆类型,如PAM-γ5, PAM-β1, PAM-β2, PAM-α1和PPL1-γ1pedc等参与调控长期记忆(Huetterothetal., 2015; Placaisetal., 2017),PAM-β’2和PAM-γ4等调控短期记忆(Huetterothetal., 2015),刺激DANs可导致cAMP水平的上升,而其中的cAMP信号对控制长期或短期记忆是必需的(Blumetal., 2009)。研究发现DOP1受体通过偶联Gs蛋白刺激cAMP合成从而介导记忆的获取(Himmelreichetal., 2017),同时发现DOP1可以调控食欲长期记忆(Ichinoseetal., 2015),而在DOP1的突变体中恢复DOP1的表达也可恢复长期和短期记忆(Qinetal., 2012),另外,DOP1通过其下游的翻译调控因子Orb2A能将记忆获取与记忆巩固的过程连接起来(Kruttneretal., 2015)。MB中能量流的上调对促进长期记忆的形成是充分必要的,而在MB神经元中的DOP2介导了DA作用于能量流的过程(Placaisetal., 2017);PPL1-γ1pedc神经元中的DOP2也被发现参与食欲长期记忆的形成(Mussoetal., 2015)。同时,另外的研究发现DA信号在MVP2神经元发挥作用以调控食欲记忆,而令人奇怪的是相反地作用于下游cAMP信号的DOP2和DOP3受体均参与了食欲长期记忆的形成(Pavlowskyetal., 2018)。遗忘是记忆重要的另外一面,而DOP2受体特异地参与介导果蝇的遗忘(Berryetal., 2012),通过RNAi在MB中敲除Gq蛋白抑制了遗忘,由此可见DOP2通过激活Gq蛋白调动Ca2+信号从而调控遗忘(Himmelreichetal., 2017)。
4.4 求偶与交配
求偶与交配行为对于昆虫生存繁衍是十分关键的,被多种内外因素通过神经调节系统控制,其中DA起着重要作用。阻断DA的神经传递能显著降低雄果蝇对雌果蝇的求偶行为,而在DANs中恢复VMAT的表达可以缓和VMAT雄果蝇突变体的求偶缺陷(Chenetal., 2013)。在未交配雄果蝇中,DOP1受体调控其求偶欲望(Limetal., 2018);而DA通过DOP2受体将信号传递到P1神经元,可以控制已交配的果蝇降低其求偶欲望(Zhangetal., 2016);在衰老果蝇的PPL2ab神经元中升高DA水平,可以恢复其求偶行为(Kuoetal., 2015)。分别突变DOP1, DOP2, DOP3和DopEcR均会导致果蝇交配时间的下降,表明DA是通过4种DARs调控交配的持续(Crickmore and Vosshall, 2013)。在雄果蝇中提高DA含量可以诱导雄雄求偶行为,是由于改变了其性倾向(Liuetal., 2008);而DA水平的降低也能诱导雄雄求偶行为,主要是由于提高了雄果蝇的吸引力或降低了对其他雄性的厌恶(Liuetal., 2009);通过遗传学和药理学操作,发现果蝇雄雄求偶行为是通过DOP1调控的(Liuetal., 2008; Chenetal., 2012)。
4.5 睡眠与觉醒
睡眠对于维持昆虫生理功能是不可缺少的(Helfrich-Forster, 2018)。在果蝇中,大量研究表明DA参与了睡眠和觉醒的过程,DANs通过MBs促进觉醒,将多巴胺信号输入到背扇形体(dorsal fan-shaped body, dFSB)区域(Artiushin and Sehgal, 2017)。DOP1被发现在dFSB中介导DA的睡眠和觉醒作用(Liu QLetal., 2012; Uenoetal., 2012),DAT突变体果蝇短睡眠的表型能被DOP1的突变完全回补,但在野生型果蝇dFSB中敲除DOP1可以恢复短睡眠的表型(Uenoetal., 2012)。另外,其他研究发现在dFSB中敲除DOP3可以导致总睡眠上升(Pimenteletal., 2016)。由此可见,DOP1和DOP3都在dFSB中发挥作用,DOP1是充分的但不是必要的。同DA通过Gs蛋白偶联的D1-like DARs起作用一样,在dFSB中持续激活Gs蛋白可以导致睡眠下降,另外dFSB可通过增加cAMP直接对DA的施用作出反应,但通过敲除DOP1可以消除(Uenoetal., 2012)。通过持续激活PKA也可导致睡眠不足,表明dFSB依赖DA的抑制通过cAMP依赖信号起作用(Liu QLetal., 2012);另外,DA可以通过钾通道超极化dFSB神经元,这种效应可以被百日咳毒素(pertussis toxin, PTX)消除,也支持了DOP3下游Gi偶联的机制(Pimenteletal., 2016)。在果蝇中,DOP1突变体增强了环境诱导的唤醒,降低了正常睡眠周期的唤醒,这两种类型的唤醒可以被咖啡因相反地影响(Lebestkyetal., 2009);咖啡因可以通过DA信号促进果蝇的唤醒,而DOP1受体可以介导这种咖啡因诱导的唤醒(Andreticetal., 2008; Nalletal., 2016)。
4.6 其他功能
DARs还可以调控昆虫的其他生理与行为过程。在果蝇中,DOP1参与了抉择行为的调控(Zhangetal., 2007), DOP1, DOP3和DopEcR参与调控运动行为(Draperetal., 2007; Kongetal., 2010; Larketal., 2017), DOP1和DOP3调控好斗行为(Alekseyenkoetal., 2013), DOP2调控变态发育(Regnaetal., 2016)。在赤拟谷盗中,干扰DOP3抑制了卵黄蛋白的摄取和卵巢的发育(Bai and Palli, 2016)。在东亚飞蝗Locustamigratoria中,microRNA-133可通过控制DA的合成调控其型变行为(Yangetal., 2014),通过DOP1和DOP2分别调控群居与散居行为(Guoetal., 2015);另外,DOP1可通过抑制microRNA-9a的表达介导飞蝗的嗅觉吸引行为(Guoetal., 2018)。在小地老虎Agrotisipsilon中,DopEcR调控了对性信息素的感知(Abrieuxetal., 2013, 2014)。在棉铃虫Helicoverpaarmigera中,20E通过结合DopEcR抑制了幼虫的取食,促进了化蛹(Kangetal., 2019)。在二化螟Chilosuppressalis中,DA通过DOP1受体调控血细胞的吞噬(Wuetal., 2015)。由此可见, DA可能是连接神经系统与免疫系统的重要分子。
5 展望
DA在昆虫神经系统中有着相对高的含量,且是丰度最高的单胺,在昆虫中调控着多种生理与行为过程。随着CRISPR/Cas9技术在大量昆虫中成功地应用(Sunetal., 2017; Taningetal., 2017),这将有利于研究昆虫多巴胺信号通路中基因的功能;最新的实时成像技术可以特异地检测到DA在果蝇MB中的动态变化,甚至能灵敏地检测到单一神经元中的变化(Sunetal., 2018),这将更方便地追踪DA在昆虫中的微量变化,有利于探讨DA的生理功能;近年来兴起的单细胞测序可以从单一细胞水平进行转录组测序,有助于解析不同类型的单个DAN的转录调控网络(Crockeretal., 2016; Davieetal., 2018)。这些分子生物学技术的进展,都将有利于昆虫DA的研究更加深入地开展。
GPCRs是非常成功的药物靶标,接近35%的药物作用于这些受体以及它们相关的蛋白(Hauseretal., 2017; Sriram and Insel, 2018)。在无脊椎动物中,GPCRs长期以来被作为开发新型杀虫剂的靶标,而DARs是其中的重要靶标之一(Audsley and Down, 2015; Hilletal., 2018);另外,也有研究表明多巴胺代谢酶可作为新型杀虫剂的靶标(Chenetal., 2018; O′Flynnetal., 2018a)。由于昆虫DARs的药理学性质存在差异,不同类型的DARs的特异性激动剂或拮抗剂可作为选择性杀虫剂的合成前体。之前很多研究表明,扰乱多巴胺信号通路可以引起昆虫死亡或导致其无行动能力或发育不良(Fuchsetal., 2014; Conleyetal., 2015; Bai and Palli, 2016),因此合理设计以害虫DARs和代谢酶为靶标的特异小分子,或构建可以表达靶向害虫DARs和代谢酶基因的dsRNA或miRNA的作物,都将有益于害虫防治。
