烟草甲谷胱甘肽S-转移酶基因LsGSTe1的表达及其与甲酸乙酯耐受性的关系
2020-03-03许抗抗胡大鸣杨文佳
严 毅, 许抗抗, 杨 洪, 胡大鸣, 杨文佳
(1. 贵州大学昆虫研究所, 贵州山地农业病虫害重点实验室, 贵阳 550025;2. 贵阳学院生物与环境工程学院, 贵州省山地珍稀动物与经济昆虫重点实验室, 贵阳 550005;3. 贵州大学烟草学院, 贵阳 550025; 4. 贵州中烟工业有限责任公司, 贵阳 550025)
烟草甲Lasiodermaserricorne隶属于鞘翅目(Coleoptera)窃蠹科(Anobiidae),是烟草、粮食、中药材、茶叶等储藏期害虫的优势种,其发生危害具有较强的隐藏性(Lietal., 2009)。同时由于烟草甲繁殖力强、环境适应能力强等特性,其危害愈演愈烈,对多种储藏物造成了严重的经济损失(Imai and Masuda, 2017; Yangetal., 2019)。目前,烟草甲的防治主要以化学熏蒸为主,但化学药剂的长期不合理使用不仅导致其抗药性发展迅速,由此带来的食品安全和环境保护等问题也日益突出(Hori, 2003; Hironakaetal., 2017)。甲酸乙酯常温下为无色液体,是一种防治仓储害虫的新型熏蒸剂,具有杀虫快、毒性低、无残留等特点,并且多种储藏物会自然产生甲酸乙酯,因此该药剂的使用不会对储藏物的品质造成影响(Nicholas and Ebert, 2006)。自2002年登记注册以来,甲酸乙酯被广泛应用于谷蠹Rhyzoperthadominica, 赤拟谷盗Triboliumcastarteum, 菜豆象Acanthoscelidesobtectus, 嗜卷书虱Liposcelisbostrychophila和花斑皮蠹Trogodermavariabile等仓储害虫的防治,研究证实其防控害虫速效性优于磷化氢,且毒性低于磷化氢,因此该熏蒸剂将有望成为磷化氢的替代品(唐培安等, 2007; 王云果等, 2008; 姚洁等, 2016)。
谷胱甘肽S-转移酶(glutathioneS-transferases, GSTs, EC 2.5.1.18)是由多个基因编码的超家族酶系,几乎存在于所有的生物体内(Sheehanetal., 2001; Lietal., 2007)。根据其同源性和底物特异性,可将昆虫GSTs分为7个家族,包括Sigma, Omega, Zeta, Epsilon, Delta和Theta 6个已知家族和一个未知家族(Fengetal., 2001; 许抗抗等, 2017)。其中Epsilon和Delta是在昆虫中特异存在的家族,主要通过催化多种外源和内源的有毒疏水化合物与还原型的谷胱甘肽共轭亲和,中和有毒物质亲电子中心,提高其水溶性,从而达到降低细胞毒性的目的(Agianianetal., 2003; Huetal., 2014)。研究表明,家蚕Bombyxmori的Epsilon家族GSTs不仅参与有毒物质的解毒代谢过程,而且还具有抗氧化功能(Yuetal., 2008)。AgGSTe2蛋白参与了DDT在冈比亚按蚊Anophelesgambiae体内的代谢,导致其抗药性的产生(Ortellietal., 2003)。GSTe2,GSTe5和GSTe7基因在埃及伊蚊AedesaegyptiDDT抗性品系中过量表达,采用蛋白体外重组表达和RNA干扰(RNAi)技术,证明GSTe5蛋白可以有效代谢DDT,而GSTe2和GSTe7与溴氰菊酯和DDT的解毒有一定相关性(Lumjuanetal., 2011)。由此,可以看出Epsilon家族GSTs基因在昆虫应对外源化合物胁迫和解毒代谢过程中起着重要作用。目前有关Epsilon家族GSTs基因参与昆虫对化学熏蒸剂解毒的分子机制研究较少。本研究在烟草甲转录组数据库的基础上,利用RT-PCR技术克隆获得LsGSTe1基因的cDNA全长序列,利用qPCR技术分析了该基因在烟草甲不同发育阶段、不同组织部位以及甲酸乙酯熏蒸胁迫后的表达特性,并采用RNAi技术研究其对甲酸乙酯的解毒特性。本研究初步探索了LsGSTe1在甲酸乙酯解毒过程中的作用,为新型分子靶标杀虫剂的开发提供了理论依据。
1 材料与方法
1.1 供试烟草甲
烟草甲于2010年采自贵州省贵阳市(26°34′N, 106°41′E),以中药材当归Angelicasinensis为食料在人工气候箱中连续饲养繁殖50代以上。气候箱参数为:温度28±1℃,相对湿度75%±5%,光周期0L∶24D。
1.2 主要试剂
总RNA提取试剂盒TaKaRa MiniBEST Universal RNA Extraction Kit, DNase, cDNA第1链合成试剂盒PrimeScript® RT Reagent Kit和DNA 2000 Marker均购自TaKaRa公司;感受态细胞Trans5α, PCR试剂盒2×EasyTaq PCR SuperMix均购自全式金公司;胶回收试剂盒Gel Extraction Kit购自Omega公司;载体pGEM-T Easy Vector, qPCR试剂盒GoTaq® qPCR Master Mix均购自Promega公司;RNAi试剂盒TranscriptAid T7 High Yield Transcription Kit购自Thermo Scientific公司;熏蒸剂甲酸乙酯购自Aladdin公司(无水级,≥98%)。
1.3 烟草甲总RNA提取与cDNA第1链合成
根据MiniBEST Universal RNA Extraction Kit说明书提取烟草甲的总RNA,利用NanoDrop 2000核酸蛋白浓度测定仪(Thermo Scientific公司)检测RNA的浓度和纯度,通过1%琼脂糖凝胶电泳检测RNA的完整性,并利用DNase去除基因组DNA。选取OD260/OD230和OD260/OD280在1.8~2.2的RNA于-80℃保存备用。使用PrimeScript® RT Reagent Kit合成cDNA第1链。
1.4 烟草甲LsGSTe1基因的克隆
根据烟草甲转录组获得的1个Epsilon家族GST基因的Unigene片段,采用Primer 6.0软件设计1对全长验证引物(表1)扩增该基因的开放阅读框。PCR反应体系: 2× Assembly Mix 25 μL, 上下游引物(20 μmol/L)各1 μL, cDNA模板2 μL, 加ddH2O补至总体积50 μL。反应条件: 95℃预变性3 min; 95℃变性30 s, 57℃退火30 s, 72℃延伸1 min, 共35个循环;最后72℃延伸10 min。PCR扩增产物用1%琼脂糖凝胶电泳检测,按照Gel Extraction Mini Kit说明书回收目的条带,并连接至pGEM-T Easy载体,再转化到Trans5α大肠杆菌Escherichiacoli感受态细胞中,经蓝白斑筛选和PCR鉴定,将阳性克隆送成都擎科梓熙生物技术有限公司进行测序。
1.5 序列分析
采用DNAMAN 6.0 (Lynnon Biosoft)对测序结果进行编辑和分析,推导的氨基酸序列采用BLAST工具(http:∥www.ncbi.nlm.gov/BLAST/)进行同源性比对分析。利用ProtParam (http:∥web.expasy.org/)和NetNGlys 1.0 Server (http:∥www.cbs.dtu.dk/services/NetNGlyc/)分析编码蛋白的理化性质和N-糖基化位点。利用Prosite (http:∥prosite.expasy.org/)分析氨基酸的保守区域。经过Clustal X软件进行序列比对,使用MEGA 6.06软件中的邻接法(neighbor-joining)构建系统进化树,替代模型为泊松模型,各分支均进行1 000次的重复检验(Tamuraetal., 2013)。
1.6 烟草甲LsGSTe1基因的时空表达
分别收集烟草甲低龄幼虫(卵孵化后24 h内)、高龄幼虫(4龄以上)、蛹(化蛹后48 h以上)、低龄成虫(羽化后24 h内)和高龄成虫(羽化后7 d),每个虫态设置3个生物学重复,每个重复40头试虫。解剖烟草甲高龄幼虫的表皮、中肠、脂肪体和马氏管共4种组织,每种组织设3个生物学重复,每个重复分别解剖50头试虫。将上述材料经液氮速冻后保存于-80℃冰箱,并按照1.3节方法分别提取所有样品的总RNA并进行cDNA制备。采用qPCR技术检测烟草甲LsGSTe1基因的时空表达,以18S rRNA基因为内参基因,引物序列见表1。qPCR扩增在CFX96TMReal-Time System实时定量PCR仪(Bio-Rad公司)中进行,技术重复2次。反应体系(20 μL): GoTaq® qPCR Master Mix 10 μL, cDNA模板1 μL, 上下游引物(10 μmol/L)各1 μL, ddH2O 7 μL。混匀后轻微离心,扩增条件: 95℃预变性5 min; 然后95℃变性15 s, 60℃退火30 s, 72℃延伸30 s, 共40个循环;最后在60~95℃绘制熔解曲线,选取相关系数(R2)大于0.98和扩增效率(E)在90%~110%的引物备用。

表1 本研究使用的引物
下划线为T7启动子序列。T7 promoter sequence is underlined.
1.7 甲酸乙酯胁迫后烟草甲LsGSTe1基因的表达
熏蒸处理参照广口瓶密闭法(唐培安等, 2007),用细毛笔轻轻挑取30头5龄幼虫于50 mL无盖塑料离心管内,加入40 g当归作为食料,用160目纱网做成的离心管盖用皮筋绑在螺口处,放于1 000 mL广口瓶中,将剪好的大小一致的滤纸放置广口瓶底部,用移液器点滴一定量的甲酸乙酯在滤纸上,并用凡士林涂抹在瓶口处密封盖紧瓶盖。将广口瓶置于人工气候箱培养观察,并统计甲酸乙酯熏蒸处理后烟草甲的存活与死亡数,根据前期预结果(数据另文发表)采用2个亚致死浓度LC10(5 μL/L)和LC30(10 μL/L),以及致死中浓度LC50(20 μL/L)的甲酸乙酯进行熏蒸处理,参考姚洁等(2016)24 h后散气挑取存活的试虫,以相同条件下的空气处理作为对照,每处理3次重复。按照1.3节方法分别提取上述处理样品的RNA并合成cDNA,按照1.6节方法进行qPCR,检测LsGSTe1基因的表达。
1.8 烟草甲LsGSTe1基因的沉默及效率检测
烟草甲LsGSTe1基因dsRNA (dsLsGSTe1)的体外合成按照使用TranscriptAid T7 High Yield Transcription Kit说明书进行,引物序列见表1,用1.5%琼脂糖凝胶电泳对合成的dsRNA进行检测。烟草甲主要以幼虫在寄主内取食危害,是害虫防治的关键时期,且前期qPCR结果表明LsGSTe1基因在烟草甲幼虫中高表达,所以选取大小均一、生长状况良好的烟草甲5龄幼虫进行RNAi实验,运用显微注射仪(World Precision Instruments公司)沿着血液流动方向(头部向腹部方向),将200 ng dsLsGSTe1注射到5龄幼虫的倒数第2和第3腹节之间,注射等量的dsGFP作为对照组。每个处理30头试虫,分别在48和72 h收虫并冻存于-80℃,按照1.3节方法分别提取上述处理样品的RNA并合成cDNA,按照1.6节方法进行qPCR,检测不同时间点RNAi的沉默效率。实验重复3次。
1.9 RNAi干扰LsGSTe1后烟草甲对甲酸乙酯的敏感性分析
对分别注射200 ng dsLsGSTe1和dsGFP(方法同1.8节)72 h后的5龄幼虫进行甲酸乙酯LC30(10 μL/L)和LC50(20 μL/L)两个浓度毒力生物测定(同1.7节),每个处理40头试虫,24 h后统计死亡率。实验重复3次。
1.10 数据分析
实验结果采用平均值±标准误表示,数据处理采用SPSS 23.0软件。采用2-△△CT计算烟草甲LsGSTe1基因的相对表达量(Livak and Schmittgen, 2001),将表达量最低的样品数值视为1,其他样品的表达量以相对于最低表达量的倍数进行分析。烟草甲不同发育阶段、不同组织及甲酸乙酯处理后mRNA表达差异采用单因素方差分析(ANOVA),P<0.05表示差异显著。dsRNA注射后靶标基因mRNA表达和试虫敏感性测定采用T检验进行差异显著性分析,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果
2.1 LsGSTe1基因的克隆与序列分析
利用RT-PCR扩增获得烟草甲一个GST基因的cDNA全长序列,同源性比较确定该基因属于GSTs基因Epsilon家族,命名为LsGSTe1(GenBank登录号: MN480468)。LsGSTe1开放阅读框长684 bp,编码227个氨基酸,理论等电点为5.15,预测蛋白质分子质量为26.7 kD,且不存在N-糖基化位点。Prosite分析表明,LsGSTe1编码的氨基酸具有2个谷胱甘肽S-转移酶结合域的2个催化活性保守位点,第1-84位氨基酸为N末端结构域,第90-215位为C末端结构域(图1)。
2.2 LsGSTe1基因的序列比对和系统发育分析
LsGSTe1氨基酸序列BLAST比对结果显示:LsGSTe1与其他鞘翅目昆虫Epsilon家族GSTs的同源性较高,其中与黄粉虫Tenebriomolitor(GenBank登录号: AIL23539.1)、赤拟谷盗Triboliumcastaneum(GenBank登录号: XP_008190708.1)和白蜡窄吉丁Agrilusplanipennis(GenBank登录号: XP_018333399.1)GST氨基酸序列一致性分别为59%, 52%和48%。
将LsGSTe1与目前已经鉴定的其他昆虫(赤拟谷盗、黑腹果蝇Drosophilamelanogaster和家蚕)GSTs氨基酸序列进行了聚类分析,结果显示4种昆虫的18个GSTs被分为6组(Delta, Sigma, Epsilon, Omega, Theta和Zeta),其中LsGSTe1与同属于鞘翅目的赤拟谷盗的TcGSTe15的氨基酸序列一致性高达74%,这表明LsGSTe1隶属于Epsilon家族(图2)。
2.3 LsGSTe1基因的时空表达
LsGSTe1在烟草甲检测的所有发育阶段均有表达,其在高龄幼虫时期的表达量最高,显著高于其他发育阶段(P<0.05),是低龄成虫时期表达量的5.6倍,在低龄幼虫和蛹期表达量略低,而在低龄和高龄成虫期的表达量达到最低水平,显著低于其他发育阶段(P<0.05)(图3: A)。烟草甲LsGSTe1表达部位主要在幼虫脂肪体(P<0.05),其次为中肠和表皮,而在马氏管中的表达量最低(图3: B)。
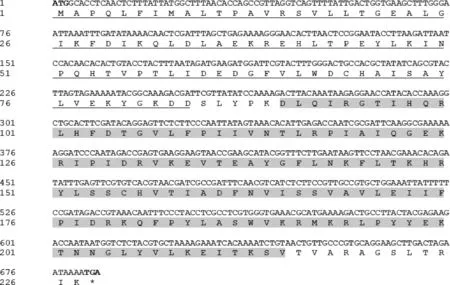
图1 烟草甲LsGSTe1基因的核苷酸序列及推导的氨基酸序列

图2 邻接法构建的基于烟草甲LsGSTe1和其他昆虫GSTs氨基酸序列的系统进化树(1 000重复)

图3 烟草甲LsGSTe1在不同发育阶段(A)和幼虫组织(B)中的相对表达量
2.4 甲酸乙酯处理后烟草甲LsGSTe1基因的表达模式
烟草甲5龄幼虫受甲酸乙酯熏蒸胁迫后,LC30(10 μL/L)和LC50(20 μL/L)浓度组LsGSTe1基因的表达量显著上调(P<0.05),分别是对照组的2.96和5.80倍;而LC10(5 μL/L)浓度组与对照组的表达量在统计学上差异不显著(P>0.05)(图4)。
2.5 RNAi对LsGSTe1的沉默效率
采用RNAi技术沉默烟草甲LsGSTe1 48 h和72 h后,结合qPCR检测该基因mRNA的相对表达量。结果表明,与对照组相比,注射48 h和72 h后LsGSTe1表达量分别下降了79.9%和83.0%,极显著低于对照(P<0.01),说明通过RNAi已经成功抑制该基因的表达(图5)。

图4 甲酸乙酯胁迫后烟草甲5龄幼虫LsGSTe1基因的相对表达水平

图5 RNAi对烟草甲5龄幼虫LsGSTe1基因沉默效率
2.6 LsGSTe1沉默后烟草甲5龄幼虫对甲酸乙酯的敏感性
通过生物测定实验结合RNAi技术,检测烟草甲对熏蒸剂甲酸乙酯的敏感性,研究烟草甲LsGSTe1对甲酸乙酯的解毒代谢作用。结果发现,甲酸乙酯LC30(10 μL/L)熏蒸处理下dsLsGSTe1处理组的死亡率达到45.5%,略高于对照组(dsGFP注射组)的死亡率(33.3%),差异不显著(P>0.05);甲酸乙酯LC50(20 μL/L)熏蒸处理下dsLsGSTe1处理组的死亡率(80.0%)显著高于LC50熏蒸处理下对照组(dsGFP注射组)的死亡率(47.6%)(P<0.05)(图6)。

图6 LsGSTe1基因沉默后烟草甲5龄幼虫对甲酸乙酯的敏感性
3 讨论与结论
谷胱甘肽S-转移酶是昆虫体内一种重要的多功能催化酶,广泛参与到昆虫对外源杀虫剂的解毒代谢过程,可被多种杀虫剂诱导表达(Hemingwayetal., 2004),与杀虫剂耐受性相关的GSTs大多属于Epsilon和Delta家族(Samraetal., 2012)。在埃及伊蚊中发现,DDT和溴氰菊酯可诱导GSTe2和GSTe7基因的过表达,在一定程度上表明GSTe2和GSTe7参与了DDT和溴氰菊酯的代谢解毒过程(Lumjuanetal., 2005);同样冈比亚按蚊体内多个Epsilon家族GSTs基因在DDT抗性品系中过量表达(Ortellietal., 2003);黑腹果蝇体内DmGSTe6和DmGSTe7基因能够对甲基对硫磷进行代谢(Alias and Clark, 2010)。此外,马铃薯甲虫Leptinotarsadecemlineata, 赤拟谷盗和中欧山松大小蠹Dendroctonusponderosae分别有30, 36和28个GSTs基因被鉴定,其中Epsilon基因分别有10, 19和12个基因属于Epsilon家族,但都缺乏进一步功能分析(Shietal., 2012; Keelingetal., 2013; Hanetal., 2016)。本研究发现,烟草甲经甲酸乙酯LC30(10 μL/L)和LC50(20 μL/L)熏蒸处理后,体内LsGSTe1基因表达水平分别上调2.96和5.80倍,诱导的LsGSTe1高表达可能参与到甲酸乙酯的代谢过程。
基因的时空表达特性可在一定程度上反映基因的功能(Yangetal., 2016a)。不同昆虫体内的GSTs基因在不同发育阶段的表达量变化差异较大。如小菜蛾PlutellaxylostellaGSTs1基因在卵和幼虫阶段高表达,而在蛹和成虫阶段则不表达(Youetal., 2015);相反的是,二化螟ChilosuppressalisSigma家族的GST基因在成虫期高表达,在蛹和幼虫阶段表达量相对较低(Liuetal., 2015)。在菜粉蝶Pierisrapae的研究中,发现PrGSTe2,PrGSTo4,PrGSTs4和PrGSTt1主要在4龄幼虫期表达,而PrGSTe1在4龄幼虫和蛹期高表达(Liuetal., 2017)。本研究中LsGSTe1表达模式与PrGSTe1类似,暗示LsGSTe1可能更大程度地参与到成虫前期对寄主内部外源化合物的解毒代谢过程中。为进一步挖掘LsGSTe1的组织表达特性,本研究采用qPCR技术对LsGSTe1在烟草甲幼虫不同组织部位的表达模式进行解析,结果发现,LsGSTe1在表皮、中肠、脂肪体和马氏管4个组织中均表达,且在脂肪体中表达量最高,相同的结果还出现在对小菜蛾、家蚕和稻纵卷叶螟Cnaphalocrocismedinalis的研究中(Yuetal., 2008; Liuetal., 2015; Youetal., 2015)。由于脂肪体是昆虫的主要储存能量器官,并在应对外源有毒物质的代谢过程中发挥着关键作用(Houetal., 2010),因此我们推测LsGSTe1在脂肪体中的高表达可能与外源杀虫剂的解毒代谢有关。
利用RNAi技术对昆虫GST家族基因进行功能分析,不仅可以为解析GSTs在杀虫剂解毒中的作用提供直接证据,而且有助于揭示GSTs介导的杀虫剂耐受性机制(Yuetal., 2016)。利用RNAi沉默朱砂叶螨TetranychuscinnabarinusTcGSTM7基因表达后,该螨对丁氟螨酯和甲氰菊酯的敏感性均显著提高(申光茂等, 2018)。烟粉虱Bemisiatabaci体内GST14被沉默后,其在噻虫嗪胁迫下的死亡率显著提升,表明GST14能够明显提高烟粉虱对噻虫螓的耐受性(Yangetal., 2016b),类似功能也出现在东亚飞蝗LmGSTs3基因的研究中(Qinetal., 2012)。最新研究发现,柑橘木虱DiaphorinacitriDcGSTe2和DcGSTd1两个基因的共沉默,可导致柑橘木虱对甲氰菊酯和噻甲氧胺的抗性水平进一步提升(Yu and Killiny, 2018)。本研究采用RNAi技术研究烟草甲LsGSTe1与甲酸乙酯代谢解毒的关系,发现沉默LsGSTe1后,烟草甲对LC30(10 μL/L)的甲酸乙酯敏感性没有发生显著性变化,而对LC50(20 μL/L)的敏感性显著上升(死亡率提高32.4%),推测LsGSTe1基因可能参与烟草甲对甲酸乙酯的体内解毒代谢。类似的结果出现在棉铃虫Helicoverpaarmigera细胞色素P450氧化还原酶的研究中,发现目的基因沉默后,与对照组相比,棉铃虫对低浓度溴氰菊酯的敏感性无显著差异,而高浓度处理组棉铃虫死亡率显著增加(汪丹, 2011)。昆虫在应对低剂量/浓度的农药胁迫过程中,多种解毒代谢基因共同参与杀虫剂的解毒代谢,具有一定的协同效应(Liuetal., 2017)。因此,我们推测烟草甲在低浓度的甲酸乙酯的胁迫下,其他类解毒代谢酶基因可能在这一时期发挥着关键作用。
综上所述,本研究利用RT-PCR技术克隆获得烟草甲谷胱甘肽S-转移酶基因LsGSTe1的cDNA全长序列,该基因在烟草甲高龄幼虫和脂肪体中表达较高,暗示其可能参与烟草甲对外源物质的解毒代谢。进一步研究抑制LsGSTe1基因的表达后,烟草甲对甲酸乙酯的敏感性与对照组相比明显提高,表明LsGSTe1在烟草甲响应甲酸乙酯胁迫并参与代谢过程中发挥了关键作用。
