通用引物双重PCR在节肢动物物种鉴定中的应用
2020-03-03王彦坤李天楚粘景梓陈思聪郝志霞姜金壮黄大卫
王彦坤, 李天楚, 粘景梓, 陈思聪, 郝志霞, 姜金壮, 黄大卫,,*
(1. 河北大学生命科学学院, 河北保定 071002; 2. 南开大学生命科学学院, 天津 300071)
多重PCR是指在一次PCR反应体系中加入多对引物,从而同时产出多条目标片段的技术,由Chamberlain等(1988)首次提出。目前多重PCR主要应用于致病微生物的快速检测:如针对靶标致病微生物设计扩增产物大小不同的多对特异性引物,将这些引物同时用于对样品进行一次PCR扩增,然后将扩增产物进行电泳,即可通过检查扩增产物条带的大小快速确定样品中感染微生物的种类(Potrykusetal., 2014; Kimetal., 2015)。
自Hebert等(2003)引入DNA条形码的概念以来,BOLD数据库中基于线粒体细胞色素C氧化酶亚基I (mitochondrial cytochromecoxidase subunit I, COI) 基因的条形码超过350万条,覆盖超过21万个物种(截至2019年10月) (Ratnasingham and Hebert, 2007),成为动物物种鉴定的标准分子标签。在物种鉴定及进行系统发育研究中,单一的DNA条形码分析在一定程度上可以满足实验分析的需要,但在部分类群中,人们发现基于COI基因片段的DNA条形码会受到线粒体假基因(Songetal., 2008)、线粒体异质性(Magnacca and Brown, 2010)或是胞内共生菌(Sunetal., 2011; Xiaoetal., 2012)的影响。因此在物种鉴定以及系统发育研究中,为了获得更加准确可靠的结果,人们通常会选择多个分子标记,例如在线粒体COI基因序列的基础上,加测其他线粒体基因(沈媛等, 2010; Xiaoetal., 2012; Wangetal., 2017)。在常规实验过程中,如果需要获取单一样本的多条标记基因,需要对该样品使用不同的引物进行多次扩增。因此,当需要快速准确鉴定物种,或是样本十分珍贵的情况下,上述实验过程由于实验流程显著延长或样本消耗加倍而存在诸多弊端。基于多重PCR的思路,在本研究中,我们考虑将双重PCR的方式用于多分子标记鉴定动物物种过程中的可能性,以期一次性获得单一样品的两个标记基因的序列,从而简化获取多个分子标记的实验过程,并减少样本消耗。
1 材料与方法
1.1 动物样本采集及基因组DNA提取
为了验证实验在不同类群中的实适用性,我们挑选了分属于3纲8目14科的14种动物 (表1),其中,家蝇Muscadomestica与大型溞Daphniamagna由河北大学免疫学实验室饲养,黄粉虫Tenebriomolitor于2014年购自河北省保定市花鸟鱼虫市场并饲养,甜菜夜蛾Spodopteraexigua于2018年6月购自河南济源白云实业有限公司,小金蝙蝠蛾Hepialusxiaojinensis于2014年5月采自四川省黑水县;其余标本均于2018年6月采自河北省保定市河北大学校园内,并依据形态将标本初步鉴定至科。所有标本采集后,浸泡于100%乙醇中,并在-20℃中保存。
基因组DNA提取时,首先对标本的体表进行清洗,随后将整头标本(表1中标本编号1, 11和13的3种动物)或部分附肢(其余11种动物,长度约5 mm),按照EasyPureGenomic DNA Kit (北京全式金生物技术有限公司)说明书,提取基因组DNA,并将其溶解于200 μL Elution Buffer中,随后将基因组DNA保存于-20℃。基因组DNA提取质量通过扩增COI基因进行检验。
1.2 双重PCR及测序
常用于物种鉴定以及构建系统发育的线粒体基因包括COI基因,Cytb(cytochromeb)和16S rDNA等。基于COI基因的DNA条形码有数量非常庞大的数据库,因此我们首先选择LCO1490与HCO2198 (Folmeretal., 1994)为COI基因的引物。在其他线粒体基因中,16S rDNA也具有较广泛的应用(沈媛等, 2010; Wangetal., 2017),因此我们选择16S rDNA作为双重PCR的备选基因。考虑到基于COI基因的DNA条形码长度为650 bp左右,我们挑选了16S rDNA基因中靶标片段长度分别为392 bp和1 049 bp的两个片段,并将其分别命名为16S-Small(16S-S)和16S-Large(16S-L)。与之对应,我们设计了两组双重PCR体系,分别用于扩增COI+16S-S与COI+16S-L。实验中所使用的引物见表2,由金唯智生物科技有限公司合成。
PCR反应体系: 10×TransTaq-T Buffer 5 μL, dNTPs (2.5 mmol/L) 4 μL, 引物 (10 μmol/L) 各1 μL,TransTaq-T Polymerase (5 U/μL) 1 μL, 模板2 μL (阴性对照为2 μL无菌水),最后以ddH2O补充至50 μL。PCR反应程序: 94℃预变性5 min; 94℃变性30 s, 50℃退火30 s, 72℃延伸40 s, 35个循环; 72℃再延伸7 min。最后将PCR产物在1%琼脂糖凝胶中电泳,经EB染色观察后,按照EasyPureQuick Gel Extraction Kit (北京全式金生物技术有限公司)说明书回收对应片段,并送至金唯智生物科技有限公司进行测序。
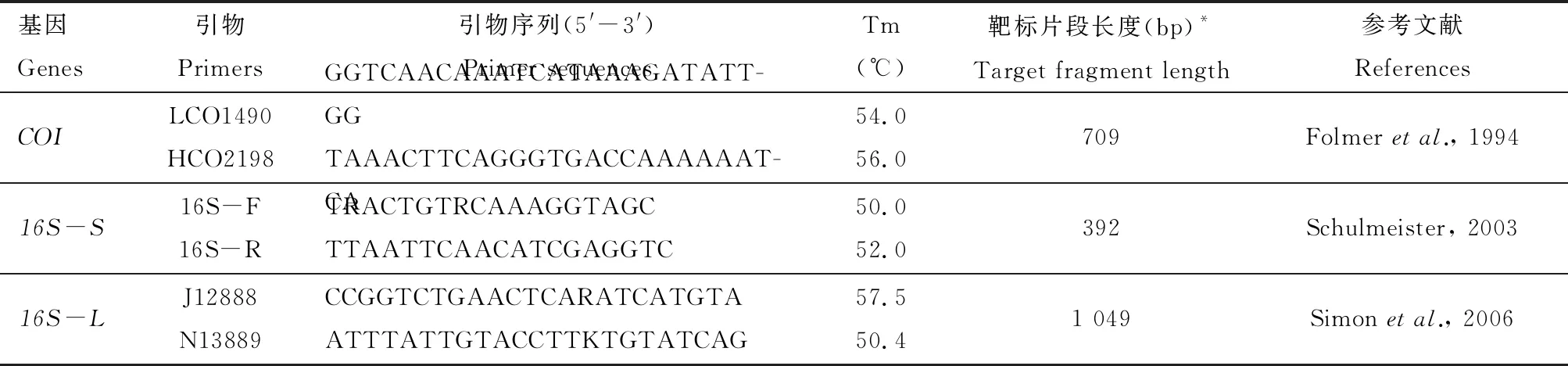
表2 本研究中使用的引物
16S-S和16S-L分别代表16S rDNA中长度为392 bp与1 049 bp的靶标片段。下同。16S-Sand16S-Lrepresent the 392 and 1 049 bp fragments of 16S rDNA, respectively. The same below.*以黑腹果蝇线粒体基因组(GenBank登录号: U37541)为参考序列;靶标片段长度包括引物长度。The mitochondrial genome ofDrosophilamelanogaster(GenBank accession number: U37541) was used as the reference sequence; the target fragment length included the primer length.
1.3 生物信息学分析
1.2节PCR产物测序所得原始序列对齐后,进行人工校对,并将两端残余的引物序列删除,最后获得了每个标本的COI,16S-S以及16S-L3条序列,在GenBank中使用在线程序Blastn搜索每个物种3条序列的相似序列。根据Blast对比结果(identity等)以及初步的形态鉴定,将每头标本鉴定至种,或将其认定为尚未公布序列的物种。由于16S-S位于16S-L内部,因此,我们仅将每个物种的COI与16S-L上传至NCBI GenBank数据库中。COI与16S-L的GenBank检索号列于表1。
2 结果
2.1 通用引物双重PCR检测
在致病微生物快速检测中,多重PCR的引物通常为特异性引物,以保证多重PCR扩增过程中没有非特异扩增条带的产生。在本研究中,为了检测双重PCR在较广泛的动物类群中的普适性,基于动物类群中可通用的线粒体通用引物,我们挑选了两组引物用于双重PCR实验,其中第1组双重PCR实验用于扩增COI与16S-S两个分子标记,而第2组双重PCR实验用于扩增COI与16S-L两个分子标记(预期扩增获得的各分子标记的靶标序列区域及长度详见方法1.2节)。我们首先以果蝇为材料检测了这两组通用引物是否适用于双重PCR。在以果蝇基因组DNA为模板检验双重PCR效果的结果中,两组双重PCR体系均可以成功扩增靶标片段,并且没有非特异性条带的产生(图1)。
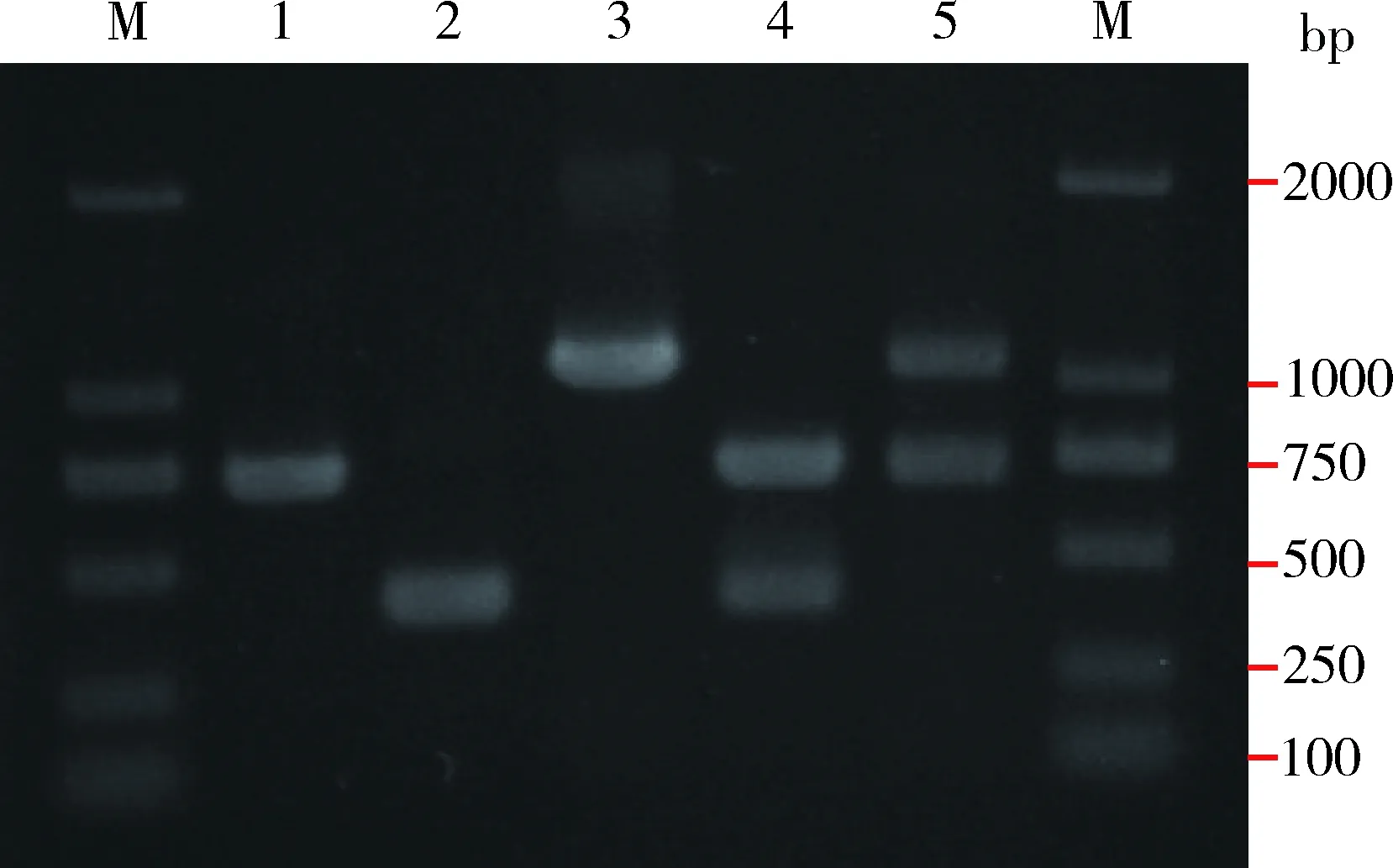
图1 双重PCR应用于黑腹果蝇基因组DNA的扩增结果
2.2 多种动物类群的双重PCR鉴定
在分属于不同动物类群的14个物种的14头标本中,两组双重PCR实验也可以成功地扩增靶标片段,并没有明显的非特异性条带的产生(图2)。接下来,将14个物种的COI,16S-L以及16S-S序列预期长度对应的电泳条带分别进行切胶回收并测序,进而将测序结果在GenBank进行在线比对。COI,16S-L以及16S-S序列的在线比对和物种鉴定结果(表1)可以总结为以下4类:
(1)可通过线粒体COI基因和16S rDNA分子标记有效鉴定至已知物种(序列一致性≥ 98%)。包括其9头标本(标本1, 3, 4, 5, 6, 9, 10, 12和13),其COI,16S-L以及16S-S序列可以分别鉴定至同一物种,并且具有较高的可信度,这些标本的鉴定结果分别为:黑腹果蝇D.melanogaster,黄粉虫T.molitor,光肩星天牛A.glabripennis,西方蜜蜂Apismellifera,日本弓背蚁Camponotusjaponicus,甜菜夜蛾S.exigua,小金蝙蝠蛾H.xiaojinensis,悬铃木方翅网蝽Corythuchaciliata以及大型溞D.magna。
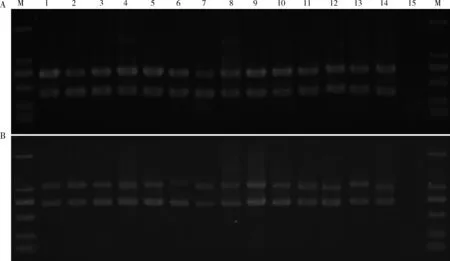
图2 14个节肢动物种的两组双重PCR扩增结果
(2)COI和(或)16S-L,16S-S序列与参考序列一致性略低于98%,但仍可鉴定至已知物种。包括2头标本:直翅目标本8的COI,16S-L以及16S-S序列均可以比对至突灶螽的序列,并且与已知序列的一致性分别为96.70%, 99.69%和100%,因此标本8的鉴定结果为突灶螽;半翅目标本11的COI,16S-L以及16S-S序列分别比对至白杨毛蚜Chaitophoruspopuleti,C.populicola和C.saliapterus,序列一致性为分别为100%, 95.48%和96.59%,因此标本11的鉴定结果为白杨毛蚜。
(3)通过COI和(或)16S rDNA不能有效鉴定至特定已知物种,可能为新种,或该物种的相关序列尚未公布。仅涉及1头标本,即蚰蜒目标本14,其COI,16S-L以及16S-S序列均比对至Thereuonematurkestana,但与已知序列一致性分别为90.55%, 93.85%和93.81%,因此该标本不能成功鉴定至种,在本文中标记为Scutigeridae sp.。
(4)COI和(或)16S rDNA序列分别可以比对至两个已知物种。包括另有2头标本:双翅目标本2的COI,16S-L以及16S-S序列均可以比对至家蝇M.domestica和毛足棒角蝗Dasyhippusbarbipes,并且一致性>98%;直翅目标本7的COI序列可以比对至长翅素木蝗Shirakiacrisshirakii和中华萝蘑肖叶甲Chrysochuschinensis,16S-L以及16S-S序列可以比对至长翅素木蝗S.shirakii。虽然标本2与标本7的基因比对结果中分别出现了两个物种,但在实验前,我们首先根据形态特征,将不同标本划分至科,因此我们确信标本2和标本7的鉴定结果分别为家蝇和长翅素木蝗。
3 讨论与结论
目前多重PCR广泛应用于致病微生物检测(郝少东等, 2015; Kimetal., 2015)中;此外也有研究者应用多重PCR来扩增基因组(Quicketal., 2017; 孙嘉仪等, 2017)。在这些研究中,多重PCR所需引物均需要根据已知序列设计特异性引物。在本研究中,我们使用线粒体基因通用引物来检测在不同动物类群中通过多重PCR技术同时获取多条靶标片段的可行性。我们首先考虑双重PCR的可行性,通过双重PCR产物的电泳图,我们可以发现基于通用引物的双重PCR技术可以可靠地扩增出目的条带,并没有非靶标条带的产生。本研究中,我们选取的靶标片段为线粒体COI基因和16S rDNA,并且16S-L和16S-S两个片段具有相似的物种鉴别能力。
引物的选择与优化被认为是影响多重PCR效果最大的因素(Elnifroetal., 2000)。在本研究中,我们选取了线粒体基因COI与16S rDNA作为靶标基因,因此我们不得不考虑本研究中挑选的两对引物,在扩增过程中是否存在相互影响。首先,我们考虑了两个基因的位置关系。由于大多数昆虫线粒体基因组排列与昆虫线粒体基因组原始排列顺序一致(陈志腾和杜予州, 2016),以黑腹果蝇线粒体基因组(U37541)为例,COI与16S-L两个标记基因片段之间的间距达到7 120 bp和10 641 bp;而本研究中所使用的DNA聚合酶TransTaq-T Polymerase的扩增速度为1~2 kb/min,PCR过程中延伸时间为40 s,这就意味着如果实验物种没有发生线粒体基因重排事件,两个片段的引物是不会发生相互干扰的。其次,我们对比了引物之间的互补关系,并未发现相互之间有互补结构的出现。本研究中,COI片段在两组双重PCR体系的扩增中均获得了较明亮的条带,而部分16S rDNA片段的条带较暗,例如日本弓背蚁的16S-L片段,这可能与引物的熔解温度或扩增产物片段大小相关;但50 μL的双重PCR体系,使我们可以通过胶回收获取足量的16S-L片段,满足测序的要求。另外,针对多重PCR体系中部分产物较弱的问题,在多重PCR体系中增加对应引物的量,增加引物与模板匹配的概率,也被认为解决问题的有效方法(Elnifroetal., 2000; 郝少东等, 2015)。鉴于目前有大量针对线粒体基因组设计的通用引物,其中有的是针对动物界(Simonetal., 1994, 2006),有的针对某一类群(张乃心等, 2013),这些引物完全可以供我们在研究不同类群时,挑选不同的基因,尝试不同的组合,开展用双重或多重PCR策略进行物种鉴定的工作。
本研究中,我们比较了双重PCR法与常规方法在操作流程中的差异,两种方法的最明显差异体现在消耗的时间及样本量中:采用传统方法扩增两种标记基因所花费的时间以及消耗的DNA样品,均是双重PCR方法的两倍;而如果后期我们可以用通过引物设计、体系优化等方法实现多重PCR,即在一个反应体系内同时扩增3个或3个以上的标记基因,这种差异会更加明显。而在需要对样品进行快速物种鉴定,或是样本材料十分珍贵的情况下,这两点无疑是非常重要的。
准确而丰富的DNA分子序列库对基于DNA序列差异分析的物种鉴定工作十分重要。在本研究中,我们发现家蝇与长翅素木蝗这两头标本的线粒体DNA分别可以比对至两个物种,甚至部分片段的序列一致性高达100%。而更令人吃惊的是,GenBank中已公布的唯一的毛足棒角蝗D.barbipes的线粒体基因组(GenBank登录号: NC_041412),与家蝇的线粒体基因组序列一致性高达99.56%~99.91%,而这些家蝇线粒体基因组测序是由不同作者完成的,因此,我们怀疑毛足棒角蝗D.barbipes已公布的线粒体基因组DNA可能受到了家蝇DNA的污染。另外,我们样本中来自多足纲蚰蜒目蚰蜒科的标本14,其COI序列和16S rDNA序列均未能以高可信度匹配至GenBank中的确切物种。这些结果提示我们,在进一步完善DNA条形码及其他标记基因数据库的同时,我们务必确保样本没有受到外源污染;此外,在对物种进行分子鉴定之前,我们有必要基于形态学对样本进行初步划分,以便应对上述出现的问题。
基于通用引物的双重PCR,可以在较广泛的动物类群中,一次性扩增出单一样本的多条标记基因,可以节省大量时间与材料。对于需要快速准确鉴定物种,或材料样本十分珍贵的情况,双重PCR是很好的选择。
