亚致死浓度溴虫腈和毒死蜱对等钳蠊螨生长繁殖和解毒酶的影响
2020-03-03杨娟生王翠伦侯栋元周浩楠于士将成禄艳傅云梅程明明
杨娟生, 丛 林, 王翠伦, 侯栋元, 周浩楠, 于士将, 成禄艳,雷 双, 傅云梅, 程明明, 冉 春
(西南大学柑桔研究所, 重庆 400712)
等钳蠊螨Blattisociusdentriticus属蜱螨亚纲(Acari)囊螨科(Ascidae),为世界性广布种,在欧洲、亚洲、美洲等多个地区均有分布(Hughes, 1976),在我国上海、浙江、广东、辽宁、四川等也有发现(谢少远等, 2000)。潘纪文(1985)发现,等钳蠊螨可在暗处大量捕食腐食酪螨Tyrophagusputrescentiae。Mashaya(2002)则发现该螨对嗜虫书虱Liposcelisentomophila有一定的捕食效果。郑大睿(2011)进一步研究指出,等钳蠊螨对柑橘全爪螨Panonychuscitri、腐食酪螨T.putrescentiae和茶短须螨Brevipalpusobovatus具有捕食反应,可作为3种害螨的捕食性天敌。
由于药剂的频繁滥用,导致害螨极易产生抗药性,仅依赖药剂防治已不能从根本解决害螨猖獗问题(Khajehalietal., 2011)。1985年,忻介六引进“以螨治螨”的生防手段并运用在果树上,成功利用捕食螨来防治柑橘害螨(忻介六, 1985)。随着“双减”要求的提出和食品安全关注度的日益提高,捕食螨的大面积推广应用已成为绿色农业发展的热点(徐学农等, 2013; 汝阳等, 2017)。但由于生物防治见效慢、制约因素多等问题,现阶段有害生物综合治理仍需药剂防治的辅助。但药剂的使用,就不可避免地造成捕食螨的死亡。
为缓解化学防治和生物防治之间的矛盾,Huffaker和Kennett(1953)开发利用了抗药性捕食螨。关注抗药性捕食螨开发的同时,越来越多的学者致力于杀虫剂对昆虫(螨)的亚致死效应的研究(Howeetal., 2015; 全林发等, 2016)。昆虫(螨)在长期的化学农药亚致死剂量的选择压下,可发展和累积昆虫(螨)的抗药性(Young, 2003; 梁炜博等, 2017; Rugnoetal., 2019)。溴虫腈和毒死蜱目前是柑橘园应用较广、销量较大的杀虫(螨)剂(钟决龙, 2006; 孙国强和陆贻通, 2007),目前尚未发现溴虫腈和毒死蜱对等钳蠊螨生长繁殖及解毒酶影响的研究。为明确农药亚致死剂量对等钳蠊螨的影响,本研究选用溴虫腈和毒死蜱作为供试药剂,通过生物测定、生物化学和分子生物学等方法,分析比较上述两种药剂对等钳蠊螨的影响,旨在为农药的科学使用及等钳蠊螨的田间推广提供理论依据。
1 材料与方法
1.1 供试材料
等钳蠊螨和椭圆食粉螨Aleuroglyphusovatus均为实验室饲养种群,且长期不接触药剂。
1.2 供试药剂及主要仪器
10%溴虫腈(chlorfenapyr)悬浮剂,购自巴斯夫欧洲公司;48%毒死蜱(chlorpyrifos)乳油,购自美国陶氏益农公司;体视显微镜,购自重庆市奥特光学仪器公司;智能人工气候箱,购自Percival公司;酶标仪,购自Thermo Scientific公司;定量PCR仪,购自Analytik Jena公司;酶活性检测试剂盒,购自酶联生物公司;RNA通用提取试剂盒,购自OMEGA公司;反转试剂盒、定量试剂盒,购自Vazyme公司。
1.3 室内毒力测定方法
参照Van Leeuwen等(2005)的药膜法加以改进(下同):将两种药剂分别稀释为6个浓度梯度(溴虫腈: 250.00, 125.00, 83.33, 62.50, 55.56和40.00 mg/L;毒死蜱: 150.00, 80.00, 75.00, 68.57, 56.47, 53.33和46.15 mg/L),用毛笔蘸取药剂均匀涂抹在六孔凹玻片凹槽内壁(凹槽直径1.5 cm,深2.2 mm),放入通风橱自然晾干。每孔放入充足的椭圆食粉螨,转接30头健康的2-3日龄等钳蠊螨成螨,盖上盖玻片,用毛笔蘸取清水涂在盖玻片边缘,防止逃逸。将凹玻片置于智能人工气候箱内(温度25±1℃,相对湿度75%-85%,光周期14L∶10D),24 h后,在体视镜下检查其死亡率。用毛笔尖轻触螨体,无任何反应者视为死亡。每处理3次重复,以清水处理作对照。
1.4 溴虫腈和毒死蜱对等钳蠊螨F0代和F1代的亚致死效应
采用药膜法,选用刚蜕皮6 h以内的成螨,用溴虫腈和毒死蜱LC10和LC30剂量处理24 h后,挑选一对活泼的雌雄成螨(F0)至一洁净的凹槽中饲养,定期补充足量椭圆食粉螨。每隔12 h观察雌成螨的产卵量和产卵期至其自然死亡;挑取F0代在同一天所产的卵30粒于另一干净的凹玻片中,观察其孵化率。挑取F0代同一天产的卵至洁净的凹槽中饲养,在其蜕皮至成螨后,选取雌雄成螨(F1)各1头,进行配对饲养,记录雌成螨寿命、产卵量、产卵期和孵化率,方法同F0代。每剂量30个重复,以清水处理作对照。
1.5 等钳蠊螨解毒酶活力测定
方法与螨态选择同1.4节,用溴虫腈和毒死蜱LC10, LC30和LC50剂量处理尽可能多的成螨24 h后,收集活泼的成螨至新的离心管中,称重后液氮速冻,置于-80℃超低温冰箱中保存,用于酶活力的测定和RNA的提取。每处理3个重复,以清水处理作对照。利用酶联免疫分析试剂盒提取、酶标仪测定等钳蠊螨GST, CYP450和CarE活性。
1.6 RT-PCR
从等钳蠊螨转录组数据库(数据待发表)中筛选出17个解毒酶基因,用DNAMAN 7.0设计相应的上下游引物(表1),利用RT-PCR方法,评价其在溴虫腈和毒死蜱亚致死剂量(LC10, LC30和LC50)胁迫24 h后的相对表达量,材料处理方法同1.5节。以β-actin基因作为内参基因(GenBank登录号: KP310115)(Wangetal., 2018)。PCR反应体系: 2×ChamQ Universal SYBR qPCR Master Mix 10 μL,正反向引物(10 μmol/L)各0.4 μL, cDNA 1.0 μL, ddH2O 8.2 μL。PCR反应程序: 95℃预变性30 s; 95℃变性5 s, 57℃退火30 s, 循环40次; 95℃延伸15 s。以清水处理作对照。用7500 Software v2.0.6分析软件分析和处理数据,采用2-△△Ct法计算基因的相对表达量(Pfaffl, 2001)。
1.7 数据处理
采用农药室内生物测定数据处理系统(武汉市蔬菜科学研究所和农业部农药检定所, 2006)计算致死中浓度等毒力参数;利用SPSS 20.0软件,对各处理组间的数据进行方差显著性分析(ANOVA, Duncan氏多重比较,P<0.05)(Huizingh, 2012)。
2 结果
2.1 溴虫腈和毒死蜱对等钳蠊螨成螨的亚致死剂量
溴虫腈对等钳蠊螨成螨的亚致死剂量LC50, LC30, LC20和LC10分别为42.56, 23.11, 15.97和9.57 mg/L,毒死蜱对等钳蠊螨成螨的亚致死剂量LC50, LC30, LC20和LC10分别为72.42, 49.92, 39.86和29.17 mg/L(表2)。

表1 RT-PCR所用引物

表2 溴虫腈和毒死蜱对等钳蠊螨成螨的室内毒力测定结果
C.L.: 置信区间Confidential limit.
2.2 溴虫腈和毒死蜱对等钳蠊螨的亚致死效应
由表3和表4可知,溴虫腈LC10和LC30剂量处理等钳蠊螨24 h后,F0代雌成螨寿命分别为20.95和21.33 d,较对照(清水处理)明显缩短;LC30剂量下产卵期仅为5.53 d,明显短于对照(P<0.05);在毒死蜱处理后F0代雌成螨寿命和产卵期均明显缩短,LC30剂量下总产卵量明显少于对照(P<0.05);而LC10下则差异不显著(P>0.05)。 两种药剂处理对卵孵化率无明显影响。两种药剂对F1代的总产卵量、产卵期、卵孵化率和寿命均无明显影响(P>0.05)。
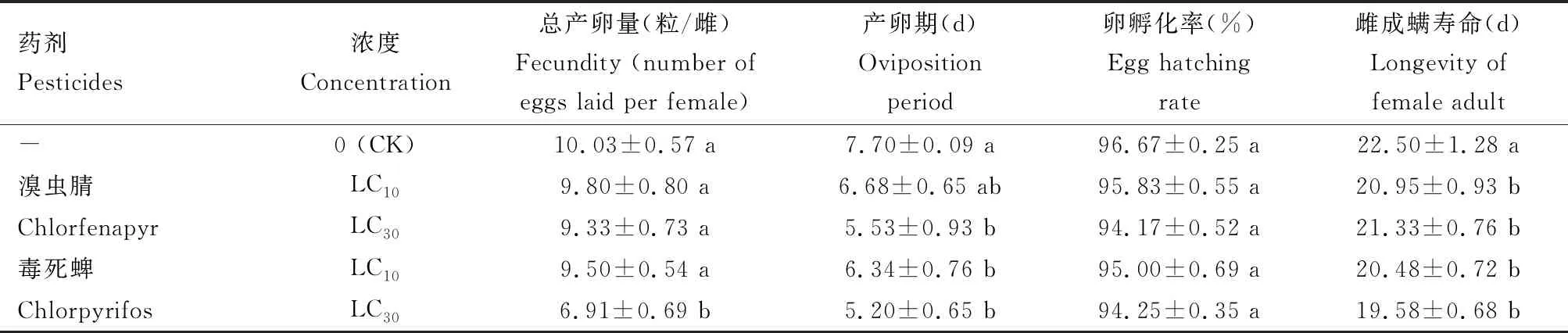
表3 亚致死剂量溴虫腈和毒死蜱对等钳蠊螨F0代雌成螨寿命及产卵特性的影响
CK: 清水处理, 作空白对照Treatment with water as the blank control. 表中数据为平均值±标准差;同列数据后不同的小写字母代表差异显著(P<0.05, Duncan氏多重检验)。Data in the table are mean±SD, and the lowercase letters following the data in the same column represent significant differences (P<0.05, Duncan’s multiple range test). 表3和4同The same for Tables 3 and 4.
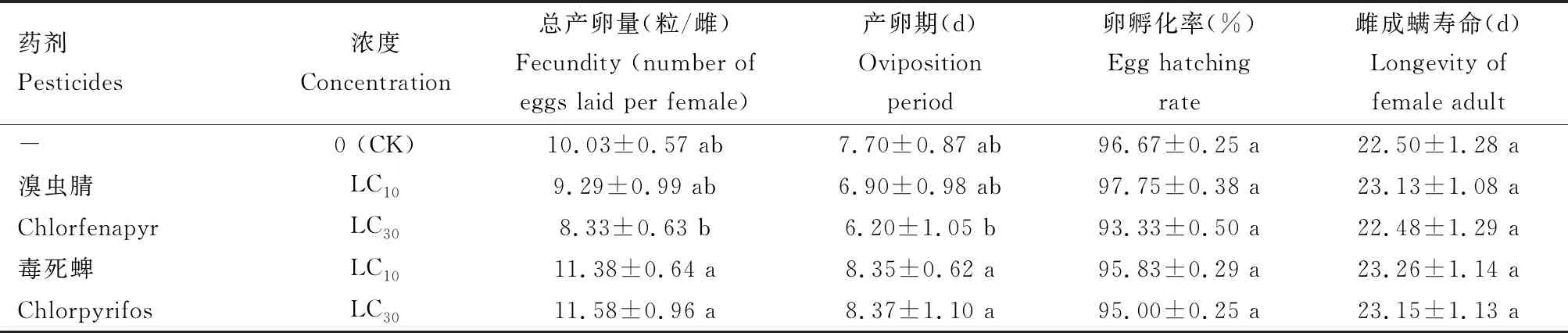
表4 亚致死剂量溴虫腈和毒死蜱对等钳蠊螨F1代雌成螨寿命及产卵特性的影响
2.3 亚致死剂量溴虫腈和毒死蜱对等钳蠊螨解毒酶活性影响
由表5可知,溴虫腈和毒死蜱LC10, LC30和LC50剂量处理等钳蠊螨24 h后,GST, CYP450和CarE 3种酶活力均有不同程度的上升。其中,溴虫腈LC50剂量下,3种酶活力分别为752.80, 1 375.59和198.70 mIU/L,显著高于对照(P<0.05);而其余剂量下则无明显差异(P>0.05)。同样,在毒死蜱LC50剂量下,3种酶活力均显著高于对照(P<0.05);但LC30剂量下,CYP450酶活力1 291.85 mIU/L,显著高于对照(P<0.05);其余处理下3种酶活力差异不明显(P>0.05)。
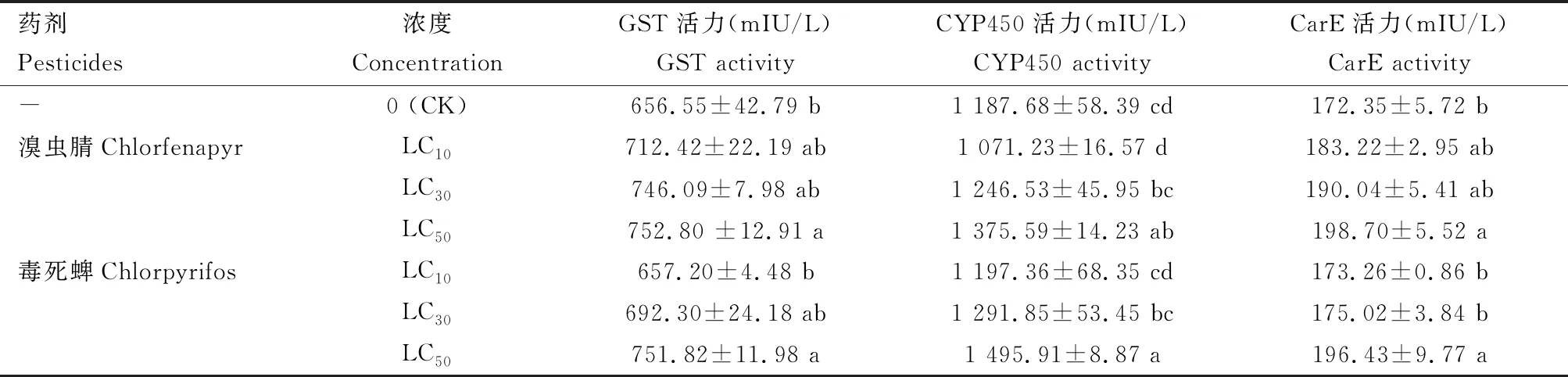
表5 亚致死剂量溴虫腈和毒死蜱对等钳蠊螨成虫GST, CYP450和CarE酶活性的影响
2.4 亚致死剂量溴虫腈和毒死蜱胁迫对等钳蠊螨体内解毒酶基因表达的影响
2.4.1对GST基因表达的影响:由图1(A)可知,溴虫腈处理下,随着剂量增加,等钳蠊螨BdGST3和BdGST6表达量均显著高于对照(P<0.05);在LC10和LC30剂量下其余GST基因表达量差异不明显(P>0.05),但LC50剂量下较对照明显增加(P<0.05)。由图1(B)可知,在毒死蜱LC10, LC30和LC503个剂量下,等钳蠊螨BdGST1,BdGST3和BdGST4基因表达量均明显高于对照(P<0.05);BdGST2和BdGST6基因在LC10剂量下表达量无明显变化(P>0.05),但LC30和LC50剂量下较对照明显增加(P<0.05);BdGST5基因在LC10和LC30剂量下表达量变化不明显(P>0.05),而LC50剂量下相对表达量高达5.76,明显高于对照(P<0.05)。

图1 亚致死剂量溴虫腈(A)和毒死蜱(B)处理下等钳蠊螨成虫GST基因相对表达量
2.4.2对CYP450基因表达的影响:在溴虫腈和毒死蜱3个剂量胁迫下,等钳蠊螨CYP450基因表达情况如图2所示。在溴虫腈3个剂量胁迫下,BdCYP1基因表达量较对照明显下调(P<0.05);BdCYP2,BdCYP3和BdCYP4基因表达量随浓度变化均显著上调(P<0.05);在LC10和LC30剂量下BdCYP5和BdCYP6表达量无明显变化(P>0.05),但LC50剂量下上调明显(P<0.05)(图2: A)。毒死蜱3个剂量胁迫下,BdCYP2,BdCYP5和BdCYP6基因表达量较对照明显上调(P<0.05);BdCYP4基因无明显变化(P>0.05);BdCYP1和BdCYP4基因在LC10剂量下表达量略有下调,但无明显差异(P>0.05);BdCYP4基因表达量在LC30和LC50剂量下无明显变化(P>0.05),而BdCYP1基因表达量则在LC50剂量下明显上调(P<0.05)(图2: B)。
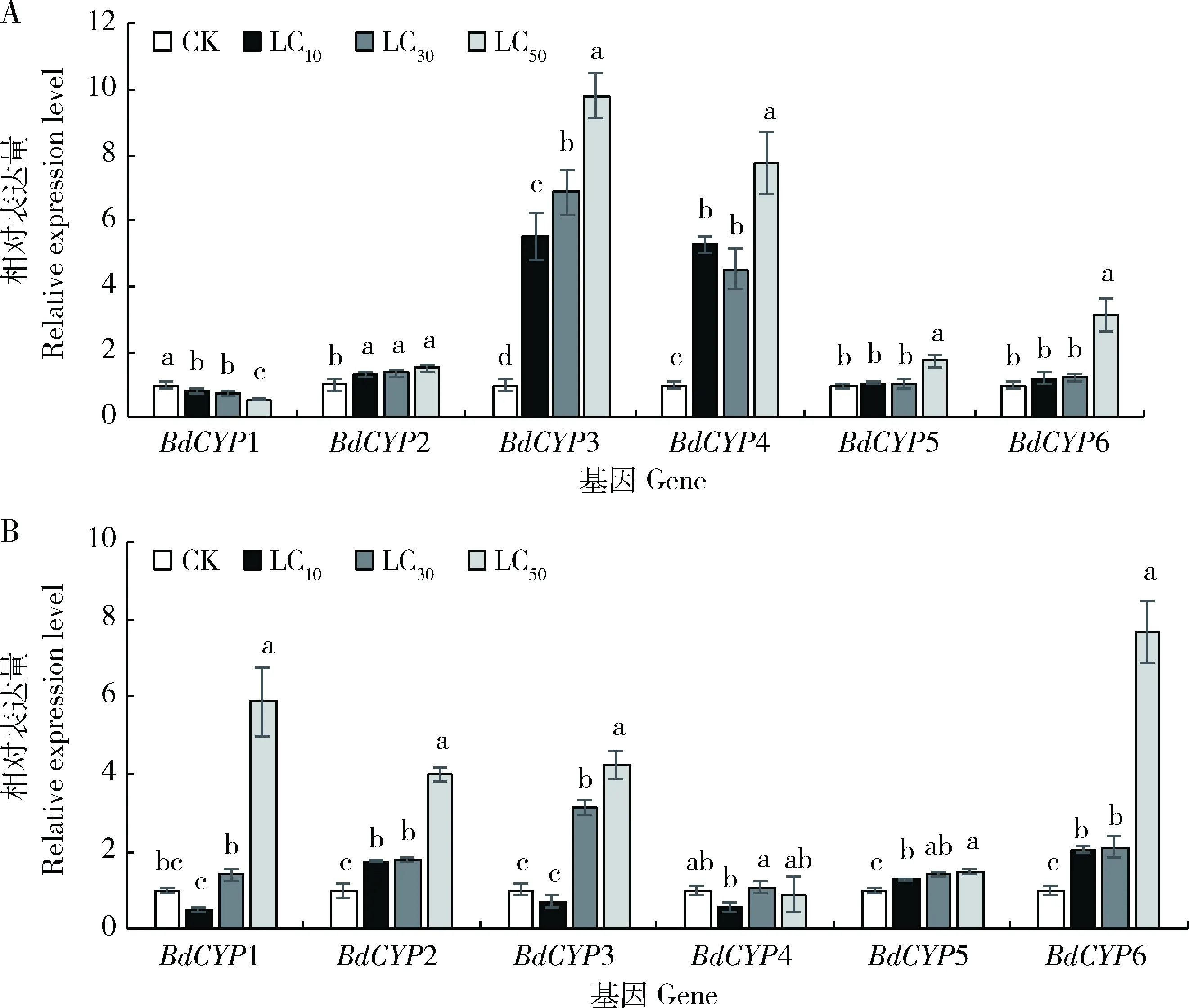
图2 亚致死剂量溴虫腈(A)和毒死蜱(B)处理下等钳蠊螨成虫CYP450基因的相对表达量
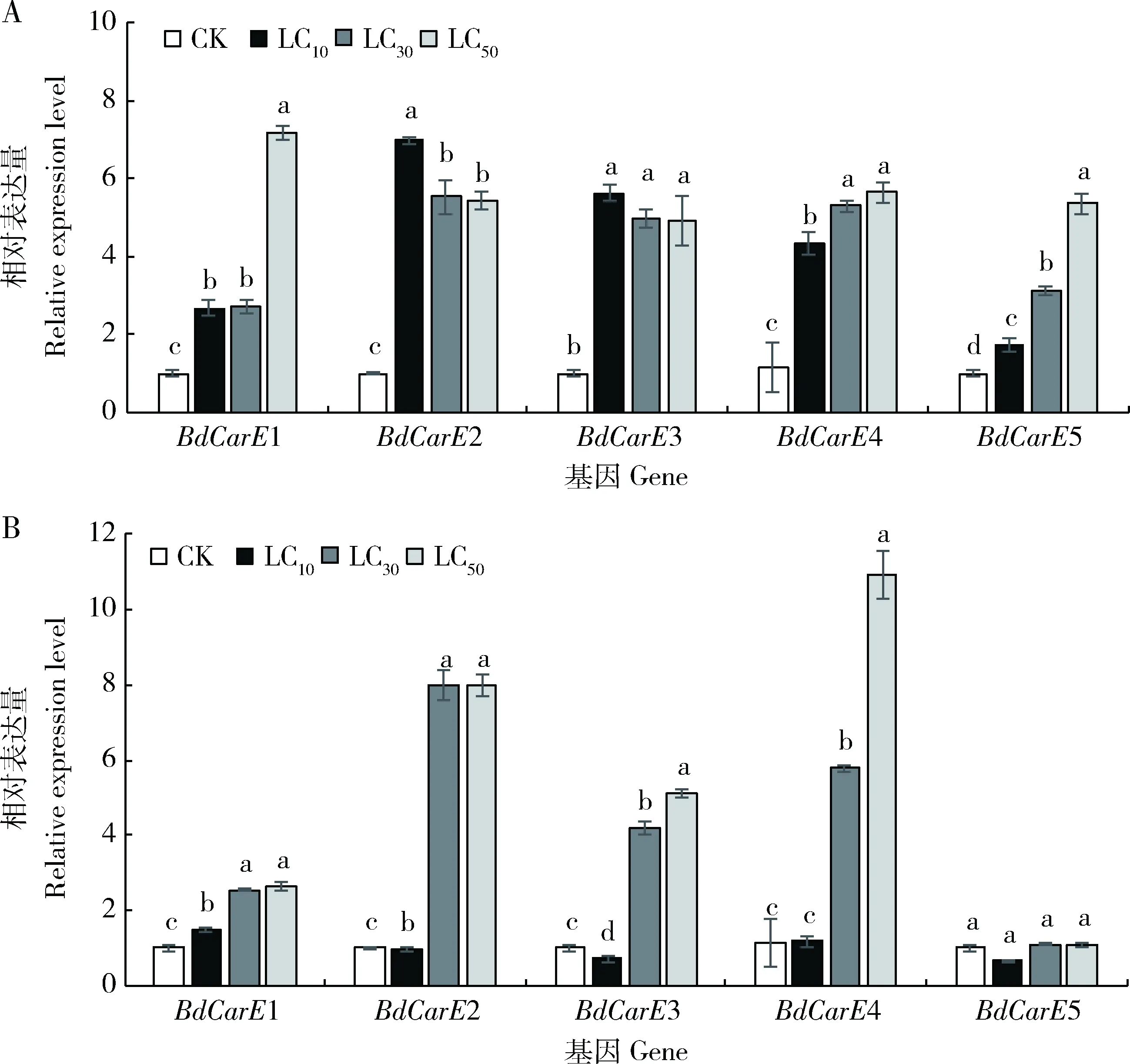
图3 亚致死剂量溴虫腈(A)和毒死蜱(B)处理下等钳蠊螨成虫CarE基因的相对表达量
2.4.3对CarE基因表达的影响:溴虫腈和毒死蜱LC10, LC30和LC50剂量处理后5个脂酶基因表达情况如图3所示,溴虫腈处理下BdCarE1,BdCarE4和BdCarE5基因表达量随浓度的增加均显著上调(P<0.05);BdCarE2和BdCarE3基因表达量均高于对照,在LC10剂量下分别为对照的6.97和5.62倍,但在LC30剂量开始却出现下调现象(P<0.05)(图3: A)。毒死蜱处理下BdCarE1基因表达量随浓度增加明显上调(P<0.05);LC10处理下BdCarE4基因表达量与对照相比差异不明显(P>0.05),而在LC30和LC50剂量处理下表达均显著上调(P<0.05);BdCarE5基因表达量与对照相比无明显差异(P>0.05)(图3: B)。
3 讨论
农药亚致死效应可导致昆虫(螨)的生长发育、繁殖等特性的改变(Delpuechetal., 1998)。例如,在二斑叶螨Tetranychusurticae的研究中发现,溴虫腈亚致死剂量处理后,其F0代的寿命和产卵期出现缩短的现象(Sani Bozhganietal., 2018)。家蚕幼虫经溴虫腈处理后,其F0代生长发育未受影响,但其茧层量却显著升高(罗雁婕等, 2011)。而利用毒死蜱LC10和LC25处理褐飞虱3龄若虫后,其F0代和F1代卵孵化率显著降低。在对柑橘全爪螨的研究中也发现,利用甲氰菊酯亚致死剂量处理其若螨后,当代雌成螨(F0代)产卵量增加,其后代F1代和F2代产卵前期缩短,后代雌雄性比增大;而阿维菌素处理却导致F0-F2代产卵量显著降低(何恒果等, 2016)。本研究也证实,溴虫腈和毒死蜱亚致死剂量处理后会导致等钳蠊螨F0代雌成螨寿命和产卵期缩短,对F1代的寿命及产卵等生物学特性无明显影响。由此可见,溴虫腈和毒死蜱亚致死剂量短期会降低该螨的繁殖速度和防治效果,但对下一代生长繁殖无影响,不会大幅影响其种群数量变化。文中溴虫腈的亚致死剂量值由于试验浓度设置偏高可能有偏差,但对后续评价无明显影响,可为等钳蠊螨抗性筛选及科学应用提供理论依据。
亚致死效应不仅对昆虫(螨)的生物学特性会有影响,也会对其体内多种解毒代谢酶产生诱导或抑制作用(尹显慧等, 2008; 张文成等, 2009)。在韭菜迟眼蕈蚊Bradshawodoriphaga4龄幼虫研究中发现,经溴虫腈LC10, LC20和LC50处理后,其GST, CarE和O-demethylation活性显著上升(Zhaoetal., 2018),说明溴虫腈亚致死剂量可诱导这3种酶的活性。在二斑叶螨经阿维菌素LC10和LC20处理24 h后,其GST, MFO和CarE活力均显著高于对照(汝阳等, 2017)。认为这3种酶在巴氏新小绥螨体内均被诱导。不同药剂胁迫对昆虫体内相关代谢酶影响不尽相同。用噻虫胺LC15和LC30处理桃蚜Myzuspersicae24 h后,CarE活力较对照分别上升1.29和1.36倍,而GST的活力则被抑制(抑制率分别为11.9%和22.7%)(任学祥等, 2017)。在本研究中,溴虫腈和毒死蜱LC50剂量处理24 h后等钳蠊螨GST, P450和CarE活性均高于对照,在LC30剂量下P450酶活力分别为1 246.53和1 291.85 mIU/L,较对照明显上升(P<0.05)(表5)。表明3种酶活力在受到药剂胁迫时明显被诱导,GST, P450和CarE可能是等钳蠊螨体内代谢或水解溴虫腈和毒死蜱的重要酶系。
在基因表达量的研究中也证实,药剂亚致死剂量还会影响昆虫(螨)体内基因表达。在二化螟Chilosuppressalis的研究中发现,经氯虫苯甲酰胺亚致死剂量处理其5龄幼虫后,CsGSTd1,CsGSTd2和CsGSTt1等10个GST基因表达明显上调,表明这些基因可能参与了其对氯虫苯甲酰胺的解毒代谢(金燕璐等, 2018)。在巴氏新小绥螨的研究中也有发现,经阿维菌素LC10和LC30处理常温品系后,发现其GST3,GST4,CYP1,CYP2,CarE1和CarE2基因可能参与了其对阿维菌素的解毒代谢(胡琴, 2017)。而CYP4G62,CYP6EL1和CYP9AQ1则可能在飞蝗对马拉硫磷的解毒代谢过程中发挥重要作用(于荣荣等, 2012)。本实验对17个等钳蠊螨基因在溴虫腈和毒死蜱胁迫24 h后的mRNA表达水平进行了相对定量分析,发现溴虫腈处理后BdGST3,BdGST6,BdCYP3和BdCYP4以及5个CarE基因(BdCarE1-5)表达量均显著上调(P<0.05),毒死蜱处理后BdGST1,BdGST3,BdGST4,BdCYP2,BdCYP3,BdCYP4,BdCarE1和BdCarE3基因表达明显上调(P<0.05)(图1-3)。研究结果表明,溴虫腈和毒死蜱亚致死剂量同时诱导了等钳蠊螨多个解毒或代谢抗性基因表达上调,由此推断,等钳蠊螨对溴虫腈和毒死蜱的抗性可能是一个复杂的过程,可能与多种基因表达上调有关。研究结果为进一步研究等钳蠊螨对溴虫腈和毒死蜱的抗性机制提供了思路。
