漂洗和斩拌对海鲈鱼肌球蛋白理化特性的影响
2020-03-03林婉玲刘芳芳李来好吴燕燕杨少玲杨贤庆
林婉玲,刘芳芳,李来好,吴燕燕,杨少玲,黄 卉,杨贤庆,林 织
漂洗和斩拌对海鲈鱼肌球蛋白理化特性的影响
林婉玲1,2,刘芳芳1,3,李来好1※,吴燕燕1,杨少玲1,黄 卉1,杨贤庆1,林 织4
(1. 中国水产科学研究院南海水产研究所,国家水产品加工技术研发中心,农业农村部水产品加工重点实验室,广州 510300;2. 韩山师范学院食品工程与生物科技学院,潮州 521041;3.上海海洋大学食品学院,上海 201306;4. 广东顺欣海洋渔业集团有限公司,阳江 529800)
为探究漂洗和斩拌对海鲈鱼肌球蛋白理化特性的影响,分别提取原料、漂洗鱼糜、斩拌鱼糜的肌球蛋白,通过测定总巯基、活性巯基、表面疏水性、浊度等基本性质,并结合红外光谱和原子力显微镜(atomic force microscope,AFM)技术对肌球蛋白二级结构和表面形貌进行研究。结果表明:相比原料,漂洗鱼糜肌球蛋白总巯基含量降低19.5%,活性巯基增大63.9%,而斩拌鱼糜肌球蛋白总巯基和活性巯基的质量分数相比漂洗鱼糜分别降低22.6%和66.8%,漂洗鱼糜的肌球蛋白变性程度最大;肌球蛋白浊度和表面疏水性在经过漂洗和斩拌均增大,漂洗对表面疏水性影响更大,斩拌对浊度影响更大;红外光谱研究结果显示,漂洗对二级结构影响更明显,原料经过漂洗后,-螺旋相对含量降低了33.16%,无规则卷曲相对含量增加了79.42%,-折叠和-转角分别增加1.11%和10.38%,斩拌后,鱼糜肌球蛋白二级结构变化率较低;漂洗和斩拌都可改变肌球蛋白的表面形貌,使肌球蛋白聚集簇明显减小,聚集高度增加。研究结果证明,漂洗和斩拌对肌球蛋白理化特性有很大的影响,是鱼糜具有更好的凝胶性能的重要步骤。
蛋白;鱼;检测;肌球蛋白;变性聚集;二级结构;表面形貌
0 引 言
加热条件下,肌原纤维蛋白在盐的作用下水溶性增强,肌球蛋白结构展开,失去其非共价稳定结构,随后分子间又相互缔合,并结合大量的游离水分子,形成具有弹性的凝胶体[1]。肌球蛋白占肌原纤维蛋白总量的50%~55%[2],是肉中含量最高的一种蛋白质,也是肌肉中唯一可以单独通过加热即可形成凝胶的蛋白质[3],凝胶性、持水性等作为肉类产品重要的特性,与肌球蛋白理化性能有着密切的联系[4],肌球蛋白在肌肉蛋白凝胶和肉的结合中发挥着主要的作用,并且肌球蛋白在体外不稳定,即使在低温下也能在溶液中自发聚集[5-6],进而影响蛋白质凝胶性能。因此对肌球蛋白结构和变性聚集受加工条件的影响研究,有助于指导肉制品的加工。目前已有大量研究表明,肌球蛋白在加热过程中巯基(总巯基、活性巯基)、浊度、表面疏水性以及结构都会发生变化[7-8]。活性巯基含量的变化在一定程度上可以反应肌球蛋白的变性程度[9],而浊度反应溶液中不溶悬浮颗粒的大小和数量,可以粗略地估计蛋白质的聚集程度。但是,目前关于漂洗和斩拌等工艺对肌球蛋白这些理化特性的影响的研究较少。漂洗和斩拌是鱼糜加工过程中重要工艺,对鱼糜品质的形成有重要的作用。已有研究表明,经过两次漂洗,白鲢鱼肌球蛋白交联反应程度明显增大[10]。另外也有研究发现,随着斩拌时间延长,鱼肉蛋白质粒径先减小后增大,证明斩拌会使蛋白质变性聚集,形成微凝胶[11],同时斩拌可以使蛋白质的构象发生改变,并且鱼糜凝胶性能与蛋白质构象紧密相关[12]。因此,为了研究鱼糜加工过程中蛋白质凝胶特性的变化,进一步研究漂洗与斩拌对揭示肌球蛋白在鱼糜加工过程中凝胶变化有重要意义。
原子力显微镜(atomic force microscope,AFM)与普通的显微镜相比具有明显的优势,比如原子级高分辨率,横向分辨率达到1 nm,纵向分辨率达到0.1 nm,作为一种新型的检测蛋白质聚集的方法,其可观测物质表面的形貌特征,扫描图也可反应蛋白质的聚集情况,因此可利用该技术检测肌球蛋白聚集平面状态下的三维图像[13],更直观的表示肌球蛋白在漂洗和斩拌过程中的变性聚集情况。因此,本文利用原子力显微镜对漂洗和斩拌过程造成的肌球蛋白聚集形态进行研究,并结合浊度、巯基、疏水性以及蛋白质二级结构变化等对肌球蛋白理化性质变化进行分析,以期为肌球蛋白的变性聚集的研究提供参考意见。
1 材料与方法
1.1 材料与试剂
海鲈鱼(),购自于广州市海珠区华润万家超市,平均质量700 g。
食盐、白砂糖,食品级,广州海珠区客村华润万家超市;乙二醇双(2-氨基乙基醚)四乙酸(EGTA)、三磷酸腺苷二钠(ATP-Na2)、5、5′-二硫代双(2-硝基苯甲酸)(DTNB)、乙二胺四乙酸(EDTA)、8-苯胺-1-萘磺酸(ANS)以及其余常见试剂均为分析纯,广州领驭生物科技有限公司;BeyoColorTM彩色预染蛋白,购于上海碧云天生物技术有限公司;三羟甲基氨基甲烷(Tris),分析纯,美国Sigma公司;-巯基乙醇、十二烷基硫酸钠(SDS),电泳级,上海麦克林生化科技有限公司。
1.2 主要仪器与设备
绞肉机,广东省佛山市顺德区陈村镇恒基隆五金机械厂;打浆机,湖南省长沙固利食品机械有限公司;IKA-T25组织匀浆机,德国IKA公司;HH-4快速恒温数显水浴箱,常州澳华仪器公司;Sunrise-basic吸光酶标仪,德国TECAN公司;Alpha1-4冷冻干燥机,德国Christ公司;IRAffinity-1红外光谱仪,日本岛津公司;3K30台式高速冷冻离心机,德国Sigma公司。
1.3 试验方法
1.3.1 鱼糜制作
将鲜活海鲈鱼在20 min内运回实验室,冰晕后宰杀清洗并取肉,并进行漂洗(水洗1次、0.2%盐洗1次,每次4 min,肉液比1:4),制成漂洗鱼糜,然后进行挤压脱水,保持含水率低于80%,再进行斩拌(空斩5 min后加入食盐(1%)和白砂糖(1%)继续斩拌10 min,斩拌温度在4~10 ℃),制成斩拌鱼糜,备用。
1.3.2 肌球蛋白提取
根据Park等[14]的方法,略微修改,为了防止蛋白质变性和蛋白质水解,所有用于制备肌球蛋白的溶液要在4 ℃下进行保存。称取样品,加入10倍体积的试剂A(0.1 mol/L KCl和20 mmol/L Tris-HCl缓冲液,pH值为7.5)。用分散匀浆器11 000 r/min条件下将其进行均质1 min。混合物在4 ℃下放置15 min,利用3K30高速冷冻离心机在3 000 g下离心5 min。向所得沉淀物中加入5倍体积的试剂B(含0.45 mol/L KCl、5 mmol/L-巯基乙醇、0.2 mol/L醋酸镁(Mg(CH3COO)2)、1 mmol/L乙二醇-双-(2-氨基乙基)四乙酸(EGTA)和20 mmol/L Tris-HCl缓冲液,pH值为6.8);再加入ATP-Na2使其成为最终浓度为5 mmol/L的悬浮液,使肌球蛋白与肌动蛋白解离,在4 ℃下放置60 min。上述悬浮液在12 000 g下离心10 min。取出上清液,加入5倍体积的1 mmol/L KHCO3进行缓慢稀释,在4 ℃下保存15 min。再将此混合物在20 000 g下离心10 min所得沉淀物用2.5倍体积的试剂C(含0.5 mol/L KCl和5 mmol/L-巯基乙醇的20 mmol/L Tris-HCl缓冲液,pH值为7.5);进行悬浮。所得悬浮液在4 ℃下保存10 min,再缓慢加入2.5倍体积的1 mmol/L KHCO3。同时,加入MgCl2使其最终浓度为10 mmol/L。将形成的混合物在4 ℃下保存12 h,然后在20 000 g下离心15 min,取沉淀物,即为肌球蛋白。沉淀物用1倍体积溶液D(含0.6 mol/L NaCl的20 mmol/L Tris-HCl缓冲液,pH值为7.0)溶解,即为肌球蛋白溶液。
1.3.3 肌球蛋白纯度鉴定
将提取的肌球蛋白溶液质量浓度调至2 mg/mL,并与2×上样缓冲液1∶1混合,沸水浴5 min,然后12 000 r/min、4 ℃离心5 min得到上清液用于电泳。marker上样量为5L,样品上样量为10L,分离胶为10%,浓缩胶为4%,以80 V恒压是样品在浓缩胶部分浓缩成一条线,然后将电压切换至120 V,在恒压下直至溴酚蓝指示剂到达分离胶边缘,电泳结束,染色液为0.1%的考马斯亮兰R-250-乙醇冰醋酸溶液;脱色液为水-乙醇冰醋酸溶液。最后用quantity one软件进行蛋白纯度分析。
1.3.4 浊度
参考Cao等[15],将肌球蛋白浓度调节至1 mg/mL,在340 nm测定吸光值,以吸光值来表达肌球蛋白浊度大小。
1.3.5 总巯基和自由巯基的测定
参考Wei等[16],略作修改。
总巯基:移取0.5 mL 4 mg/mL的肌球蛋白溶液,加入4.5 mL 0.2 mol/L Tris-HCl(含8 mol/L尿素,2%SDS,10 mmol/L EDTA,pH值为6.8)的缓冲液,震荡混匀,并加入0.5 mL 0.1%DTNB(0.1 gDTNB溶于100 mL 0.2 mol/L Tris-HCl,pH值为8.0)缓冲液中,4 ℃避光反应1 h,于412 nm处测定吸光值。
自由巯基:移取0.5 ml 4 mg/mL的肌球蛋白溶液,加入4.5 mL 0.2 mol/L Tris-HCl不含尿素的缓冲液,震荡混匀,其余操作同上。
巯基计算公式:
SH(mol/105g)=×÷(×)(1)
式中为412 nm处的吸光值,为稀释倍数,本方法中为11,为摩尔消光系数,为13 600 L/(mol×cm),C为蛋白浓度,4 mg/mL。
1.3.6 表面疏水性的测定
参考Yongsawatdigul等[17],采用ANS法测定,用0.6 mol/L NaCl的20 mmol/L Tris-HCl,pH值为7.0的缓冲液将所提取的肌球蛋白溶液进行梯度稀释,浓度为0.062 5、0.125、0.25、0.5、1 mg/mL,在激发波长380 nm,发射波长470 nm条件下利用酶标仪测定荧光强度,利用蛋白浓度-荧光强度作图,表面疏水性S0-ANS以蛋白浓度-荧光强度曲线斜率表示。
1.3.7 肌球蛋白二级结构的测定(红外光谱)
参考林婉玲等[18],首先将肌球蛋白溶液调节至相同的蛋白浓度(10 mg/mL),然后在−80 ℃冰箱中冻结4 h以上,然后置于真空冷冻干燥机中干燥直至肌球蛋白样品完全干燥为止,即得到肌球蛋白冻干样品。红外光谱的测定是将肌球蛋白冻干样品与提前干燥的无水溴化钾以1:100充分研磨混匀,然后压片。测定条件为分辨率4 cm-1,室温下重复扫描24次,扫描范围4 000~400 cm-1。扫描结果用Peak fit 4.12软件进行去卷积,高斯拟合,分析蛋白质二级结构。
1.3.8 原子力显微镜(AFM)
样品前处理:将肌球蛋白溶液稀释至20g/mL,准确吸取10L蛋白溶液滴于直径为1 cm的圆形云母片上,室温条件下在超净台上自然干燥,形成蛋白质吸附层,然后用超纯水冲洗吸附层以消除盐分的干扰,继续自然干燥,制成测试样品。蛋白质颗粒的粒径可以用干燥状态下从云母片基底表面到蛋白质颗粒表面的垂直距离表示,原子力显微镜扫描图可以反映蛋白质的聚集程度。
AFM成像:AFM探针为商用氮化硅针尖,操作模式为分子力模式,共振频率为150~200 kHz,弹性系数为5 N/m。本试验图像扫描范围均为3m×3m,每个样品至少选取10个不同区域进行扫描,确保得到可重复的高质量图像,所有图像均在NanoScope Analysis离线软件上进行,图片先进行Flatten平整化处理,以消除慢扫描方向上的低频噪音造成的倾斜、扭曲、跳线等的影响,对每条扫描线进行补偿,使得到的图像更加真实。
1.3.9 数据分析
所有数据均采用Origin 9.0和Excel 2010进行作图,试验数据用SPSS 22.0统计软件进行分析,结果用平均值±标准差来表示,多组数据之间的差异用单因素ANOVA检验两两比较的Duncan’s比较模型,<0.05表示差异显著。
2 结果与讨论
2.1 肌球蛋白纯度
提取的海鲈鱼原料、漂洗鱼糜、斩拌鱼糜的肌球蛋白的SDS-PAGE图如图1所示,通过quantity one软件进行蛋白纯度分析得知,提取的肌球蛋白纯度大于80%,可作为本试验原料使用。
2.2 巯基和活性巯基
漂洗和斩拌对肌球蛋白的变性和聚集都有一定的影响,巯基作为肌球蛋白中具有最高反应活性的基团,与其结构的稳定性密切相关,并且巯基含量的变化可以反应蛋白质的氧化变性程度[19]。其中总巯基包括活性巯基和隐藏巯基[20],总巯基指暴露在蛋白表面和埋藏在蛋白分子内的巯基,而活性巯基指暴露在蛋白分子表面的巯基[21]。

注:1、2、3分别代表海鲈原料、漂洗鱼糜、斩拌鱼糜肌球蛋白电泳条带,MHC、MLC分别代表肌球蛋白重链和肌球蛋白轻链。
如图2所示,漂洗和斩拌后鱼糜肌球蛋白总巯基含量显著下降19.5%(<0.05),从新鲜肉的8.51 mol/105g分别减少到6.85和5.3 mol/105g,而活性巯基在漂洗过程中显著增加,从1.39增加到3.86 mol/105g,增大了63.9%,后经斩拌减小到1.28 mol/105g,活性巯基与总巯基在漂洗阶段的比值为0.56,显著大于原料和斩拌期间的比值。相比漂洗鱼糜,斩拌鱼糜肌球蛋白总巯基和活性巯基的质量分数分别降低22.6%和66.8%,在蛋白质中,总巯基含量下降表明活性巯基氧化生成二硫键,活性巯基的增加表明蛋白质结构的伸展[22],活性巯基与总巯基的比值可以反映蛋白质三级结构的解折叠程度,并且其比值与蛋白质解折叠度呈正相关关系[23]。这主要是由于漂洗过程中活性氧攻击蛋白质,并且含有巯基的半胱氨酸属于氧化敏感氨基酸,经过氧化易形成二硫化物。

图2 漂洗和斩拌对肌球蛋白巯基的影响
因此,可以推断漂洗可以造成肌球蛋白变性伸展,使埋藏在蛋白质内的巯基暴露,从而活性巯基增加,并且部分被氧化形成二硫键,造成总巯基含量降低。漂洗鱼糜经过斩拌后肌球蛋白活性巯基和总巯基都显著降低(<0.05),这主要是因为随着斩拌的进行,变性蛋白质会聚集形成微凝胶,而蛋白质聚合体的形成会掩盖一些巯基,从而使检测到的活性巯基显著降低,总巯基含量的降低与二硫键的形成有关,而二硫键的形成有利于蛋白质凝胶的稳定。这一结果也与活性巯基与总巯基的比值研究结果一致,肌球蛋白在漂洗时解折叠度最大,变性最明显,而经过斩拌肌球蛋白解折叠度显著降低。另外巯基的氧化也会导致肌球蛋白表面疏水性的增加,变性程度增强,因此有必要进一步研究漂洗和斩拌对肌球蛋白表面疏水性的影响。
2.3 表面疏水性
蛋白质的表面疏水性是用来反映蛋白质分子内部疏水基团的暴露程度,一般情况下,这些疏水氨基酸残基主要分布在蛋白质分子内部,并对肌球蛋白尾部的双螺旋结构起着稳定的作用,在蛋白质变性时,分布在蛋白质内部的疏水基团就会暴露,并且疏水基团暴露越多,肌球蛋白的表面疏水性越大,因此通常将表面疏水性作为研究肌球蛋白的变性程度的另外一个指标。漂洗和斩拌对肌球蛋白表面疏水性的影响如图3,漂洗后,鱼糜肌球蛋白表面疏水性显著增大,从395增加到759 S0-ANS,增加了47.9%,证明漂洗可以使肌球蛋白内部疏水氨基酸残基暴露,肌球蛋白变性程度较大,但是有研究表明,0.5%盐水漂洗,会使高白鲑鱼肌原纤维蛋白表面疏水性显著降低[24],因此可以推测造成肌球蛋白表面疏水性显著增大是由于冷水漂洗的结果。而斩拌鱼糜肌球蛋白相比漂洗鱼糜,表面疏水性仅增加5%,差异不显著,这主要是由于随着斩拌的进行,变性展开的蛋白质会发生部分聚集,抑制了蛋白结构内疏水基团的暴露[25],与巯基研究结果一致。
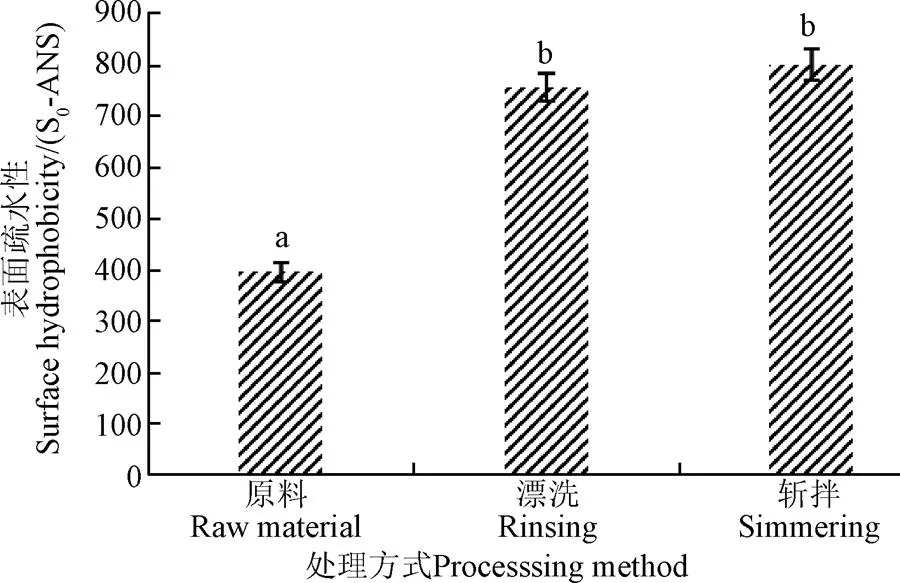
图3 漂洗和斩拌对肌球蛋白表面疏水性的影响
2.4 浊 度
通常外界环境的变化会改变蛋白质表面的微环境,从而造成蛋白质构象的改变,一般是蛋白质二级结构的转变,-螺旋的解折叠也是肌球蛋白聚集的原因,蛋白聚集后,蛋白质颗粒增大,使光发生散射,引起溶液浊度增加。溶液的浊度与溶液中包含的单个的粒子所造成的浑浊程度有关,粒子包括悬浮物以及不溶解的颗粒,与溶液的透过率成反比关系。由图4知,漂洗和斩拌均使肌球蛋白浊度增大,相比原料,漂洗后鱼糜肌球蛋白浊度增大了12.5%,漂洗鱼糜在经过斩拌后,肌球蛋白浊度增大了22.2%,而浊度反映的是肌球蛋白颗粒的大小,可以粗略估计肌球蛋白的聚集,根据前文巯基及表面疏水性分析知,漂洗和斩拌均会造成蛋白质的不同程度的变性和聚集,当肌球蛋白发生变性时,蛋白质分子之间逐渐发生了肽链的展开、交联、聚集、絮凝等变化,从而使体系浊度逐渐上升[26],因此斩拌对肌球蛋白浊度的影响相比漂洗的更大,即斩拌更易造成肌球蛋白的聚集。
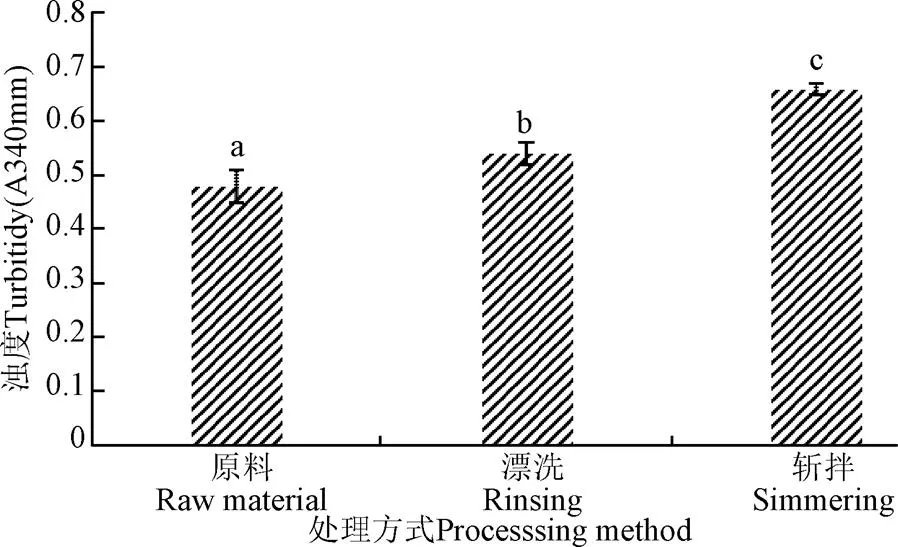
图4 漂洗和斩拌对肌球蛋白浊度的影响
2.5 红外光谱测定结果
由于在蛋白质中,表面疏水性和活性巯基含量的改变都意味着蛋白质二级结构可能发生了变化[27],因此为进一步研究漂洗和斩拌对肌球蛋白变性和聚集的影响,有必要对其二级结构变化进行研究。傅里叶红外光谱在测定蛋白质二级结构中发挥着重要的作用,蛋白内部不同的结构会选择性吸收不同的红外波长,从而产生不同的特征吸收峰。如图5,是不同处理条件下海鲈肌球蛋白的红外光谱图。傅里叶变换红外光谱图可提供蛋白质酰胺I带、酰胺II带、酰胺III带信息以及蛋白质结构中的C-C振动和C=O等振动信息,酰胺I带吸收峰是由蛋白多肽骨架的伸缩振动而引起的,位于之间1 700~1 600 cm-1波段之间,对蛋白质二级结构变化较敏感,通常用于分析蛋白质二级结构相对含量的变化。对酰胺I带去卷积,进行高斯拟合得到各个子峰,其中各子峰与蛋白质二级结构的对应关系为:1 600~1 640 cm-1是-折叠;1 640~1 650 cm-1是无规卷曲;1 650~1 660 cm-1是-螺旋;1 660~1 695 cm-1是-转角。利用相对面积变化来计算蛋白质二级结构相对含量的变化,漂洗和斩拌对肌球蛋白二级结构相对含量的变化如图6所示。

图5 肌球蛋白红外光谱图

图6 肌球蛋白二级结构相对含量变化
不同处理方式对肌球蛋白二级结构相对含量的影响如图6,-螺旋和-折叠是主要的二级结构,又因为-螺旋和-折叠中含有较多的氢键,是较有序、规则的结构,因此可以推测鱼肉经过漂洗和斩拌处理后,肌球蛋白结构仍相对稳定。相比原料,漂洗鱼糜肌球蛋白-螺旋相对含量从40.20%降低到30.19%,降低了33.16%,无规则卷曲相对含量从8.41%增加到15.09%,增加了79.42%,-折叠和-转角变化率相对较小,分别增加1.11%和10.38%;斩拌对肌球蛋白二级结构的影响相比于漂洗较不明显,-螺旋和无规则卷曲相对含量分别下降1.16%和7.95%,-折叠和-转角分别增加4.16%和1.92%,并且-折叠和-转角结构是凝胶形成的基础,两者含量的增高有利于良好凝胶结构的形成[28],同时-螺旋含量的下降有利于蛋白质的聚集,肌球蛋白作为唯一可以单独加热形成凝胶的蛋白,对蛋白质凝胶的形成起着至关重要的作用,因此漂洗和斩拌对于蛋白质的凝胶的形成有着重要的作用。
2.6 漂洗和斩拌对肌球蛋白表面形貌的影响
2.6.1 缓冲液AFM成像
图7为缓冲液即肌球蛋白溶解液(pH值为7.0,0.6 mol/L NaCl的20 mmol/L Tris-HCl缓冲液),由图可知,缓冲液表面无明显杂质,证明在超净台自然干燥时未被尘埃污染,其对应的3维图进一步说明云母片表面较为平整,溶液颗粒细小,无直径较大的聚集体。

图7 缓冲液AFM图像
2.6.2 不同处理条件下肌球蛋白AFM图像
AFM图像可以提供蛋白质表面形态的高分辨率成像,这是研究肌球蛋白聚集特征的重要因素,通过2D图像、3D图像和横截面图像观察海鲈鱼原料以及经过漂洗和斩拌的鱼糜的肌球蛋白聚集体的表面形态(图8)。

注:从左至右依次为:2D图、左图沿线中相应的截面分析、3D图。 Note: From left to right are 2D image, section analyses along the corresponding lines, 3D graph.
已有研究证明,肌球蛋白在生理条件下呈现单体或可溶性低聚物[29],由图8a可知,海鲈鱼原料在未经任何处理的条件下表现出完整的肌球蛋白束,并且肌球蛋白在悬浮液中的均匀分布,无明显颗粒状存在,与鸡胸肌肌原纤维蛋白外观一致[30]。然而王艳敏等[31]研究表明,未加热的鲢鱼天然肌球蛋白以单体或小聚集体的形式吸附在云母片的表面,Guo等[32]研究表明,金线鱼肌球蛋白在天然状态下呈现珠状,因此可以推测不同鱼种肌球蛋白在天然状态下结构有所差异。蛋白在漂洗(图8b)和斩拌(图8c)后,肌球蛋白开始以低聚物的形式存在,通过高度图像的截面分析,肌球蛋白悬浮液中聚集体的高度从14 nm经过漂洗明显增高到高于25 nm,斩拌后,肌球蛋白聚集体高度略有下降,但不明显,如图8所示。另外经过斩拌,肌球蛋白颗粒聚集簇明显减小,且分布更加均匀。因此在漂洗和斩拌过程中,肌球蛋白是变性和聚集共同存在的过程,又因为蛋白质解聚是加热进一步聚集成簇状聚合物的前提,通过原子力显微镜的研究,进一步证实了漂洗和斩拌是蛋白质加热形成具有良好凝胶性能的重要前处理步骤。
3 结 论
漂洗和斩拌作为鱼糜加工过程中的重要步骤,相比原料,漂洗鱼糜肌球蛋白总巯基减少了19.5%,活性巯基、浊度和表面疏水性分别增大了63.9%、12.5%和47.9%,肌球蛋白变性程度较大;而斩拌过程中活性巯基减少了66.8%,肌球蛋白变性程度减弱,漂洗对表面疏水性影响更大,斩拌对浊度影响更大;漂洗对鱼糜肌球蛋白二级结构影响更显著,尤其是对-螺旋和无规则卷曲结构,-螺旋相对含量降低了33.16%,无规则卷曲相对含量增加了79.42%,斩拌后肌球蛋白二级结构变化相对不明显;漂洗和斩拌均可以造成肌球蛋白表面形貌发生变化,漂洗后,肌球蛋白聚集簇明显减小,而聚集高度显著增大,斩拌后肌球蛋白聚集簇进一步减小,聚集高度变化不明显。因此,漂洗和斩拌对肌球蛋白的基本理化性质以及变性和聚集有很大的影响,是鱼糜加工过程中重要的前处理过程。
[1]Xu X L, Han M Y, Fei Y, et al. Raman spectroscopic study of heat-induced gelation of pork myofibrillar proteins and its relationship with textural characteristic[J]. Meat Science, 2011, 87(3): 159-164.
[2]Samejima K, Hashimoto Y, Yasui T, et al. Heat gelling properties of myosin, actin, actomyosin and myosin-subunits in a saline model system[J]. Journal of Food Science, 2010, 34(3): 242-245.
[3]Samejima K, Hashimoto Y, Yasui T, et al. Heat gelling properties of myosinactin, actomyosin and myosin-subunits in a saline model system[J]. on Academic, 1969, 34(3): 242-245.
[4]Hayakawa T, Yoshida Y, Yasui M, et al. Heat-induced gelation of myosin in a low ionic strength solution containing L-histidine[J]. Meat Science, 2012, 90(1): 77-80.
[5]高霞,曹立伟,熊善柏,等. 不同质量浓度鲢鱼肌球蛋白低温自组装动力学及理化性质[J]. 食品科学,2019,40(1):1-8.
Gao Xia, Cao Liwei, Xiong Shanbai, et al. Self-assembly kinetics and physicochemical properties of silver carp myosin under conditions with different concentrations and low temperature[J]. Food Science, 2019, 40(1): 1-8. (in Chinese with English abstract)
[6]Brenner T, Johannsson R, Nicolai T. Characterization of fish myosin aggregates using static and dynamic light scattering[J]. Food Hydrocolloids, 2009, 23(2): 296-305.
[7]Chan J K, Gill T A, Thompson J W, et al. Herring surimi during low temperature setting, physicochemical and textural properties[J]. Journal of Food Science, 1995, 60(6): 1248-1253.
[8]Gill T A, Chan J K, Phonchareon K F, et al. Effect of salt concentration and temperature on heat-induced aggregation and gelation of fish myosin[J]. Food Research International, 1992, 25(5): 333-341.
[9]Ding Y, Liu R, Rong J, et al. Heat-induced denaturation and aggregation of actomyosin and myosin from yellowcheek carp during setting[J]. Food Chemistry, 2014, 149: 237-243.
[10]王金余,刘承初,赵善贞,等. 白鲢鱼糜肌球蛋白交联反应和凝胶化最适条件的研究[J]. 食品科学,2008,29(11):223-227.
Wang Jinyu, Liu Chengchu, Zhao Shanzhen, et al. Optimal conditions for maximal cross-linkage of myosin heavy chain (MHC) and gelation of surimi product from silver carp (Hypophthalmichtys molitrix)[J]. Food Science, 2008, 29(11): 223-227. (in Chinese with English abstract)
[11]Ducept F, De Broucker T, Souliè J M, et al. Influence of the mixing process on surimi seafood paste properties and structure[J]. Journal of Food Engineering, 2012, 108(4): 557-562.
[12]李贤. 破碎方式对鱼糜凝胶特性的影响[D]. 武汉:华中农业大学,2014.
Li Xian. Effect of Broken Methods on Surimi Gel Properties[D]. Wuhan: Huazhong Agricultural University, 2014. (in Chinese with English abstract)
[13]Ikeda S, Morris V J, Nishinari K. Microstructure of aggregated and nonaggregated κ-carrageenan helices visualized by atomic force microscopy[J]. Biomacromolecules, 2001, 2(4): 1331-1337.
[14]Park J, Lanier T. Scanning calorimetric behavior of tilapia myosin and actin due to processing of muscle and protein purification[J]. Journal of Food Science, 1989, 54: 49-51.
[15]Cao H, Jiao X, Fan D, et al. Microwave irradiation promotes aggregation behavior of myosin through conformation changes[J]. Food Hydrocolloids, 2019, 96: 11-19.
[16]Wei L, Cao L, Xiong S, et al. Effects of pH on self-assembly of silver carp myosin at low temperature[J]. Food Bioscience, 2019, 30: 100420.
[17]Yongsawatdigul J, Park J W. Thermal denaturation and aggregation of threadfin bream actomyosin[J]. Food Chemistry, 2003, 83(3): 409-416.
[18]林婉玲,杨贤庆,李来好,等. 浸渍冻结对调理草鱼冻藏过程中肌原纤维蛋白特性的影响[J]. 南方水产科学,2016,12(3):67-73.
Lin Wanling, Yang Xianqing, Li Laihao, et al. Immersion freezing effect on myofibrillar protein characteristics of prepared grass carp () fillets during frozen storage[J]. South China Fisheries Science, 2016, 12(3): 67-73. (in Chinese with English abstract)
[19]He X H, Liu H Z, Liu L, et al. Effects of high pressure on the physicochemical and functional properties of peanut protein isolates[J]. Food Hydrocolloids, 2014, 36: 123-129.
[20]Benjakul S, Sutthipan N. Muscle changes in hard and soft shell crabs during frozen storage[J]. LWT- Food Science and Technology, 2009, 42(3): 723-729.
[21]Hamada M, Ishizaki S, Nagai T. Variation of SH content and kamaboko-gel forming ability of shark muscle protein by electrolysis[J]. Journal of Shimonoseki University of Fisheries, 1994, 42: 131-135.
[22]Ko W C, Yu C C, Hsu K C. Changes in conformation and sulfhydryl groups of tilapia actomyosin by thermal treatment[J]. LWT-Food Science and Technology, 2007, 40(8): 1316-1320.
[23]冯芳,刘文豪,陈志刚. 大豆7S、11S蛋白的结构与热致凝胶特性的研究[J/OL].食品科学:1-11[2019-07-03]. http://kns.cnki.net/kcms/detail/11.2206.ts.20190409.1521.064. html.
[24]高泽磊. 防止蛋白质氧化引起高白鲑肌肉劣变的技术研究[D]. 石河子:石河子大学,2017.
Gao ZeLei. Study on the Technology to Prevent Protein Oxidation Caused the Deterioration of Coregonus Peled Muscle[D]. Shihezi: Shihezi University, 2017. (in Chinese with English abstract)
[25]李婷,周春霞,冯瑞,等. 硫酸葡聚糖对低离子强度下罗非鱼肌球蛋白热变性聚集的抑制及其机制[J]. 食品与机械,2018,34(12):5-10.
Li Ting, Zhou Chunxia, Feng Rui, et al. Inhibition of heat-induced aggregation of Tilapia myosin by dextran sulfate at low ionic strength[J]. Food & Machinery, 2018, 34(12): 5-10. (in Chinese with English abstract)
[26]姜启兴. 鳙鱼肉热加工特性及其机理研究[D]. 无锡:江南大学,2015.
Jiang Qixing. Study on Thermal Processing Properties and Mechanism of Bighead Carp() Muscle[D]. Wuxi: Jiangnan University, 2015.
[27]Chen H H, Xu S Y, Wang Z. Interaction between flaxseed gum and meat protein[J]. Journal of Food Engineering, 2007, 80(4): 1051-1059.
[28]Kang Z L, Wang P, Xu X L, et al. Effect of beating processing, as a means of reducing salt content in frankfurters: A physico-chemical and Raman spectroscopic study[J]. Meat Science, 2014, 98(2): 171-177.
[29]Shimada M, Takai E, Ejima D, et al. Heat-induced formation of myosin oligomer-soluble filament complex in high-salt solution[J]. International Journal of Biological Macromolecules, 2015, 73: 17-22.
[30]Chen X, Xu X, Zhou G. Potential of high pressure homogenization to solubilize chicken breast myofibrillar proteins in water[J]. Innovative Food Science & Emerging Technologies, 2016, 33: 170-179.
[31]王艳敏,于加美,石彤,等. 原子力显微镜研究L-半胱氨酸对鲢肌球蛋白溶液热聚集行为的影响[J]. 食品科学,2018,39(14):1-8.
Wang Yanmin, Yu Jiamei, Shi Tong, et al. Influence of l-cysteine on the heat-induced aggregation of bighead carp myosin studied by atom force microscope[J]. Food Science, 2018, 39(14): 1-8. (in Chinese with English abstract)
[32]Guo Z, Li Z, Wang J, et al. Gelation properties and thermal gelling mechanism of golden threadfin bream myosin containing CaCl2 induced by high pressure processing[J]. Food Hydrocolloids, 2019, 95: 43-52.
Effects of rinsing and mashing on physical and chemical properties of myosin in sea bass
Lin Wanling1,2, Liu Fangfang1,3, Li Laihao1※, Wu Yanyan1, Yang Shaoling1, Huang Hui1, Yang Xianqing1, Lin Zhi4
(1.,,510300; 2.,521041,; 3.,,201306; 4..,.,529800,)
The physicochemical properties, such as total sulfhydryl (T-SH) group, active sulfhydryl (R-SH) group, surface hydrophobicity and turbidity, were determined for the myosin that extracted separately from the raw materials, rinsed- and simmer surimi in sea bass, while the secondary structure and surface morphology of the myosin were analyzed using the combined techniques including the infrared spectroscopy and atomic force microscopy (AFM). The experimental results showed that the content of total sulfhydryl (T-SH) groups in the myosin of the rinsed surimi decreased by 19.5% from 8.51 to 6.85 mol/105g, whereas the active sulfhydryl group increased by 63.9% from 1.39 to 3.86 mol/105g, compared with the raw materials. The content of total sulfhydryl (T-SH) and active sulfhydryl (R-SH) groups in the myosin of the simmer surimi decreased to 5.3 and 1.28 mol/105g compared with the raw materials, indicating decrease by 22.6% and 66.8%, respectively. The ratio of the active sulfhydryl (R-SH) to the total sulfhydryl (T-SH) group in the myosin of the rinsed surimi is the largest than others, inferring that the myosin of the rinsed surimi can be the most deformed in this case. The turbidity and surface hydrophobicity, the indictor for the aggregation and degree of denaturation in proteins, in the myosin of the surimi increased after the treatment of rinsing and simmering. Specifically, the turbidity of the myosin in the surimi increased by 12.5% after rinsing and 22.2% after simmering, compared with raw materials , whereas the surface hydrophobicity increased by 47.9% after rinsing and 5% after simmering. The data reveal that the treatment of the rinsing and simmering can significantly affect the denaturation and aggregation of proteins in the varying level. The rinsing has a greater influence on the surface hydrophobicity, while the mixing effect has a greater influence on the turbidity. The simmering can cause the slight aggregation of the myosin to form a sort of microgel. There was a much more obvious effect of the rinsing on the secondary structure of the myosin. In Fourier transform of the infrared spectroscopy the-helix relative content of the myosin that extracted can decreased by 33.16%, while the random curl relative content increased by 79.42%,-fold and-turn increased by 1.11% and 10.38%, respectively, after the rinsing of raw materials in the sea bream. After rinsing, the change rate of the secondary structure in the surimi myosin was smaller, and the-helix and random curl content decreased by 1.16% and 7.95%,-fold and-turn increased by 4.16% and 1.92%, respectively. Generally, the decrease in the-helix content can be conducive to the aggregation of proteins, and the increase in-sheet and-turn can be beneficial to the formation of the good gel structure. The characterized results from atomic force microscopy (FAM) showed that the myelin myosin exhibited a sort of protein bundle under the natural conditions, and the distribution of the protein bundle in the suspension was uniform without obvious granularity. Both treatment of the rinsing and simmering can change the surface morphology of the myosin in the sea bass, indicating reduce significantly the aggregation clusters of the myosin, while increase the height of the aggregates in the myosin suspension from 14 nm to 25 nm. After mixing, the height of the myosin aggregates did not change significantly. These findings demonstrate that the treatment of the rinsing and simmering have a great influence on the physicochemical properties of the myosin in rinsed and simmer surimi of the sea bass, as well as a certain effect on the degeneration and aggregation of the myosin suspension. This study can be expected to provide potential reference for the future development on the formation mechanism of surimi gel in food industry.
protein; fish; monitoring; myosin; degeneration and aggregation; secondary structure; surface morphology
林婉玲,刘芳芳,李来好,吴燕燕,杨少玲,黄 卉,杨贤庆,林 织. 漂洗和斩拌对海鲈鱼肌球蛋白理化特性的影响[J]. 农业工程学报,2020,36(1):310-317.doi:10.11975/j.issn.1002-6819.2020.01.037 http://www.tcsae.org
Lin Wanling, Liu Fangfang, Li Laihao, Wu Yanyan, Yang Shaoling, HuangHui, Yang Xianqing, Lin Zhi. Effects of rinsing and mashing on physical and chemical properties of myosin in sea bass[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2020, 36(1): 310-317. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2020.01.037 http://www.tcsae.org
2019-08-20
2019-12-25
“十二五”国家重点研发计划(2016YFD0400201-6);中央级公益性科研院所基本科研业务费专项资金项目(2019TS16);现代农业产业技术体系专项(CARS-47);“扬帆计划”引进创新创业团队专项(2015YT02H109)
林婉玲,博士,副研究员,研究方向为水产品加工与质量安全研究。Email:lwlscsf@163.com
李来好,博士,研究员,研究方向为水产品加工与质量安全。Email:laihaoli@163.com
10.11975/j.issn.1002-6819.2020.01.037
TS254.4
A
1002-6819(2020)-01-0310-08
