超声波诱变对猴头菇粗多糖的影响
2020-03-02张帅程昊邱彩霞陈贤如
张帅,程昊,邱彩霞,陈贤如
1(肇庆学院 食品与制药工程学院,广东 肇庆,526601) 2(广西科技大学 生物与化学工程学院,广西糖资源绿色加工重点实验室,广西 柳州,545006) 3(蔗糖产业省部共建协同创新中心,广西 南宁,530004)
猴头菇(Hericiumerinaceus)是一种珍贵的食药两用的大型食用菌,富含多糖、蛋白质、维生素及微量元素等多种营养和功效成分[1-3],尤其是猴头菇多糖因具有较强的抗氧化、抑菌、增强免疫力、抗疲劳等多种生理活性而常用于保健食品的研发[4-5]。提高食用菌中多糖的含量及活性成为当前食用菌领域研究的重点和热点,菌种诱变技术或许是解决这一问题的一种有效方法。目前关于猴头菇诱变方法的报道较多,如紫外线、60Co-γ射线、离子束注入及交变磁场诱变等[6-10],但采用超声波诱变猴头菇尚未见报道。
超声波诱变的原理是通过超声波的机械作用、热作用、空化作用产生的高温高压来破坏微生物细胞壁结构并引起组织细胞内物质运动,从而使DNA突变率增加。超声波穿透性好,诱导时不用开盖诱导,这样可减少微生物污染的几率。同时,超声波诱变法操作简单,安全性高,经济实惠,一般实验室条件都可达到[11-14]。本研究通过对猴头菇超声波诱变处理,考察了超声波诱变对猴头菇粗多糖含量及其抑菌效果的影响,不仅为提高猴头菇粗多糖含量和抑菌活性提供了一种简单可行的方法,而且为其他食用菌中粗多糖等活性成分的提高提供了方法借鉴,这对于食用菌行业的发展以及食用菌产品的深加工具有重要意义。
1 材料与方法
1.1 菌种和培养基
猴头菇菌种,本学院食品微生物实验室试管保藏;PDA培养基,购自广东环凯微生物科技有限公司,依说明书配好后分装试管和平面皿,灭菌后做成PDA斜面和PDA平板若干,冷藏备用。
液体种子培养基组成:可溶性淀粉5%、蔗糖1%、KH2PO40.3%、Mg2SO4·7H2O 0.15%、酵母膏0.1%,pH 6.0。液体发酵培养基组成:葡萄糖2.2%、麸皮1%、KH2PO40.5%、MgSO4·7H2O 0.1%、酵母膏0.05%、蛋白胨0.02%。原种培养基组成:棉籽壳75%、木屑10%、麸皮13%、蔗糖1%、石膏1%。栽培培养基组成:棉籽壳45%、木屑41%、麸皮12%、蔗糖1%、石膏1%。细菌固体培养基组成:牛肉膏0.3%、蛋白胨0.5%、NaCl 0.5%、琼脂2%。细菌液体培养基组成:除不加琼脂外,其他同细菌固体培养基。上述培养基中所有百分数均为质量百分比。
1.2 主要仪器设备
YQ-120B型超声波清洗机,上海易净超声波仪器有限公司;DGX-9143 B-1电热恒温鼓风干燥箱:上海福玛实验设备有限公司;UV-1240紫外分光光度计,岛津企业管理(中国)有限公司;HH-6数显恒温水浴箱,江苏金坛市环宇科学仪器厂;XB-10B高速多功能粉碎机,东莞市隆鑫机电设备有限公司。
1.3 方法
1.3.1 猴头菇菌悬液制备
取PDA斜面保藏的猴头菇菌种,用无菌接种铲取一块约0.5 cm2接入到10 mL液体种子培养基中,于25℃培养3 d,即得猴头菇菌悬液。
1.3.2 猴头菇超声波诱变
将猴头菇菌悬液稀释至106CFU/mL,取若干试管分别装入10 mL稀释后的菌悬液,置于40 kHz、300 W超声波清洗机中进行诱导,分组诱导2、4、6、8、10 min,各平行3次。每支试管各取0.1 mL稀释液涂于不同PDA平板中,25oC培养7 d。以未超声诱变处理的猴头菇菌悬液为对照组,计算致死率,见公式(1):

(1)
1.3.3 猴头菇变异菌株初筛
从致死率为70%~95%的平板中, 挑取各平板萌发最早、生长最旺盛的菌落,转接到PDA斜面中,作为猴头菇变异菌株。待PDA斜面长满菌丝体后,接到PDA平板中,25 ℃培养7 d。根据对猴头菇菌丝体的生长势、菌丝密度、菌丝色泽、边缘整齐度的评分,选出总分比原始菌株高的变异菌株。
1.3.4 猴头菇变异菌株复筛
原始菌株与经1.3.3挑选出的猴头菇变异菌株,分别接入液体种子培养基进行培养,25 ℃培养3 d后,分别取15 mL接入200 mL液体发酵培养基中,25 ℃培养15 d,得猴头菇发酵液。通过测定猴头菇发酵液中菌丝体的生物量和粗多糖含量,筛选出生物量最大、粗多糖含量最高的猴头菇变异菌株。
1.3.4.1 猴头菇菌丝体生物量测定
将猴头菇发酵液于离心机中4 000 r/min离心10 min,取沉淀猴头菇菌丝体,洗涤3次后于65 ℃烘干至恒重,计算猴头菇发酵液中菌丝体的生物量,见公式(2):

(2)
1.3.4.2 葡萄糖标准曲线的建立
精确称取干燥恒重的葡萄糖0.1 g,用蒸馏水定容于100 mL容量瓶中,然后吸取10 mL再定容于100 mL容量瓶,得到0.1 mg/mL的标准葡萄糖溶液。采用苯酚-硫酸法[15],按表1完成操作后,摇匀放置5 min,置沸水浴中加热15 min,然后冷却至室温,于490 nm 波长处测定吸光度。最终建立葡萄糖标准曲线为y=12.675x-0.011 3,相关系数R2=0.999 2,在0.01~0.06 mg/mL葡萄糖含量与吸光度呈良好线性关系。

表1 苯酚-硫酸法葡萄糖标准曲线
1.3.4.3 猴头菇菌丝体粗多糖的测定
将经1.3.4.1处理后的猴头菇菌丝体粉碎,过30目筛,精确称重。用热水浸提[16],固液比1∶10,浸提温度90 ℃,浸提时间2.5 h,过滤去渣,浸提液用Sevag法[17-18]除蛋白后,得到猴头菇菌丝体粗多糖溶液,然后稀释至合适浓度即得样品液。准确吸取样品液1 mL,按1.3.4.2的方法测定吸光度,计算样品液的粗多糖含量,见公式(3):
粗多糖含量/[g·(100g)-1]=
(3)
1.3.5 猴头菇袋料栽培
将猴头菇原始菌株和经1.3.4复筛出的变异菌株进行袋料栽培[19],通过比较不同猴头菇的生长情况,考察猴头菇超声波诱变是否有价值。
1.3.6 猴头菇子实体粗多糖的测定
将猴头菇子实体65℃烘干至恒重,粉碎,过30目筛,精确称重。用热水浸提[20],固液比1∶10,浸提温度80℃,浸提时间3 h,过滤去渣,浸提液用Sevag法除蛋白后,得到猴头菇子实体粗多糖溶液,然后稀释至合适的浓度即得样品液。准确吸取样品液1 mL,按照1.3.4.2的方法测定吸光度,并计算样品液的粗多糖含量,见公式(4):
粗多糖含量/[g·(100g)-1]=
(4)
1.3.7 滤纸片法测定猴头菇粗多糖的抑菌效果
1.3.7.1 猴头菇子实体粗多糖溶液的制备
按照1.3.6的方法制备猴头菇原始菌株、变异菌株子实体粗多糖溶液。
1.3.7.2 猴头菇粗多糖滤纸片的制备
用打孔机将普通定性滤纸打成直径为5.0 mm圆形纸片,放进干燥洁净的培养皿内,经121 ℃、30 min高压灭菌后,放入干燥箱内干燥[21]。取干燥后的普通定性滤纸片,分别放进体积相同的猴头菇原始菌株、变异菌株的子实体粗多糖溶液,浸润30 min后备用。
1.3.7.3 参照菌种菌悬液的制备
将金黄色葡萄球菌、大肠杆菌和枯草芽孢杆菌作为参照菌种进行活化,然后将参照菌种分别接入10 mL细菌液体培养基中,37 ℃培养24 h。然后各进行10倍递增稀释,稀释成一系列浓度梯度,各参照菌种菌悬液的每个浓度各取0.1 mL涂布于细菌固体培养基平板并培养24 h,选取恰能铺满平板的菌悬液备用。
1.3.7.4 猴头菇粗多糖抑菌效果测定
对1.3.7.3选出的参照菌种菌悬液,各取0.1 mL均匀涂布于平板上,再贴上在猴头菇子实体粗多糖溶液中浸润的滤纸片,每个平板贴4片滤纸片,均匀间隔,轻压纸片,于37 ℃培养 24 h,观察抑菌圈,并用十字交叉法测量抑菌圈直径。
2 结果与分析
2.1 诱变时间对猴头菇的影响
由表2可知,猴头菇菌悬液经超声波处理不同时间后,菌落最早萌发时间均会提前1~2 d,说明超声波诱变可加速菌落萌发。随着诱变时间的延长,猴头菇菌落萌发数降低,致死率升高。从致死率为70%~95%的平板中,挑选出萌发时间最早和生长最旺盛的菌落,分别编号H-1、H-2、H-3、H-4、H-5、H-6、H-7、H-8、H-9作为猴头菇变异菌株,猴头菇原始菌株编号为H。
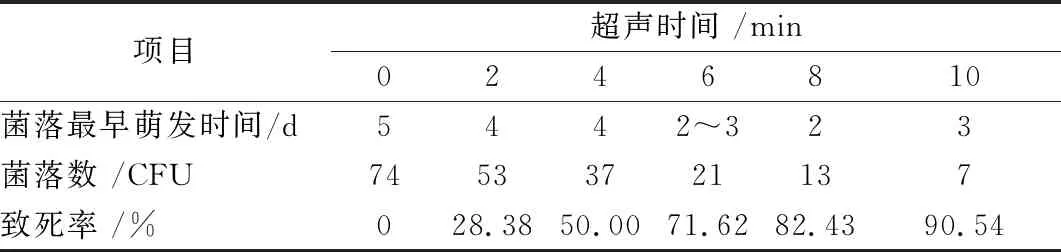
表2 诱变时间对猴头菇的影响
2.2 猴头菇变异菌株初筛结果
将上述编号为H、H-1、H-2、H-3、H-4、H-5、H-6、H-7、H-8、H-9的猴头菇菌株进行平板培养,通过对生长势、菌丝密度、菌丝色泽及边缘整齐度的评分,选出比原始菌株H评分高的变异菌株。结果见表3和图1。
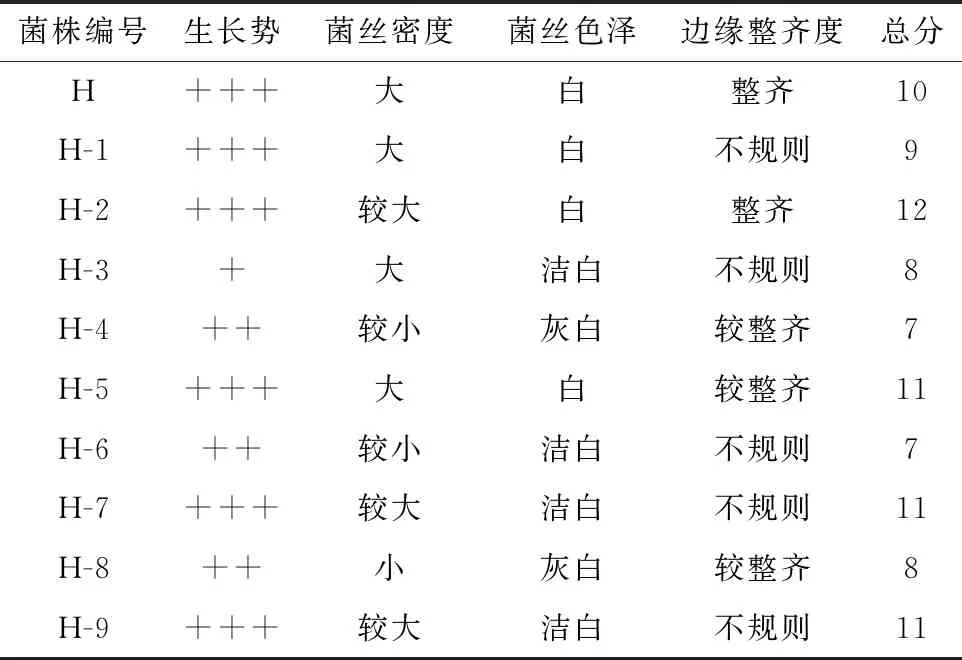
表3 猴头菇菌株生长情况的比较
注:评分标准:生长势“+++”为3分,“++”为2分,“+”为1分;菌丝密度“较大”为4分,“大”为3分,“小”为2分,“较小”为1分;菌丝色泽“洁白”为3分,“白”为2分,“灰白”为1分;边缘整齐度“较整齐”为3分,“整齐”为2分,“不规则”为1分。
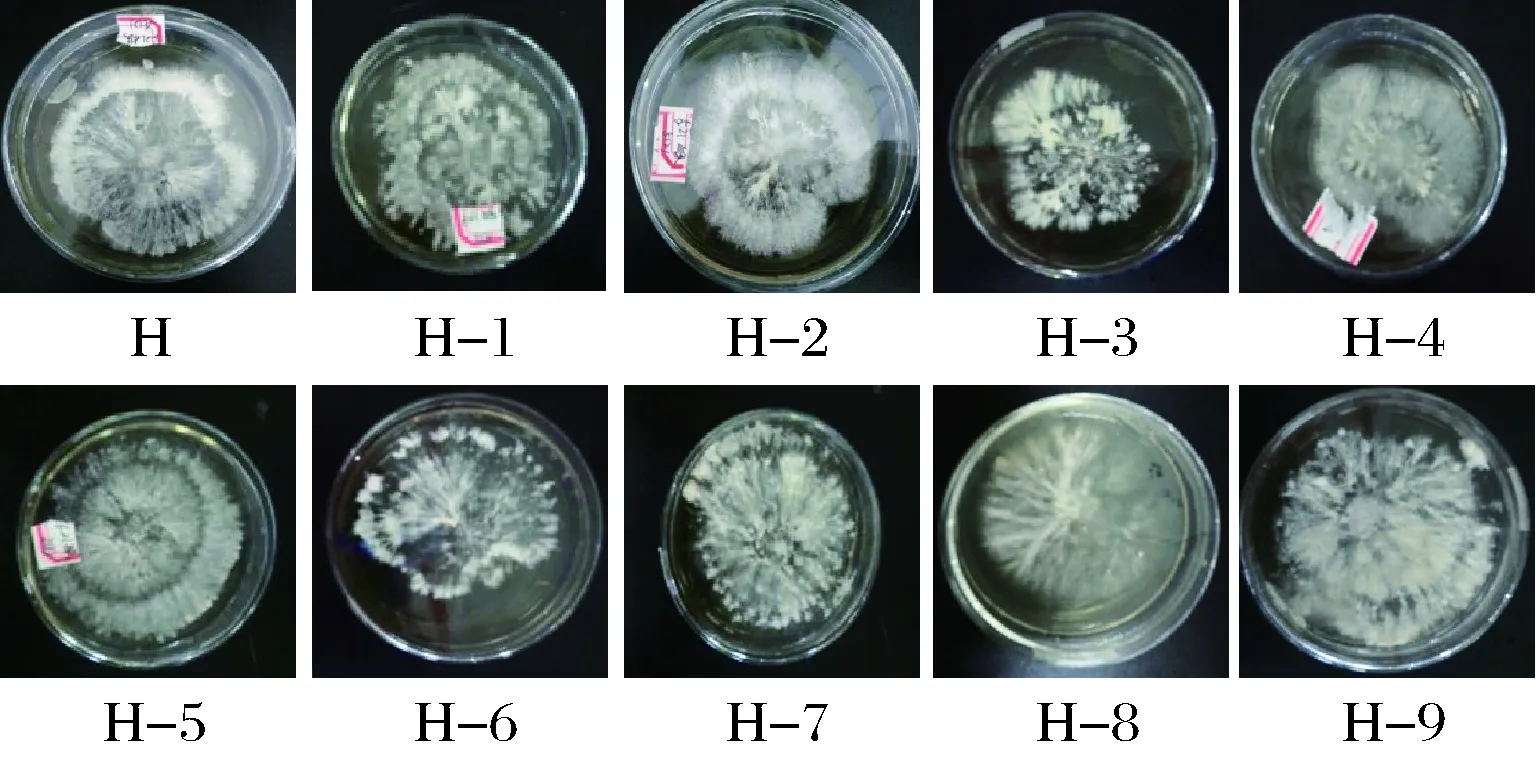
图1 猴头菇菌株生长情况比较
可见,猴头菇菌悬液经超声波诱导后,其生长势、菌丝密度、菌丝色泽及边缘整齐度均发生了明显变化。由表3和图1可见,猴头菇菌丝密度比较大的,其边缘整齐度大都呈不规则状;而菌丝密度小、菌丝色泽浅的,其边缘则都比较整齐。最终筛选出评分比原始菌株H高的猴头菇变异菌株为:H-2、H-5、H-7、H-9。
2.3 猴头菇变异菌株复筛结果
将编号为H-2、H-5、H-7、H-9的猴头菇变异菌株进行液体培养,挑选出生物量最大、菌丝体多糖含量最高的猴头菇变异菌株。结果如表4。
由表4可知,液体培养后,变异菌株菌丝体生物量比原始菌株高的为H-2、H-7、H-9;变异菌株菌丝体粗多糖含量比原始菌株高的为H-2(高出1.2 %)。因此,筛选出的优良猴头菇菌株为变异菌株H-2。另外,变异菌株H-5的生物量比变异菌株H-7要低,但H-5的菌丝体粗多糖含量却比H-7要高,这说明猴头菇经超声波诱变后,菌丝体生物量大的,其粗多糖含量不一定高。
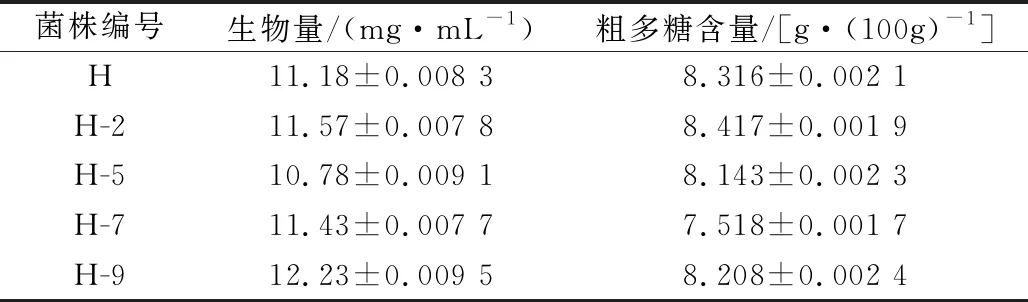
表4 猴头菇菌株液体培养后产物产量的比较
2.4 猴头菇袋料栽培结果
取猴头菇原始菌株H和变异菌株H-2,先二级种扩大培养,再用聚丙烯塑料袋装料进行栽培。结果如表5和图2。

表5 猴头菇袋料栽培结果

图2 猴头菇袋料栽培结果
由表5可知,猴头菇变异菌株H-2和原始菌株H的菌丝体长满时间一致,但H-2幼蕾萌发时间比H提早两天。由图2可看出,H-2子实体色泽偏白,而H子实体色泽偏黄。H-2子实体比H子实体的干重增加了3.8 %,粗多糖含量提高了2.3 %。另外,对比表4和表5可知,猴头菇菌丝体粗多糖含量高于子实体粗多糖含量。
2.5 猴头菇子实体粗多糖的抑菌效果
将从猴头菇原始菌株H与变异菌株H-2子实体提取的多糖,分别配成浓度为10.54 mg/mL的粗多糖溶液,用滤纸片法测定抑菌效果,抑菌圈直径小于9 mm 为低度敏感;9~11 mm为中度敏感;11 mm以上为高度敏感。结果见表6和图3。

表6 猴头菇子实体多糖抑菌效果
注:“—”表示没有抑菌效果。

图3 H-2对金黄色葡萄糖球菌的抑菌效果
由表6可知,猴头菇原始菌株H子实体多糖对金黄色葡萄球菌、大肠杆菌、枯草芽孢杆菌均无抑菌效果。猴头菇变异菌株H-2子实体多糖对金黄色葡萄球菌高度敏感(见图3),而对大肠杆菌和枯草芽孢杆菌没有抑菌效果。这可能是因为猴头菇经超声波诱变后,其子实体多糖的化学结构发生了变化,从而提高了其对金黄色葡萄球菌的抑菌活性。
3 结论
本研究利用超声波对猴头菇进行诱变。通过猴头菇平板培养初筛和液体发酵复筛,得到菌丝体生物量和粗多糖含量均高于原始菌株H的变异菌株H-2。猴头菇袋料栽培试验表明,变异菌株H-2菌丝体和子实体的粗多糖含量比原始菌株H分别提高了1.2%和2.3%。另外,比较了H-2和H两种猴头菇子实体粗多糖的抑菌效果,结果表明,猴头菇H-2子实体粗多糖,对金黄色葡萄球菌具有强抑菌作用,而原始菌株的子实体粗多糖对金黄色葡萄球菌不敏感。可见,猴头菇菌株经超声波诱变后不仅可提高子实体粗多糖含量,而且也会增强其抑菌活性,因此超声波诱变可以作为改良食用菌生物性状的一项有效措施。
