果蔬酵素中纯菌种筛选及其在复合发酵中的应用
2020-03-02肖梦月曹新志张楷正赵迎庆胡琴杨建刚
肖梦月,曹新志*,张楷正,赵迎庆,胡琴,杨建刚
(1.四川轻化工大学 生物工程学院,四川 宜宾 644005;2.四川保宁压酒有限公司, 四川 阆中 637400;3.山东凤凰生物有限公司,山东 泰安 271000)
拐枣,学名枳椇,因其形似“万”字又得名万寿果。很多研究表明,拐枣中不仅含有蛋白质、多糖、果糖、维生素等营养成分,还含有黄酮和多酚等生物活性物质[1,2]。目前关于拐枣的研究不多,现有产品有限,主要有拐枣酒、拐枣饮料和拐枣醋,还有很多研究是关于其相关成分的提取和检测[3-5]。酵素本意指酶,现在多指各种原料经过微生物发酵后所得的产品,酵素产品在保留自身有益成分的同时能够经微生物发酵产生更多的有益成分,所以经很多研究发现酵素具有改善人体内微生态环境,提高免疫力,抗氧化,延缓衰老,预防与心血管和肥胖等相关的疾病的功效[6-8]。日本在20世纪80年代就已经将酵素产品的生产作为技术来研究并进入应用阶段,在日本,每天有超过2000万人在服用酵素产品,食用酵素在日本一年的消费额可达1000亿日元[9]。虽然拐枣营养价值极高,但因其形态特殊,并略带涩味,所以直接食用拐枣的人群较少。目前将拐枣应用于酵素产品的研究还比较少见,本研究将拐枣与果蔬混合制作酵素,有望提高拐枣的加工利用率,使拐枣中的有益成分更好地得以利用。
酵素的发酵工艺可分为3种:不外加菌自然发酵、灭菌后加菌发酵和在自然发酵的基础上外加菌复合发酵[10]。在自然发酵的基础上外加菌复合发酵可以有效综合前两种方式的优缺点,解决自然发酵过程中的很多问题,并且外加菌发酵还可以增加有益物质的含量[11-14]。本文从自然发酵拐枣果蔬酵素中筛选出纯菌种,将筛选出的纯菌种应用于外加菌复合发酵酵素工艺,以期达到缩短发酵周期、降低发酵成本的目的。
1 试验材料与方法
1.1 试验材料
红糖、白砂糖及各种果蔬原料:均购于宜宾某市场;没食子酸、无水碳酸钠、三羟甲基氨基甲烷、铁氰化钾、三氯乙酸、三氯化铁、磷酸氢二钠(十二水)、盐酸、磷酸二氢钠(二水):均为分析纯,购于成都市科隆化工试剂厂;牛肉膏、蛋白胨、酵母浸粉、麦芽浸粉、酵母膏等:生物试剂,北京奥博星生物技术有限责任公司。
1.2 培养基
乳酸菌通用(MRS)培养基[15]:牛肉膏6.0 g,蛋白胨6.0 g,酵母浸粉3.0 g,乙酸钠3.0 g,磷酸氢二钾1.2 g,吐温-80(聚山梨酯-80)0.6 mL,葡萄糖12.0 g,MnSO4·4H2O 0.15 g,MgSO4·7H2O 0.35 g,柠檬酸铵1.2 g,蒸馏水600 mL,pH 6.2±0.2,固体培养基加琼脂15.0 g,(无菌)碳酸钙9.0 g,121 ℃、0.1 MPa高压灭菌20 min。
酵母膏胨葡萄糖琼脂(YPD)培养基:蛋白胨12.0 g,酵母浸膏6.0 g,葡萄糖12.0 g,固体培养基加琼脂15.0 g,蒸馏水600 mL,121 ℃、0.1 MPa高压灭菌15 min。
1.3 主要仪器与设备
GZ-250-S生化培养箱 韶关市广智科技设备有限公司;HWS-12电热恒温水浴锅 上海齐欣科学仪器有限公司;DHG-9140A电热恒温鼓风干燥箱 上海一恒科技有限公司;LS-75HD立式压力蒸汽灭菌锅 江阴滨江区医疗设备有限公司;SW-CJ-1FD超净工作台 苏州尚田洁净技术有限公司;ISO 9001恒温培养振荡器 上海智城分析仪器制造有限公司;TG-16台式高速离心机 四川蜀科仪器有限公司;TGL-16B离心机 上海安亭科学仪器厂;UV-1000紫外可见分光光度计 上海翱艺仪器有限公司;Thermo 868 pH计 热电(上海)科技仪器有限公司。
1.4 试验方法
1.4.1 拐枣果蔬酵素工艺流程及操作要点
1.4.1.1 工艺流程
果蔬清洗 风干→去皮、去核→切丁→调配→装罐密封→一次发酵→过滤→熟成。
1.4.1.2 操作要点
预处理:将拐枣(半干)、橘子、苹果、梨、萝卜、卷心菜、菠菜、柠檬、土豆、藕、西红柿清洗干净,于通风处自然晾干水分后去皮、去核并切丁,将切好的果蔬按1∶1的比例混合得到混合果蔬。
调配:按比例加入菌种及糖,菌种在加入前进行活化处理,酵母菌接种于YPD培养基中,于28 ℃摇床上,以转速150 r/min振荡培养24 h;乳酸菌于MRS培养基中于37 ℃培养48 h。
装罐密封:装罐量为容积的80%,不可装太满。
一次发酵:前7 d每天搅拌1次。
过滤:一次发酵完成后用双层纱布过滤。
熟成:将过滤后的一次发酵液密封后于常温避光处二次发酵熟成,30 d左右完成。
1.4.2 检测方法
1.4.2.1 还原力
参考毛酸浆酵素的还原力测定方法[16],取经离心处理的上清发酵液0.2 mL,加入2.5 mL浓度为0.2 mol/L的磷酸盐缓冲溶液(pH 6.6),然后加入质量分数为10%的铁氰化钾溶液,于50 ℃水浴20 min后快速冷却,然后加入2.5 mL 20%的三氯乙酸溶液,于3600 r/min离心15 min后立即取上清液2.5 mL,加入去离子水2.5 mL和0.1%的三氯化铁0.5 mL。以去离子水作参比在波长700 nm处测定吸光值。吸光值越大,说明还原能力越强,抗氧化效果越好。
1.4.2.2 SOD酶活力测定方法
参考国标GB/T 5009.171-2003[17],于25 ℃左右,取经预处理并适当稀释的样液0.2 mL于试管中,然后依次将2.35 mL浓度为0.1 mol/L的三羟甲基氨基甲烷盐酸缓冲溶液(pH为8.2,内含1 mmol/L EDTA-2Na)、1.8 mL蒸馏水、0.15 mL 4.5 mmol/L邻苯三酚溶液,混匀后立即倒入石英比色皿中在波长325 nm条件下分别测定初始时和1 min后的吸光值,二者之差为A1,空白比色皿用10 mmol/L盐酸调零,同样用蒸馏水代替样液测定邻苯三酚的自氧化速率A0,SOD酶活性计算方式如下:
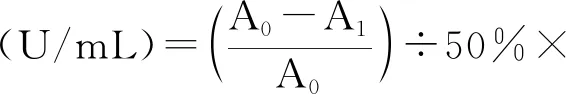
1.4.3 菌种的分离纯化[18]
按酵素工艺制备自然发酵拐枣果蔬酵素,调配时加入50%的红糖和50%的白砂糖,置于阴凉干燥处自然发酵3个月,取1 mL发酵中的自然发酵拐枣果蔬酵素原液,用无菌水逐级稀释,得到101~107共7个梯度稀释液。吸取100 μL各梯度的菌悬液分别涂布于MRS培养基和YPD培养基上,其中,MRS培养基于37 ℃恒温培养约48 h,YPD培养基于28 ℃恒温培养24~48 h,倒置培养并隔一段时间进行观察。挑取具有明显溶钙圈和酵母菌特征的菌落,再在MRS培养基和YPD培养基上划线培养。
1.4.4 菌种的筛选[19,20]
对疑似酵母菌的菌落直接水浸片镜检,对疑似乳酸菌菌落进行革兰氏染色和显微镜下菌株形态观察,并选择具有典型酵母菌、乳酸菌和醋酸菌特征的菌株进行斜面保藏和甘油管冷藏,甘油管冷藏按菌液和60%甘油1∶1的体积比接入甘油管内并冷藏于低温冰箱内。对镜检未完全纯化的菌株进行二次划线纯化,并重复以上步骤。
1.4.5 分子生物学鉴定
1.4.5.1 菌株的活化
选择典型的菌株,接种一环纯化后的酵母菌单菌落于YPD液体培养基中,28 ℃、180 r/min培养24~48 h;乳酸菌单菌落接种于100 mL MRS液体培养基中,37 ℃培养24 h;乳酸菌取2 mL菌液于2 mL离心管(EP管)中,酵母菌需按不同提取方法取不同的量,离心后弃上清液,取沉淀。
1.4.5.2 酵母菌18S rDNA分子生物学鉴定
酵母菌通用引物:(1.1 kb)18S rDNA正向引物NS1:5′-GTAGTCATATGCTTGTCTC-3′,反向引物NS4:5′-CTTCCGTCAATTCCTTTAAG-3′;(1.8 kb)18S rDNA正向引物NS1:5′-GTAGTCATATGCTTGTCTC-3′,18S rDNA反向引物NS8:5′-TCCGCAGGTTCACCTACGGA-3′。
PCR反应体系(25 μL):2×Taq MasterMix 12.5 μL;DNA模板2 μL;Primer F,10 μmol/L,0.5 μL;Primer R,10 μmol/L,0.5 μL;无菌超纯水9.5~25 μL。
PCR扩增程序:94 ℃变性1 min,52 ℃退火1 min,72 ℃延伸90 s,30个循环;72 ℃ 10 min,于4 ℃保存。
1.4.5.3 乳酸菌16S rDNA分子生物学鉴定
细菌通用引物:(1.6 kb)16S rDNA正向引物27F:5′-AGAGTTTGATCCTGGCTCAG-3′,反向引物1492R:5′-AGAGTTTGATCCTGGCTCAG-3′。
PCR反应体系(25 μL):2×Taq MasterMix 12.5 μL;DNA模板2 μL;Primer F,10 μmol/L,0.5 μL;Primer R,10 μmol/L,0.5 μL;无菌超纯水9.5~25 μL。
PCR扩增程序:95 ℃预变性5 min,95 ℃变性60 s,55 ℃退火60 s,72 ℃延伸90 s,30个循环,72 ℃ 8 min,于4 ℃保存。
送样测序:PCR产物通过1%琼脂糖凝胶电泳,检测PCR是否成功及片段大小。使用EditSeq结合Chromas软件对所测序列进行裁剪后,将所得序列在NCBI数据库中进行Blast比对,分析序列同源性,并选择相似度较高的序列,采用MEGA 6.0软件构建菌株的系统发育树。
1.4.6 复合拐枣果蔬酵素工艺优化
1.4.6.1 单因素试验
a.发酵菌种的选择
经预处理后将拐枣与混合果蔬按照1∶4的比例混合,调配时加入30%的混合糖,将样品进行编号1~4,分别加入酵母菌2%、乳酸菌2%、混合菌2%、混合菌4%。在温度为30 ℃条件下进行发酵,每天取发酵液测定pH,直至pH稳定后结束发酵进行还原力和SOD酶活力的测定。
b.加糖量的选择
前处理方式不变,将样品进行编号1~4,分别在调配时加入20%混合糖(红糖与白砂糖的比例为1∶1)、30%的混合糖、40%的混合糖、50%的混合糖,每个样品均添加2%的混合菌种,然后在30 ℃条件下进行发酵,每天取发酵液测定pH,直至pH稳定不再下降后取发酵液经预处理后进行还原力和SOD酶活力的测定。
c.发酵温度的选择
前处理方式不变,调配时加入30%的混合糖与2%的混合菌,将样品进行编号1~4,分别在25,30,35,40 ℃条件下进行发酵,每天取发酵液测定pH,直至pH稳定不再下降后取发酵液经预处理后进行还原力和SOD酶活力的测定。
1.4.6.2 正交试验
在单因素的基础上设计正交试验(见表1),考察加糖量、发酵温度和接种量3个因素共同作用对拐枣果蔬酵素的影响,发酵结束后对发酵液的还原力和SOD酶活性进行测定,每个样品重复测定3次,最后结果取平均值,根据测定结果最终选择出最优工艺条件。

表1 发酵工艺优化正交试验因素与水平Table 1 The factors and levels of orthogonal experiment for optimization of fermentation process
1.4.7 验证试验及发酵过程中pH值、还原力和SOD酶活性的变化规律
按照正交试验所得到的最优工艺,重新制作一批样品,并每天取发酵液测定其pH值、还原力和SOD酶活力。
2 结果与分析
2.1 纯菌种的筛选结果

表2 酵母菌和乳酸菌菌落及菌株形态特征Table 2 The colonies and morphological characteristics of yeast and lactic acid bacteria
将分离出来的疑似酵母菌和疑似乳酸菌的菌种分别进行纯化,挑取单菌落镜检,根据表2的酵母菌和乳酸菌菌落及菌株形态特征选取形态不同的菌株进行保藏,分别挑选出2株酵母菌和1株乳酸菌进行生物学鉴定。
2.2 生物学鉴定结果
2.2.1 酵母菌测序结果
将所得序列剪切后在NCBI数据库中进行Blast比对,J-1-1及J-1-2与酿酒酵母菌(Saccharomycescerevisiae)的同源性为100%,故鉴定为酿酒酵母菌(Saccharomycescerevisiae),其中酵母菌J-2-1和J-1-1的系统发育树见图1。

图1 酵母菌J-1-1和J-2-1基于18S rRNA序列 进行构建系统发育树Fig.1 Phylogenetic tree of Saccharomyces J-1-1 and J-2-1 based on 18S rRNA sequence
2.2.2 乳酸菌鉴定结果
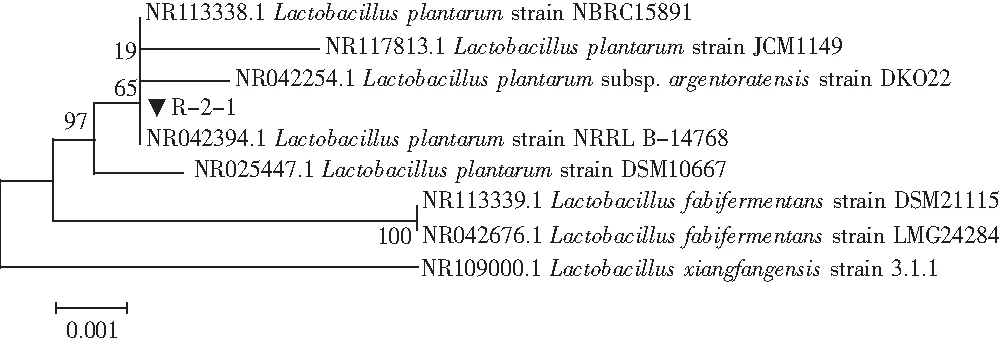
图2 乳酸菌R-2-1基于16S rRNA序列进行构建系统发育树Fig.2 Phylogenetic tree of Lactobacillus R-2-1 based on 16S rRNA sequence
检测发现R-2-1与植物乳杆菌(Lactobacillusplantarum)的同源性为100%,故鉴定为植物乳杆菌(Lactobacillusplantarum),菌株R-2-1的系统发育树见图2。
2.3 发酵菌种的选择结果
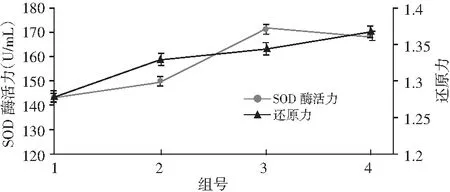
图3 不同菌种添加量对SOD酶活力和还原力的影响Fig.3 The effects of different strains' additive amount on SOD enzyme activity and reduction ability
由图3可知,混合菌种添加的发酵效果均优于单菌种添加,且只添加乳酸菌(第2组)的发酵效果要明显优于只添加酵母菌的(第1组)。其中第3组添加混合菌种量2%和第4组添加混合菌种量4%的发酵效果有差异,说明适宜的菌种种类与菌种添加量对酵素的品质有很大影响。
2.4 加糖量的选择结果
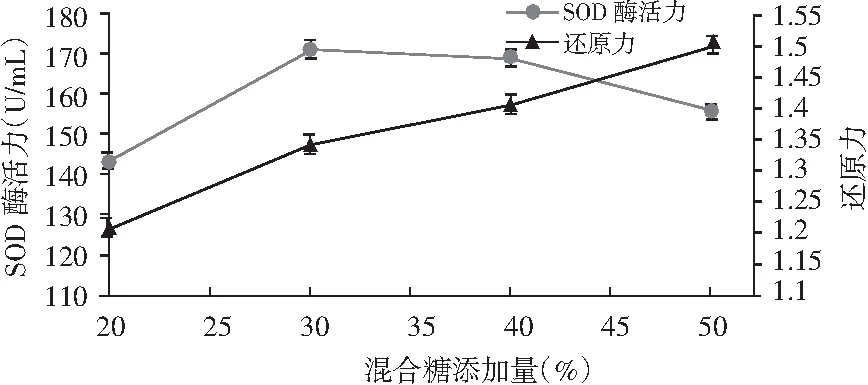
图4 不同糖添加量对SOD酶活力和还原力的影响Fig.4 The effects of different sugar additive amount on SOD enzyme activity and reduction ability
由图4可知,糖的添加量对酵素的SOD酶活力和还原力均会产生很大影响,随着糖添加量的增大,SOD酶活力出现先增大后降低的现象,这可能是过高的糖添加量反而会抑制微生物的生长繁殖,最终导致所产酶活力下降。还原力随着糖添加量的增大一直增大,这可能是由于糖添加量增多,被微生物分解成还原糖的量也越大,所以最终导致发酵结束时还原力很大。
2.5 温度的选择结果
由图5可知,过高的温度和过低的温度均不利于酵素的发酵,随着温度的升高,拐枣果蔬酵素的SOD酶活力和还原力出现先上升后下降的趋势,在35 ℃时SOD酶活力和还原力均达到最大值,这可能与所添加的酵母菌和植物乳杆菌的最适温度有关系。
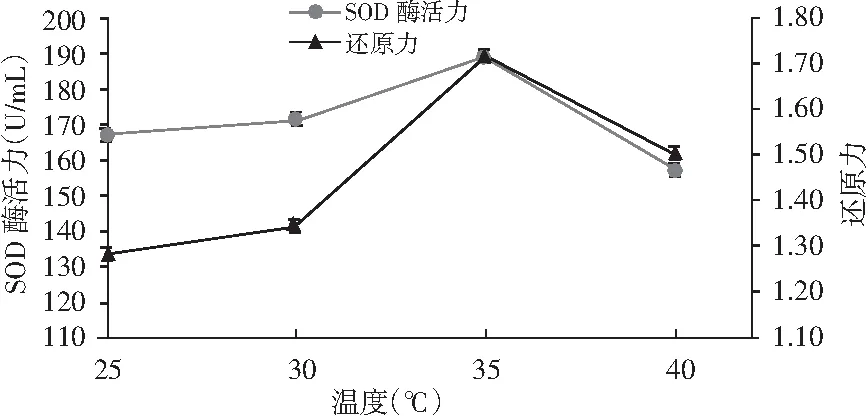
图5 温度对SOD酶和还原力的影响Fig.5 The effect of temperature on SOD enzyme and reduction ability
2.6 正交试验结果
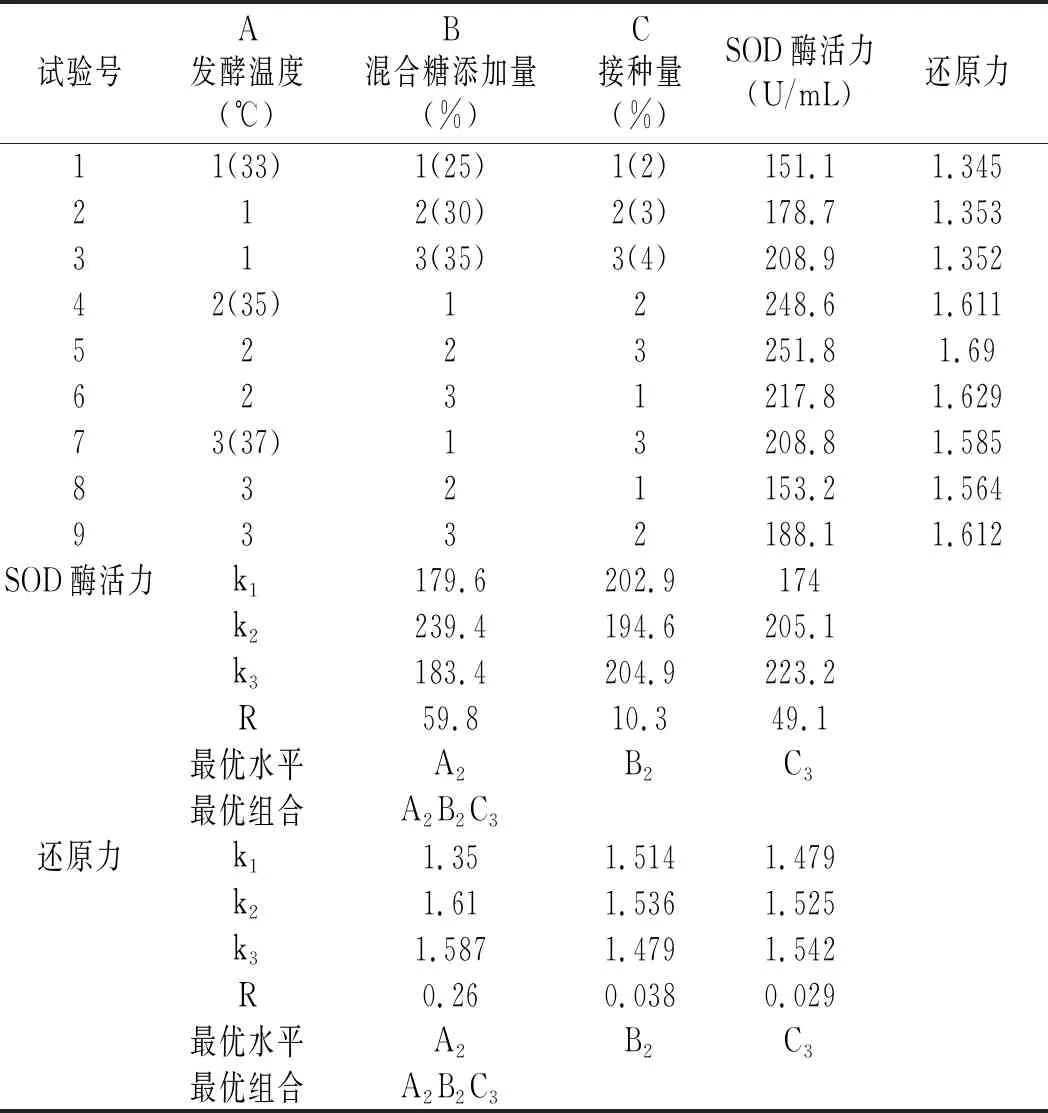
表3 发酵工艺正交试验结果与分析Table 3 The results and analysis of orthogonal experiment for fermentation process
由表3极差值分析可知,影响酵素样品SOD酶活力的因素主次顺序为A>C>B,发酵温度是影响酵素样品SOD酶活力的最主要因素,这可能是由于温度极大地影响了微生物的生长繁殖,因而影响了酵素的产物组成。影响酵素样品还原力的主次顺序为A>B>C,温度对还原力的影响最大。对于SOD酶活力和还原力而言,两种指标均越大越好,所以从两种指标都可得出最优组合是A2B2C3。
2.7 验证试验结果与发酵过程中各指标变化规律
由图6可知,在正交试验所得最佳工艺条件下发酵,即发酵温度35 ℃,混合糖添加量30%,接种酵母菌和植物乳杆菌按1∶1比例混合的混合菌4%,所得的拐枣果蔬酵素pH为3.64,SOD酶活力为252 U/mL,还原力为1.690,发酵时间为5 d。在发酵过程中前3 d pH值变化最明显,然后趋于平稳,在第6天有少许上升。还原力和SOD酶活力均呈现先上升后下降的趋势,其中还原力在第3天达到最大值,然后逐渐下降至比较平稳。
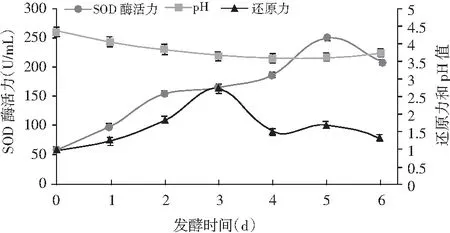
图6 发酵过程中各指标的变化Fig.6 The changes of indexes during fermentation
3 结论
拐枣的营养丰富,目前应用拐枣制作酵素的报道比较少见,自然发酵的拐枣果蔬酵素发酵周期长,加糖量多。本试验从自然发酵的拐枣果蔬酵素中分离筛选出3株纯菌种,经分子生物学鉴定,2株酵母菌皆为酿酒酵母,1株乳酸菌为植物乳杆菌。将筛选出来的酵母菌和乳酸菌应用于拐枣果蔬酵素的复合发酵工艺,通过单因素试验和正交试验最终得到最优工艺为发酵温度35 ℃,混合糖添加量30%,两菌种各添加2%。在此工艺条件下发酵5 d所得的拐枣果蔬酵素SOD酶活力为252 U/mL,还原力为1.690,色泽呈浅红棕色,口味酸甜,有拐枣固有风味且无涩味。比较未添加拐枣的酵素,其含有更多的黄酮类和多酚类物质,且更不易被杂菌污染。
