闽江河口湿地植物根际土壤氨氧化细菌群落结构分析
2020-03-02陈丽华刘兰英李玥仁
陈丽华,吕 新,刘兰英,黄 薇,李玥仁
(福建省农业科学院农业质量标准与检测技术研究所/福建省农产品质量安全重点实验室,福建 福州 350003)
0 引言
【研究意义】湿地系统是陆地和水生生态系统间的重要过渡区,具有保持生物物种多样性、拦截和过滤物质流、净化水体、保持水土等多重生态服务功能[1]。土壤的氮含量及其迁移转化速率显著影响着湿地生态系统的结构和功能,因此氮循环在湿地生态系统的生物地球化学循环中占有重要地位[2]。氨氧化细菌是氮循环关键环节硝化作用的主要驱动者之一[3],因此在湿地生态系统中研究氨氧化细菌具有重要的现实意义。【前人研究进展】氨氧化细菌作为驱动湿地氮转化的一类重要功能微生物得到了研究者的广泛关注[4−6]。有研究表明,氨氧化菌群种类数量及其种群生态分布的变化,将直接或间接影响土壤养分循环、水体富营养化、温室气体和生态系统的功能[7]。氨单加氧酶是氨氧化微生物特有的一种胞内酶,amoA基因编码氨单加氧酶的活性位点[8],且在氨氧化细菌中保守性较高,因此amoA基因作为氨氧化细菌群落研究的特征基因,已被应用于多种生境中[9−11]。闽江河口湿地处于闽江入海口区域,水体中含氮化合物输入湿地后,表面沉积物成为硝化过程的重要场所。围绕闽江河口湿地沉积物微生物群落开展的工作包括互花米草入侵对红树林根际土壤微生物的影响[12−13],以及湿地土壤产甲烷菌群落研究[14−15],研究认为互花米草入侵后红树林土壤微生物群落多样性指数均有下降,红树林-互花米草混交区域的土壤微生物功能多样性和丰富度都高于红树林群落和互花米草群落;闽江口芦苇湿地土壤中产甲烷菌群落包括甲烷杆菌目、甲烷微菌目和甲烷八叠球菌目,但闽江河口区淡水和半咸水短叶茳芏潮汐沼泽湿地土壤产甲烷菌群落类型有较大的差异。【本研究切入点】闽江河口湿地海陆交互,物质梯度变化明显,其具有的独特微生物群落在氮循环中起着重要作用,然而,对脱氮功能微生物群落的研究则鲜见报道。项目组前期对闽江河口湿地芦苇、互花米草和红树林根际土壤氨氧化细菌数量时空分布特征进行分析[16],发现0~20 cm土层氨氧化细菌数量大于20~40 cm土层,春秋季氨氧化细菌数量大于夏季,不同植物之间氨氧化细菌数量为芦苇>红树林>互花米草。该结果仅仅反映闽江河口湿地土壤氨氧化细菌数量的变化情况,为更全面了解闽江河口湿地氨氧化微生物,还需进一步分析氨氧化细菌的多样性和群落结构。【拟解决的关键问题】本研究通过高通量测序技术测定样品amoA基因序列,从而分析闽江河口湿地芦苇、互花米草和红树林根际土壤氨氧化细菌的群落多样性和结构组成,旨在了解闽江河口湿地不同植物根际脱氮功能微生物类群,进一步为功能微生物资源利用提供科学数据。
1 材料与方法
1.1 样品采集
土壤样品采自闽江河口湿地国家自然保护区,该区位于福州市长乐区东北部,闽江入海口南侧,行政区域范围涉潭头、文岭、梅花3个镇13个行政村,总面积2 100 hm2(地理坐标:119°36′27.8″~119°41′15.1″ E, 26°01′07.8″~26°03′39.3″ N)。分别于2016年5月(春季)、2016年8月(夏季)、2016年10月(秋季)和2016年12月(冬季),采集芦苇(具体坐标:26°01′50″ N, 119°37′36″ E)、互花米草(具体坐标:26°01′52″ N, 119°37′36″ E)和红树林(具体坐标:26°01′53″ N, 119°37′42″ E)3种植物根际土壤样品。采用多点混合采样法,采样深度为0~20 cm和20~40 cm。在距离植物主茎半径约20 cm范围内取土,剔除植物残体、根系、小石块等杂质后,将样品四分法混匀,取0.5 kg左右土壤装入无菌密封袋,置于冰盒内,快速带回实验室,−20 ℃条件下冷冻保藏待用。
1.2 土壤总DNA的提取
采用FastDNA®SPIN for Soil Kit(MP Biomedicals,LLC.)提取土壤总DNA。称取0.5 g土壤样品,按照试剂盒上的步骤提取土壤样品微生物总DNA,置于−20 ℃保存待用。
1.3 氨氧化细菌amoA基因的PCR扩增
amoA基因扩增所用引物[17]:amoA-1F(5′ - GGG GTT TCT ACT GGT GGT-3′)和amoA-2R(5′ - CCC CTC KGS AAA GCC TTC TTC-3′),长度约491 bp。PCR扩 增 体 系:2×Taq PCR Master Mix 12.5 μL,5 μmol·L−1引物各1 μL,DNA样品约30 ng,2 mg·L−1BSA 3 μL,用无菌ddH2O补足至25 μL。PCR反应条件:95 ℃ 5 min;95 ℃ 45 s,50 ℃ 50 s,72 ℃ 45 s,35个循环;72 ℃ 10 min。扩增24个样品的amoA基因,将同一个样品的3个平行扩增产物混合后经2%琼脂糖凝胶电泳检测,并用AxyPrep DNA凝胶回收试剂盒进行切胶回收。纯化后的产物委托北京奥维森基因科技有限公司进行高通量测序(Miseq PE300平台)及多样性分析。
1.4 测序数据的质控及生物信息学分析
为了得到高质量的测序数据,需对原始下机数据进行质控和过滤。利用Trimmomatic软件去除序列末端质量低于20的碱基并去除可能包含的嵌合体序列,以及去除长度小于50 bp的短序列;使用FLASH软件将成对序列拼接成一条序列,进一步去除拼接后低质量序列;通过Mothur软件查找并去除序列中的引物等。过滤后得到质量和可信度较高的优化序列,用于后续生物信息学分析。
通过在QIIME中调用Uparse方法对优质序列按照97%相似性进行OTU(Operational taxonomic unit)聚类分析;利用R软件生成样品间OTU分布维恩图;采用RDP Classifier算法对OTU代表序列进行比对分析,并在各个水平注释其群落的物种信息;根据OTU列表中的各样品物种丰度情况,应用Mothur软件计算常用的生物多样性指数。
2 结果与分析
2.1 样品高通量测序数据及合理性分析
通过对测序数据的优化与统计,获得闽江河口湿地芦苇、互花米草和红树林根际土壤氨氧化细菌的有效测序数据(表1)。测序24个样品共得到300 527条最终序列,各样品序列数为2 282~40 818,序列长度为260~540 bp。按照97%相似性对非重复序列进行OTU聚类,24个样品产生的氨氧化细菌OTU数目在90~556个。稀释曲线分析发现,样品序列数的增加使稀释曲线趋向平坦。这表明了本次高通量测序数据合理,测序深度能覆盖样品氨氧化细菌群落中的绝大多数物种,可以反映闽江河口湿地生境中氨氧化细菌群落结构和多样性的真实情况。
2.2 OTU聚类分析
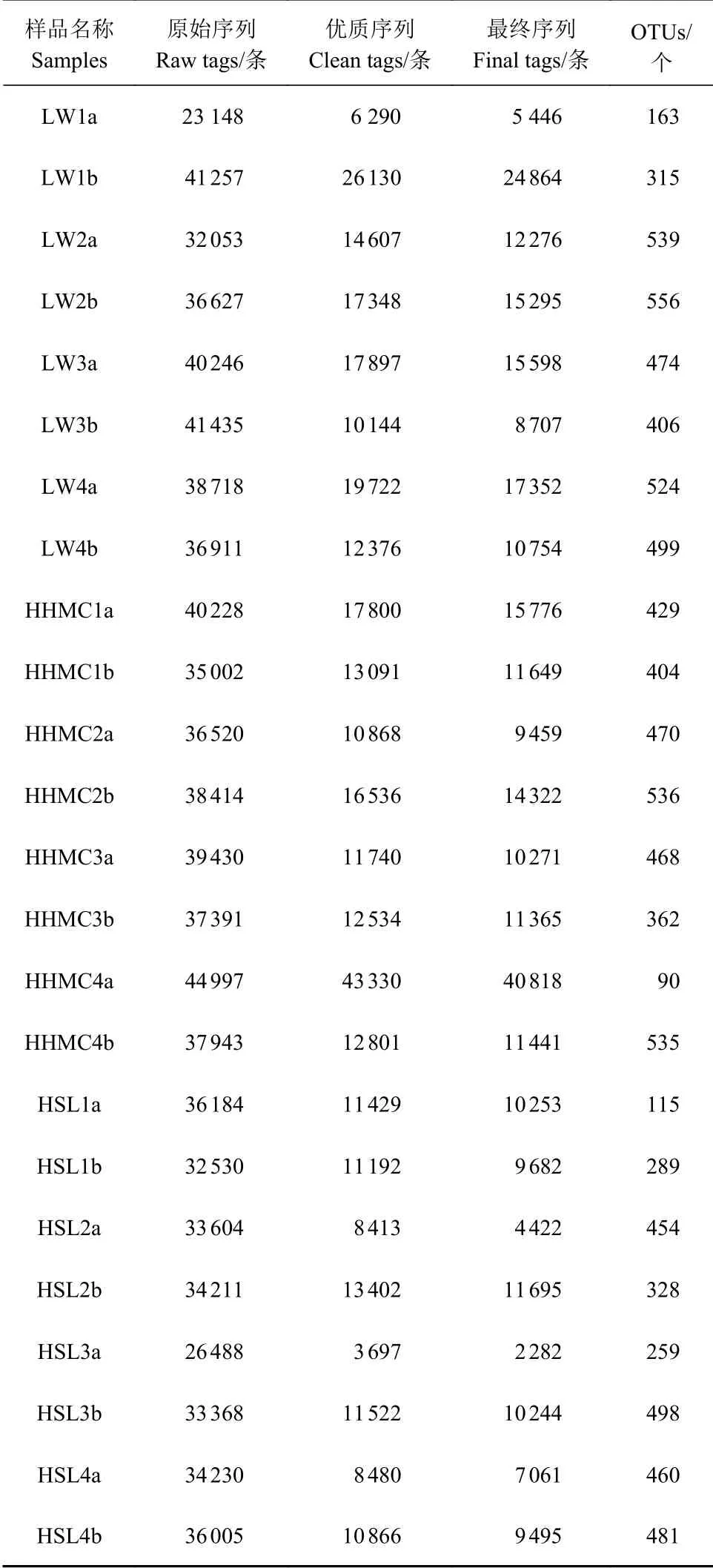
表 1 高通量测序有效数据统计Table 1 Filtered valid data from high-throughput sequencing
Venn图可用于统计多个样本共有和特有的OTU数目,能比较直观地展现环境样本的OTU数目组成相似性及重叠情况。图1为闽江河口湿地芦苇、互花米草和红树林根际土壤氨氧化细菌OTUs Venn图。结果表明,3种植物根际土壤样品共产生氨氧化细菌OTU数目2 794个,其中芦苇根际土壤样品特有OTU为483个,互花米草根际土壤样品特有OTU为341个,红树林根际土壤样品特有OTU为660个;三者共有OTU数目514个。从不同季节来看,芦苇根际土壤样品OTU数目表现为夏季>冬季>秋季>春季,互花米草根际土壤样品OTU数目表现为夏季>秋季>春季>冬季,红树林根际土壤样品OTU数目表现为冬季>夏季>秋季>春季。这3种植物根际土壤氨氧化细菌的OTU数目未呈现出完全一致的季节变化趋势,但总体上表现为夏季样品的OTU数目大于春秋季样品的OTU数目。
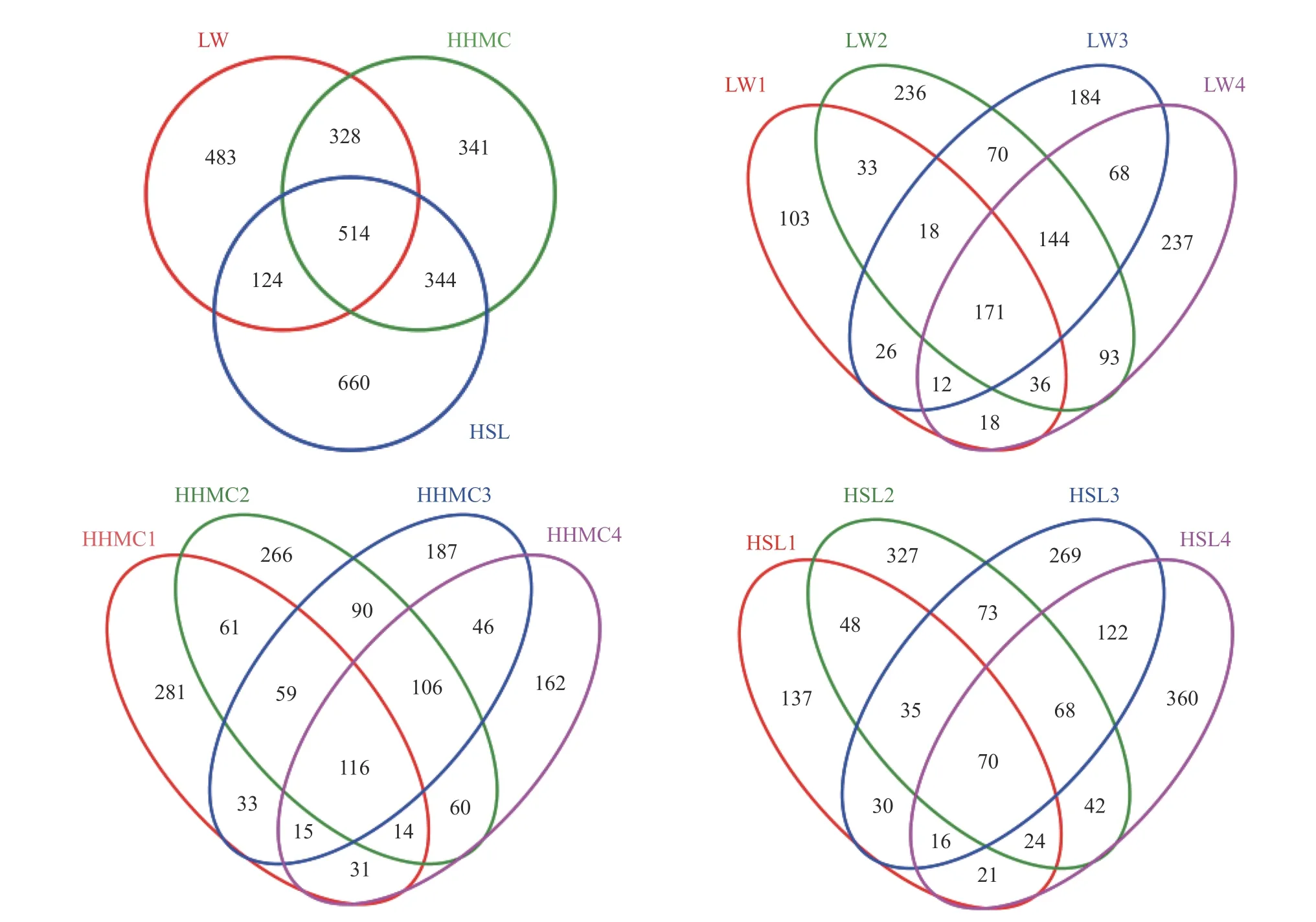
图 1 闽江河口湿地植物根际土壤氨氧化细菌OTUs Venn图Fig. 1 OTUs Venn diagrams of ammonia-oxidizing bacteria in rhizosphere soils of Minjiang estuary wetlands
2.3 氨氧化细菌多样性分析
通 过qiime(version v.1.8 http://qiime.org/scripts/alpha_rarefaction.html)平台分析闽江河口湿地3种植物根际土壤样品氨氧化细菌的Alpha多样性指数(表2)。其中,Observed species指随测序深度的增加,实际观测到OTU的个数;Coverage表征各样本文库的覆盖率,其数值越高,样本中序列被测出的概率则越高;Chao即菌群丰富度指数,用以估计群落中的OTU数目;Shannon指数是估算样品微生物多样性的指数之一,值越大说明群落多样性越高[18]。
从表2看出,测序覆盖率为93.71%~99.52%,表明样品中的序列多数能被测出,进一步证实测序结果基本能够反映闽江河口湿地植物根际土壤样品氨氧化细菌的真实情况。芦苇、互花米草和红树林根际土壤样品的Chao指数平均值分别为348.99、342.38和344.61,说明闽江河口湿地土壤氨氧化细菌的丰富度差别不大。不同季节芦苇和红树林根际土壤样品中Chao指数表现为春季最低。不同土层芦苇、互花米草和红树林根际土壤样品Chao指数未呈现出明显趋势。芦苇、互花米草和红树林根际土壤样品Shannon指数的平均值分别5.16、4.76和5.71,说明红树林根际土壤氨氧化细菌的群落多样性最高,互花米草根际土壤氨氧化细菌的群落多样性最低。从季节来看,芦苇和红树林根际土壤样品的Shannon指数均表现为春季最低。不同土层芦苇、互花米草和红树林根际土壤样品Shannon指数也未呈现出明显的规律。
2.4 氨氧化细菌群落结构分析
24个闽江河口湿地植物根际土壤样品共检测出16个门类氨氧化细菌,图2为门水平氨氧化细菌及其相对丰度。由图2可知,24个土壤样品中未确定门分类的氨氧化细菌所占比例较大,占比0.80%~85.88%;变形菌门(Proteobacteria)为最主要的优势菌门,相对丰度为13.74%~99.19%。此外,放线菌门(Actinobacteria)、绿菌门(Chlorobi)、绿弯菌门(Chloroflexi)、硝化螺旋菌门(Nitrospirae)、厚壁菌门(Firmicutes)、酸杆菌门(Acidobacteria)、疣微菌门(Verrucomicrobia)、螺旋体门(Spirochaetes)等也有检出,但它们的相对丰度大多低于1%(样品HSL2a中放线菌门相对丰度为1.49%除外)。从季节来看,芦苇根际土壤样品的优势菌门变形菌门相对丰度明显表现为春季>夏季>秋季>冬季;从土层来看,优势菌门变形菌门的相对丰度在绝大多数样品中表现为0~20 cm土层>20~40 cm土层,只有在春季芦苇和红树林根际土壤样品中表现为20~40 cm土层>0~20 cm土层。
基于24个样品门水平氨氧化细菌群落结构分析结果,对闽江河口湿地植物根际土壤样品的氨氧化细菌属水平进行分析,共获得166个属。图3所示为属水平前20优势氨氧化细菌及其相对丰度。由图3可知,24个土壤样品中未确定属分类的氨氧化细菌同样所占比例较大;优势菌属包括亚硝化单胞菌属(Nitrosomonas)、硫杆菌属(Thiobacillus)、Caldimonas属、Sideroxydans属、Zhizhongheella属、亚硝化螺菌属(Nitrosospira)、嘉 利 翁 氏 菌 属(Gallionella)、食酸菌属(Acidovorax)、Sulfuriferula属、细嗜硫卤菌 属(Thiohalophilus)、根 杆 菌 属(Rhizobacter)、红育菌属(Rhodoferax)、贪铜菌属(Cupriavidus)、伯克氏菌属(Burkholderia)、厌氧粘细菌属(Anaeromyxobacter)、甲基杆菌属(Methylobacterium)、甲基单胞菌属(Methylomonas)、Acidihalobacter属等。其中,多数样品的第一优势菌属是亚硝化单胞菌属(Nitrosomonas);硫杆菌属(Thiobacillus)是春冬季芦苇20~40 cm土层样品的第一优势菌属;Caldimonas属则是秋季芦苇20~40 cm土层样品的第一优势菌属。另外,还发现Sulfuriferula属是芦苇根际土壤样品中特有的菌属,而甲基杆菌属(Methylobacterium)则只出现在红树林根际土壤样品中。从土层来看,优势菌属亚硝化单胞菌属(Nitrosomonas)的相对丰度在多数样品中表现为0~20 cm土层>20~40 cm土层,在春季互花米草和红树林根际土壤样品以及夏季红树林根际土壤样品中则呈现相反的趋势。
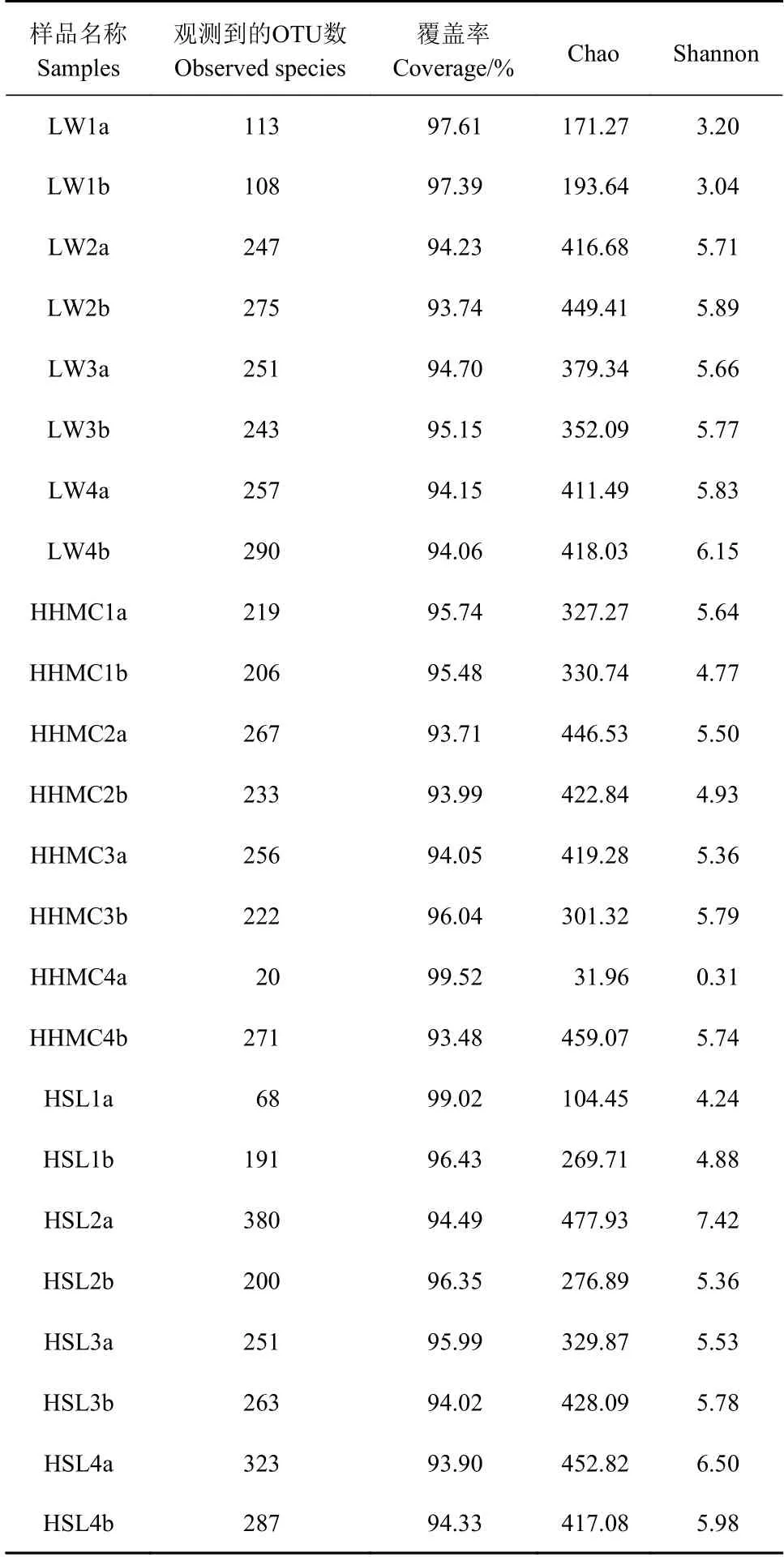
表 2 土壤样品氨氧化细菌的Alpha多样性指数Table 2 Alpha diversity indices of ammonia-oxidizing bacteria in soil specimens
3 讨论与结论
高通量测序技术能提供大量遗传信息,可以检测到环境中低丰度的类群,有助于对微生物群落结构进行全面深入研究[3]。本研究通过氨氧化细菌amoA基因的高通量测序分析,对闽江河口湿地植物根际土壤中与氮循环过程密切相关的氨氧化细菌群落多样性和结构组成进行了探索。基于OTUs的多样性分析发现,3种植物根际土壤样品的丰富度指数Chao指数差别不大,多样性指数Shannon指数平均值则表现为红树林>芦苇>互花米草。张爱娣等[19]研究珠江三角洲滨海湿地土壤微生物群落时也发现,土壤微生物群落多样性基本表现为互花米草湿地<碱蓬滩湿地<芦苇湿地<红树林湿地。但是,赵紫檀等[13]在研究闽江河口湿地互花米草入侵下红树林土壤微生物群落特征时却发现互花米草的土壤微生物多样性要高于红树林。湿地生态系统土壤微生物对生态环境变化比较敏感,其土壤微生物多样性状况受植被类型、土壤质量、盐碱度等众多因素的影响,所以相同植被的土壤微生物多样性也可能呈现相反的变化趋势。本实验研究对象为土壤微生物中的氨氧化细菌,有研究发现根际分泌物与根际功能微生物群落组成有很强的相关性[20−21],而红树林作为常绿灌木或小乔木,它的根系发达,可能更有利于各类氨氧化细菌的定植和繁衍,所以红树林根际土壤氨氧化细菌多样性要高于芦苇和互花米草根际土壤样品。不同土层之间土壤微生物多样性常表现为随着采样深度的加大,土壤微生物多样性反而降低。本研究中不同土层芦苇、互花米草和红树林根际土壤氨氧化细菌Chao指数和Shannon指数未呈现出明显的规律,这可能是因为闽江河口湿地周期性的潮汐使得土壤稳定性差。
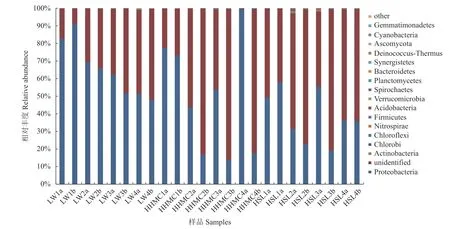
图 2 门水平氨氧化细菌群落的相对丰度Fig. 2 Relative abundance of ammonia-oxidizing bacteria community at phylum level
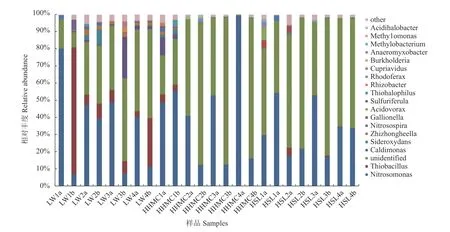
图 3 属水平Top 20优势氨氧化细菌群落的相对丰度Fig. 3 Relative abundance of top 20 ammonia-oxidizing bacteria community at genus level
高通量测序分析结果表明,闽江河口湿地分类地位确定的氨氧化细菌中,第一优势菌门为变形菌门(Proteobacteria)。变形菌门是细菌中最大的一门,其多为专性或兼性厌氧代谢[22],包含许多与有机物和无机物代谢有关的菌属[23],同时也包含硝化菌属和绝大多数的反硝化菌属[24−25],它们与氮循环密切相关。有研究报道湿地环境中变形菌门以第一优势门存在[22,26],本实验结果与之相吻合。闽江河口湿地植物根际土壤中的优势菌属包括亚硝化单胞菌 属(Nitrosomonas)、硫 杆 菌 属(Thiobacillus)、Caldimonas属等,其中亚硝化单胞菌属(Nitrosomonas)为大多样品的第一优势菌属。亚硝化单胞菌属是高含氮环境中的优势类群,它们喜欢较高浓度的基质环境[27]。闽江河口湿地位于闽江入海口区域,闽江水体中含氮化合物输入湿地,容易造成高含氮环境。
长期以来,众多学者认为在氨氧化过程中起主导作用的微生物主要包括氨氧化细菌和氨氧化古菌。研究中发现土壤中氨氧化古菌和氨氧化细菌可能存在一定的生态位分异,氨氧化古菌更倾向于在酸性和低氮的寡营养环境中起作用,而氨氧化细菌则多在中碱性和高氮环境中起主导作用[28]。闽江河口湿地属于滨海湿地,土壤偏中碱性,因此本研究对闽江河口湿地根际土壤氨氧化细菌的多样性和群落结构展开研究。2015年,科学家们发现了可以独立将氨态氮氧化为硝态氮的完全氨氧化菌(comammox)[29−30]。该发现使得硝化作用再一次成为研究热点。在闽江河口湿地生境下研究氨氧化微生物,可以进一步探讨氨氧化古菌、氨氧化细菌和comammox细菌在湿地生态系统中的生态位以及它们对氨氧化作用的贡献。
