七叶一枝花根际与非根际土壤细菌群落多样性
2020-03-02郑梅霞朱育菁苏海兰
郑梅霞,陈 宏,朱育菁,苏海兰
(福建省农业科学院农业生物资源研究所,福建 福州 350003)
0 引言
【研究意义】七叶一枝花为百合科多年生草本植物,药用历史悠久,以蚤休之名首载于《神农本草经》,有清热解毒、消炎镇痛、止咳平喘、熄风定惊等功效;是夺命丹、百宝丹、云南白药、宫血宁等多种中成药的重要原料[1]。七叶一枝花与根际土壤微生物存在共生关系[2],土壤微生物是构成土壤微生态系统的主要部分,而土壤细菌群落的多样性与土壤微生物环境紧密相关。地理环境、栽培条件和根际土壤微生物数量影响七叶一枝花的生长情况及药用价值[3−6]。【前人研究进展】研究表明,药用植物产生的次级代谢产物很丰富,在其生长过程中很容易将这类物质释放到土壤中,从而引起药用植物根际土壤理化性质的改变,导致根际微生物和土壤酶活性较非根际有更大的变化[7]。曹永昌等[8]研究表明,根际与非根际土壤微生物多样性存在差异,主成分显著不同。研究表明,根际土壤细菌和真菌数量高于非根际土壤,放线菌低于非根际土壤,原因可能是放线菌对高温、干燥、碱性条件适应力强,在非根际环境中占有优势[9]。【本研究切入点】植物根际是土壤-植物生态系统物质交换的环境,土壤细菌既是土壤微生物区系的重要组成部分,也是土壤物质流和能量流的主要推动者[2]。目前,对七叶一枝花根际与非根际土壤微生物组多样性的研究较少,并且野生七叶一枝花和人工移栽七叶一枝花土壤微生物群落的结构及多样性分析比较还有待阐明。【拟解决的关键问题】本研究采用野外条件下的剥离取样法[10]采集土样,进行16S的扩增子测序,对野生和人工移栽七叶一枝花根际与非根际土壤细菌群落结构及多样性进行初步研究,分析七叶一枝花与土壤微生物之间的相互作用,为探讨通过调控土壤微生物实现七叶一枝花优质高产栽培提供理论依据。
1 材料与方法
1.1 样地设置
2016年9月在福建省南平市,选取七叶一枝花野生环境2个样地,人工移栽2个样地,样地信息如表1所示。其中,野生环境样地,均为群体分布,密度为15~20株·m−2,人工移栽为林下种植,常规管理。按梅花点分别选取5株8个刻痕大小植株。
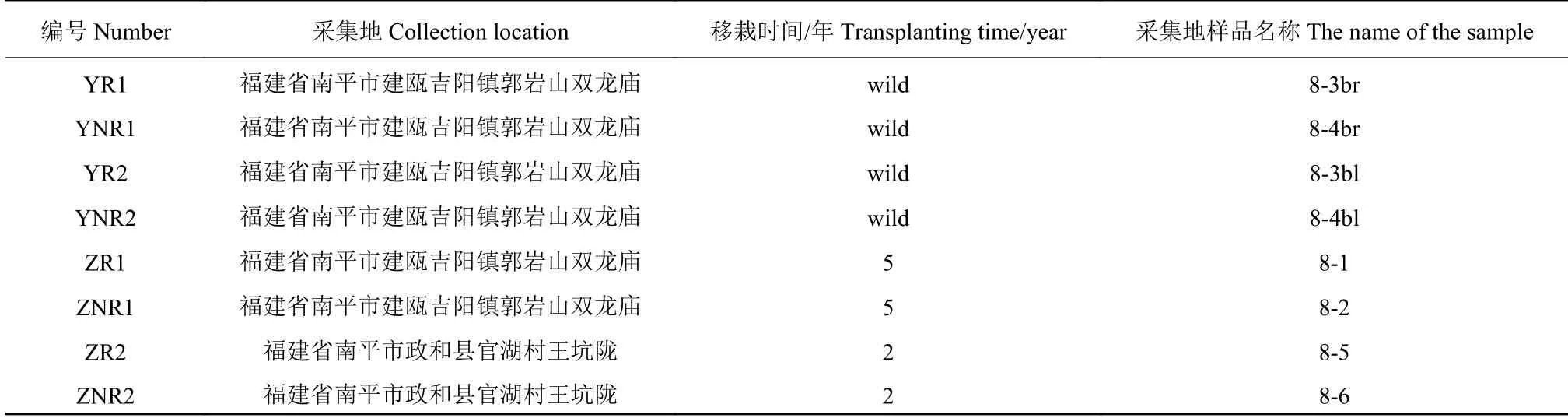
表 1 七叶一枝花土壤样本信息Table 1 Sources of soil samples
1.2 土样采集
先除去落叶层,铲除表面1~2 cm表土。在七叶一枝花植株周围挖0~20 cm土层深度具有完整根系的土体,先轻轻抖落不含根系的土,将抖落下来的土壤视为非根际土,黏附在根上0~0.5 cm土壤作为根际土样,将混匀的土壤装入无菌自封袋内,置于 4 ℃冰箱保存,备用。
1.3 试验方法
1.3.1 土壤可培养微生物的分离 称取10 g土壤悬浮于90 mL无菌水,剧烈震荡摇匀,得到土壤的水溶液。采用梯度稀释平板涂布法进行细菌分离。土壤原液分别稀释至10−3和10−5,然后取100 μL稀释涂布于LB平板上(LB培养基:胰蛋白胨10 g·L−1,酵母蛋白5 g·L−1,氯化钠5 g·L−1,琼脂糖17 g·L−1),每个处理3个重复, 30 ℃恒温培养48 h后,计算细菌的数量。
1.3.2 土壤总DNA提取 土壤DNA样品的提取以及后续测序和数据分析由上海微基生物(TinyGen)提供。根据Mobio Powersoil DNA Isolation Kit试剂盒(胜创生物,12888-50)的操作说明,称取250 mg左右的土壤样本分别进行基因组DNA抽提。分别取3 μL进行1.2%琼脂糖凝胶电泳检测,后续试验质量浓度为30 ng·μL−1。
1.3.3 土壤16S rDNA文库构建 文库构建采用两步PCR扩增的方法,首先采用特异引物(内侧引物:F内侧引物:5′-TTCCCTACACGACGCTCTTCCGATCT-特异引物-3′;R内侧引物:5′-GAGTTCCTTGGCAC CGAGAATTCCA-特异引物-3′;)扩增目的片段,将目的片段采用AXYGEN公司的AxyPrepDNA凝胶回收试剂盒(AXYGEN,AP-GX-50G)进行胶回收,而后将回收产物作为模板进行二次PCR扩增(F外侧引物:5′-AATGATACGGCGACCACCGAGAT CTACAC-barcode-TCTTTCCCTACACGACGCTC-3′;R外侧引物:5′-CAAGCAGAAGACGGCATAC GAGAT-barcode-GTGACTGGAGTTCCTTGGCACC CGAGA-3′),目的是将illumina平台测序所需的接头,测序引物,barcode添加到目的片段的两端。第一次PCR扩增体系为:50 μL反应体系,10 μL 5×Buffer,1 μL dNTP(10 mmol·L−1),1 U Phusion超保真DNA聚合酶,各1 μL F/R内侧引物(10 μmol·L−1),5 ~50 ng模板,双蒸水补足体积;第一次PCR扩增反应条件为:94 ℃ 2 min;94 ℃ 30 s,56 ℃ 30 s, 72 ℃ 30 s,循环数25;72 ℃ 5 min。第二次PCR扩增体系为:40 μL反应体系,8 μL 5×Buffer,1 μL dNTP(10 mmol·L−1),0.8 U Phusion超 保 真DNA聚合酶,各1 μL F/R内侧引物(10 μmol·L−1),5 μL模板,双蒸水补足体积;第二次PCR扩增反应条件为:94 ℃ 2 min;94 ℃ 30 s, 56 ℃ 30 s, 72 ℃ 30 s,循环数8;72 ℃ 5 min。PCR产物采用AxyPrepDNA凝胶回收试剂盒(AXYGEN公司,AP-GX-50G)进行切胶回收,FTC-3000TM real-time PCR仪进行定量检测。样本进行miseq文库制备后进行illumina miseq 2×300 bp高通量测序[微基生物科技(上海)有限公司]。
1.3.4 微生物组测序数据质控与分析 对测序得到的原始数据进行拼接、过滤,得到有效数据。采用Mothur V.1.33.3软件基于有效数据进行OTUs(Operational Taxonomic Units)聚类和物种信息分析。利用UPARSE进行聚类,得到OTU的代表序列,利用UCHIME将PCR扩增产生的嵌合体从OTU代表序列中去除,采用Clean Tags对97%相似水平的OTU代表序列进行分类学分析。使用unsearch-global方法将所有序列比对回OTU代表序列,得到每个样品在每个OTU的丰度统计表。
1.3.5 七叶一枝花土壤中细菌物种组成与分析 比较测序数据量不同的土壤中细菌群落组成的丰富度和土壤微生物的测序数据量是否合理的稀释性曲线图,采用mothur软件和微基生物科技(上海)有限公司自编程序分析。反映组间各样本之间的共有和独有OTU数目的Venn图,采用mother和R语言软件生成。可操作分类单元(OTU)根据97%的序列相似性阈值进行划分。利用mothur软件分析不同随机抽样下的Alpha多样性指数来反映土壤细菌群落的丰度和多样性,包括Chao、Ace、Shannon和Simpson等指数,相似水平为0.03。Chao和Ace指数反映样本中群落的丰富度(species richness),Shannon和Simpson指数反映群落的多样性(Species evenness),均受样本群落中物种丰富度和物种均匀度的影响。Chao、Ace和Shannon指数越大,Simpson指数越小,说明样本中物种越丰富。
1.3.6 七叶一枝花根际与非根际土壤细菌群落显著性差异分析 基于物种分类信息的数据表,利用R语言工具作图,得到样本在不同分类水平上的群落结构,根据群落丰度数据,利用matastats对七叶一枝花根际和非根际两组样本在不同分类学水平上进行显著性差异分析(Differentially Abundant Features)。利用LEfSE软件根据分类学组成对样本按照不同的分组条件进行线型判别分析(LDA),找出对样本划分产生显著性差异影响的群落,即LDA EffectSize组间群落差异分析。通过分析不同样本OTU组成反映样本间的差距和距离的Principal co-ordinates analysis(PCoA)图通过mothur和R语言软件生成。
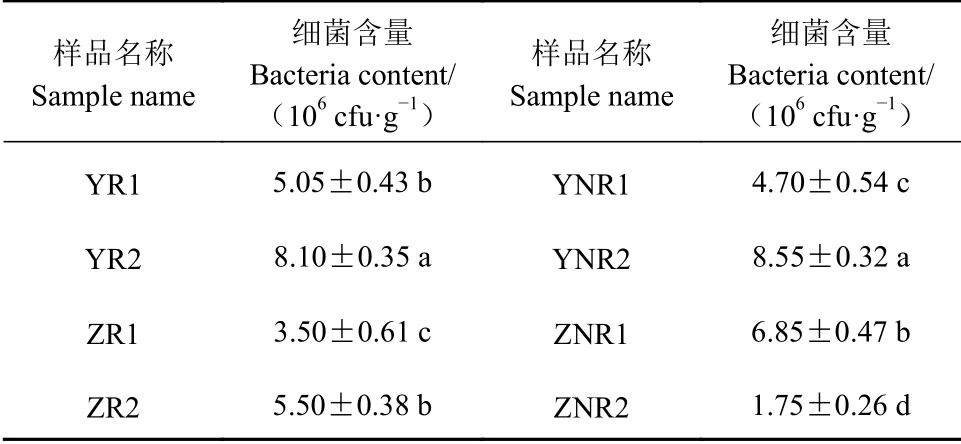
表 2 七叶一枝花土壤的细菌分离数量Table 2 Plate counts of soil samples
2 结果与分析
2.1 七叶一枝花土壤细菌数量分析
七叶一枝花土壤中细菌的数量如表2所示,细菌含量均在106cfu·g−1以上,说明其中微生物丰富。野生七叶一枝花的根际和非根际(YR1,YNR1,YR2和YNR2)土壤中细菌数量相当,相差5%~6%,均比较丰富;但是不同地区的野生七叶一枝花的土壤细菌含量相差较大,YR2是YR1的1.6倍,YNR2是YNR1的1.8倍;移栽5年的七叶一枝花的根际土壤ZR1的细菌数量仅为非根际ZNR1的51%;移栽2年的七叶一枝花的的根际土壤ZR2的细菌数量是非根际ZNR2的3.14倍,七叶一枝花移栽时间越长,其根际土壤的细菌数量先增大后减少,且根际和非根际土壤的细菌数量相差越小,说明移栽对七叶一枝花的根际和非根际土壤细菌产生一定的影响,若移栽的土壤细菌数量贫瘠,七叶一枝花可以调节根际微生物菌群,使其根际土壤细菌数量增大,若移栽的土壤细菌数量丰富,七叶一枝花调控根际土壤细菌形成优势菌群,移栽时间越长根际和非根际土壤细菌数量越趋于平衡,可能是因为移栽时间足够长之后,根际土壤中形成了优势菌群。
2.2 七叶一枝花土壤细菌扩增子测序及物种(OTU)组成
南平地区野生和移栽七叶一枝花的8份土壤细菌DNA文库经过对merge后的reads的质量进行质控过滤后获得了共360 596个序列,优化后获得270 081个序列,如表3所示,稀释性曲线如图1所示,在测序达到一定深度后,各样本的稀释曲线趋于平缓,表明测序深度已经基本覆盖到样本中所有的物种,覆盖率高,测序数据合理。虽然样本稀释性曲线没有完全平坦,但更多的数据量只会产生少量新的OTU,却使得成本更高。因而,本试验样本的取样深度及测序数据量合理,能够较好地反映七叶一枝花土壤细菌菌群情况。
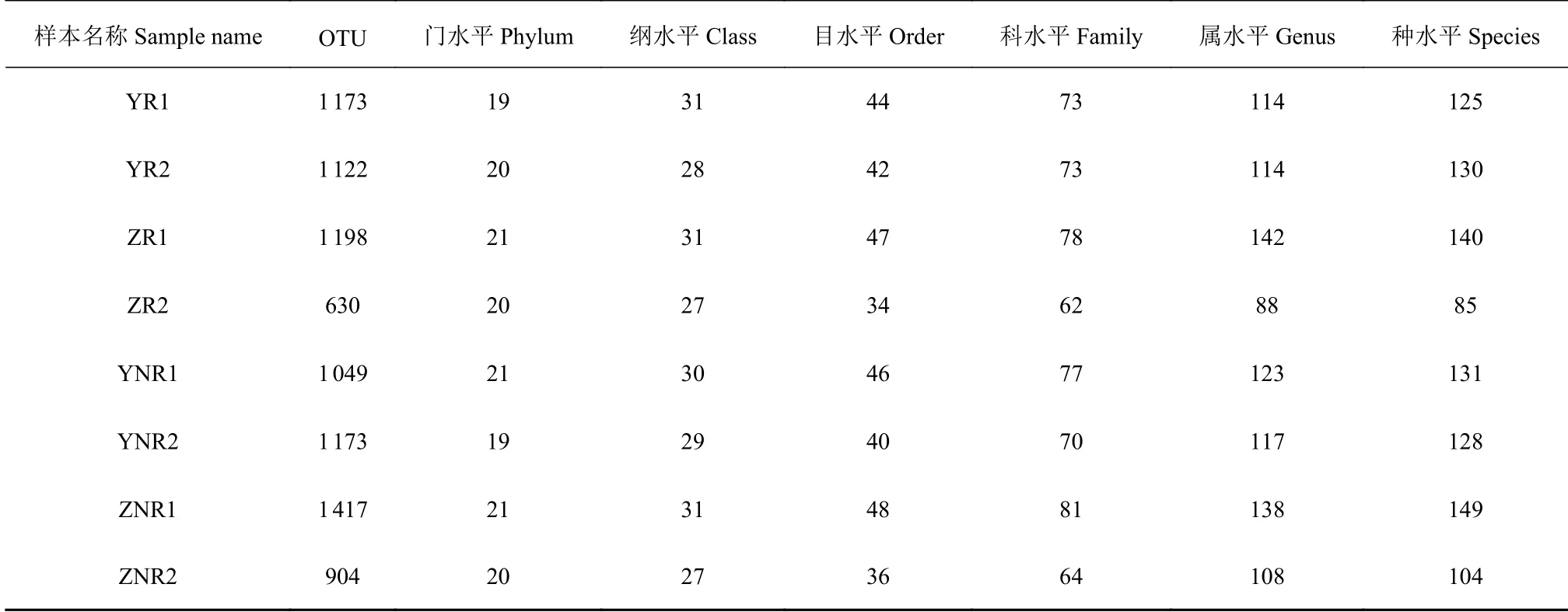
表 3 七叶一枝花土壤样本不同分类阶元细菌物种(OTU)数量Table 3 OTUs of soil samples on different biological classification levels
统计七叶一枝花土壤中共有和独有的细菌物种(OTU)数量如表3所示,8份土壤中包含8 666种OTUs,各个土壤中OTU数从904到1 417,其中最大的是移栽5年七叶一枝花的非根际土壤。韦恩图显示(图2),七叶一枝花根际和非根际土壤中共有1 827种OTU,其中根际土壤特有72种OTU,占根际土壤总OTU的4%;非根际土壤特有64种OTU,占非根际土壤总OTU的3.6%。OTU差异分析(图3),七叶一枝花根际与非根际土壤中差异比较大 的 是OTU-65、OTU-675、OTU-1731、OTU-1329和OTU-1133。
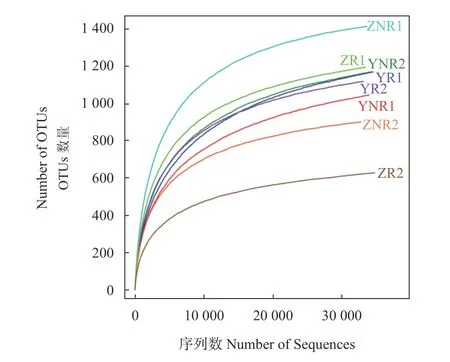
图 1 七叶一枝花土壤细菌16S rRNA相似水平为97%的稀释性曲线Fig. 1 Rarefaction curves of soil bacteria with 97% similarity on 16S rRNA
从OTU上分析(表3),七叶一枝花非根际土壤的OTU数量都大于根际土壤;门水平的数量在19~21之间,野生七叶一枝花的根际和非根际土壤细菌的门数量稍有差异,而移栽的七叶一枝花的根际和非根际的门数量一样;纲水平的数量在27~31,野生七叶一枝花的根际和非根际土壤细菌的纲数量稍有差异,而移栽的七叶一枝花的根际和非根际的纲数量一样;目水平的数量在34~48,野生和移栽的七叶一枝花的非根际土壤细菌的目数量均略大于根际;科水平的数量在62~81,野生和移栽的七叶一枝花的非根际土壤细菌的科数量均略大于根际;属水平的数量在88~142,野生和移栽的七叶一枝花的非根际土壤细菌的属数量均略大于根际,野生七叶一枝花的根际与非根际土壤细菌的属数量相差3~9,移栽2年的七叶一枝花的根际与非根际的细菌属的数量相差20,移栽5年的七叶一枝花的根际与非根际的细菌属的数量相差4,说明移栽时间越长,根际和非根际的属水平差异越小;种水平的数量在85~149,野生和移栽的七叶一枝花的非根际土壤细菌的种数量均略大于根际,野生七叶一枝花的根际与非根际土壤细菌的种数量相差2~6,移栽2年的七叶一枝花的根际与非根际的细菌属的数量相差19,移栽5年的七叶一枝花的根际与非根际的细菌属的数量相差9,也说明移栽时间越长,根际和非根际的种水平差异越小。
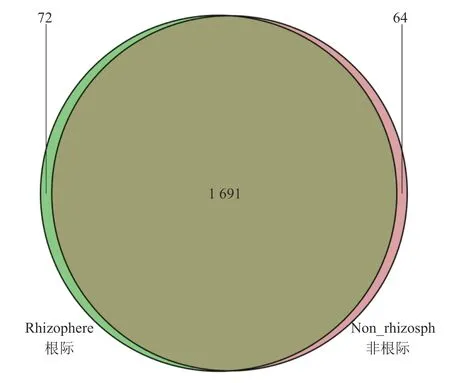
图 2 七叶一枝花土壤细菌物种(OTU)组成的韦恩图分析Fig. 2 Venn analysis on OTUs of soils
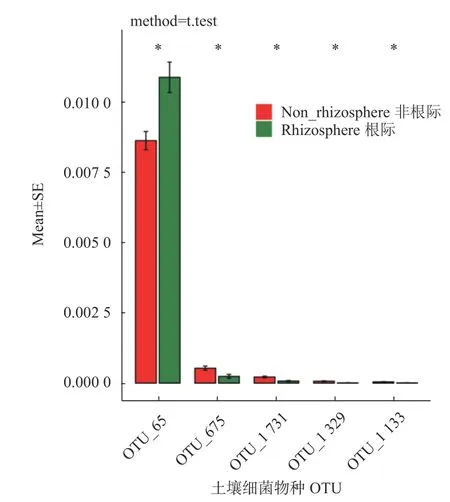
图 3 七叶一枝花根际与非根际土壤细菌物种(OTU)组成的差异Fig. 3 Venn analysis on OTUs of rhizosphere and nonrhizosphere soils
2.3 七叶一枝花土壤细菌物种丰度分析
七叶一枝花土壤中细菌多样性丰富性和系统分布在不同水平上进行分析。如图4所示,在门水平,共检测到21个细菌门,主要为变形菌门Proteobacteria(31.01%)、酸 杆 菌 门 Acidobacteria(31.68%)、厚壁 菌 门Firmicutes(4.03%)、拟 杆菌Bacteroidetes(6.15%)、硝化螺旋菌门Nitrospirae(2.17%)和绿弯菌门Chloroflexi(2.79%)等。七叶一枝花根际土壤样本丰度>2%的细菌为酸杆菌门Acidobacteria(31.68%)、变 形 菌 门 Proteobacteria(31.01%)、放线菌门Actinobacteria(10.99%)、拟杆菌门Bacteroidetes(6.15%)、绿弯菌门Chloroflexi(5.81%)、厚壁菌门Firmicutes(4.03%)、芽单胞菌 门 Gemmatimonadetes(3.45%)和 浮 霉 菌 门Planctomycetes(2.15%);七叶一枝花非根际土壤样本丰度>2%的细菌为变形菌门Proteobacteria(36.70%)、酸杆 菌门 Acidobacteria(27.12%)、放线菌 门Actinobacteria(12.88%)、拟 杆 菌 门 Bacteroidetes(5.51%)、绿弯菌门Chloroflexi(4.81%)、厚壁菌门Firmicutes(3.57%)和芽单胞菌门Gemmatimonadetes(2.16%);七叶一枝花根际土壤样本丰度>2%的细菌门中,放线菌门Actinobacteria和变形菌门Proteobacteria在根际中的丰度低于非根际,其他门在根际中的丰度均高于非根际。
在属水平,七叶一枝花根际土壤样本中,丰度>1%的细菌为Unclassfiled(62.77%)、北里孢菌属Kitasatospora(4.55%)、马赛菌属Massilia(2.62%)、芽单胞菌属Gemmatimonas(1.79%)、黄杆菌属Flavobacterium(1.71%)、芽孢杆菌Bacillus(1.67%)、Candidatus_Solibacter(1.58%)、溶杆菌属Lysobacter(1.56%)、伯克氏菌属Burkholderia(1.53%)、链嗜酸菌属Streptacidiphilus(1.47)、类芽孢杆菌Paenibacillus(1.42%)、Bryobacter(1.22%)和嗜酸栖热菌属Acidothermus(1.15%);非根际土壤样本中,丰度>1%的细菌为北里孢菌属Kitasatospora(57.12%)、马赛菌属Massilia(5.46%)、Unclassfiled(5.30%)、芽 单 胞 菌 属Gemmatimonas(3.78%)、Perlucidibaca(2.44%)、黄 杆 菌 属Flavobacterium(1.85%)、堆囊菌属Sorangium(1.66%)、链嗜酸菌属Streptacidiphilus(1.56)、贪铜菌属Cupriavidus(1.32%)、Dyella(1.19%)、Candidatus_Solibacter(1.18%)和Arenimonas(1.03%)。根际与非根际土壤中细菌属差异较大的是Unclassfiled和北里孢菌属(Kitasatospora);根际土壤中芽孢杆菌(Bacillus)、溶杆菌属(Lysobacter)、伯克氏菌属(Burkholderia)、类芽孢杆菌(Paenibacillus)、Bryobacter和嗜酸栖热菌属Acidothermus的丰度>1%,而在非根际土壤中丰度<1%;非根际土壤中Perlucidibaca、堆囊菌属Sorangium、贪 铜 菌 属 Cupriavidus、 Dyella和Arenimonas丰度>1%,而在根际土壤中丰度<1%。
2.4 七叶一枝花土壤细菌物种多样性分析
七叶一枝花土壤中微生物群落的多样性指数如表4所示,Chao、Ace和Shannon指数越大,Simpson指数越小,说明样本中细菌物种越丰富。Chao和Ace指数反映样品中群落的丰富度。Chao指数介于758.2692~1 544.8750,是OTU数目的1倍左右,表明本研究的细菌多样性测序深度达到了丰富度估计值的80%左右。Chao和Ace指数分析,野生Y1根际土壤中细菌的丰富度高于非根际,但是野生Y2根际土壤中细菌的丰富度低于非根际,移栽Z1和Z2根际土壤中细菌的丰富度均低于非根际,即七叶一枝花的根际土壤中的细菌丰富度低于非根际,说明七叶一枝花对根际的土壤细菌影响较大,可能是由于其根际形成优势菌群,所以根际土壤细菌的丰富度相对较低;七叶一枝花根际土壤中细菌的丰富度,移栽2年的最低,而移栽5年的与野生的土相当;七叶一枝花的非根际土壤中细菌的丰富度,移栽2年的最低,移栽5年后的细菌丰富度增大,甚至高过野生的。
Shannon和Simpson指数反映样品中群落的多样性,Shannon指数值越大,Simpson指数值越小,说明群落多样性越高。经Shannon和Simpson指数分析,野生七叶一枝花的根际土壤细菌群落多样性高于非根际,而移栽七叶一枝花的根际土壤细菌群落多样性低于非根际,移栽2年和5年七叶一枝花的根际土壤中细菌的多样性低于非根际,移栽2年七叶一枝花的土壤中细菌的多样性低于野生,而移栽5年七叶一枝花的土壤中细菌的多样性高于野生七叶一枝花土壤,结果表明,七叶一枝花影响土壤中细菌的多样性,随移栽时间的延长,七叶一枝花对土壤中微生态系统的影响越大,可能是由于其根际形成优势菌群,所以根际土壤细菌的多样性相对较低。
将所有七叶一枝花土壤分为根际和非根际2组,其Alpha多样性指数如图5所示,说明七叶一枝花非根际土壤的细菌丰富度和多样性均大于七叶一枝花根际土壤。
2.5 七叶一枝花土壤样品细菌群落结构差异分析及显著性差异分析
七叶一枝花土壤中细菌群落结构不同(不同水平),根据得到的OTU和群落丰度数据,运用统计学方法检测七叶一枝花根际和非根际土壤中微生物群落的丰度差异,进行稀有频率数据的多重假设检验和假发现率分析来评估差异的显著性,如图6所示。
在门水平和科水平没有显著差异。在纲水平,具有显著差异的是绿菌纲Chlorobia,其在七叶一枝花根际土壤中的含量低于非根际土壤;在目水平,具有显著差异的是绿菌目Chlorobiales和粘球菌目Myxococcales,其在七叶一枝花根际土壤中的含量低于非根际土壤;在属水平,具有显著差异的是不动杆菌属Acinetobacter和Rudaea,其在七叶一枝花根际土壤中的含量低于非根际土壤;在种水平,具有显著差异的是Mucilaginibacter ximonensis,uncultured-Nannocystineae bacterium,uncultured Singulisphaer asp.,uncultured Solibacteraceae bacterium,uncultured Xanthomonadaceae bacterium,其在七叶一枝花根际土壤中的含量均低于非根际。
七叶一枝花根际和非根际土壤中起重要作用的细菌依据LDA EffectSize组间群落差异(图7)分析可得,野生七叶一枝花根际和非根际土壤中起到重要作用的门水平没有差异。
2.6 七叶一枝花土壤细菌的Beta多样性分析
样 本 的Principal co-ordinates analysis(PCoA)如图8所示,通过分析不同样本OTU组成反映样本间的差距和距离,分析个体或群体间的差异。PCoA结果显示,野生七叶一枝花的土壤细菌物种(OTU)构成相近,可以聚为一类,移栽5年七叶一枝花或移栽2年七叶一枝花与野生七叶一枝花的细菌物种(OTU)构成差异比较大,单独聚为一类。同一个样本的根际和非根际土壤均聚为1类。
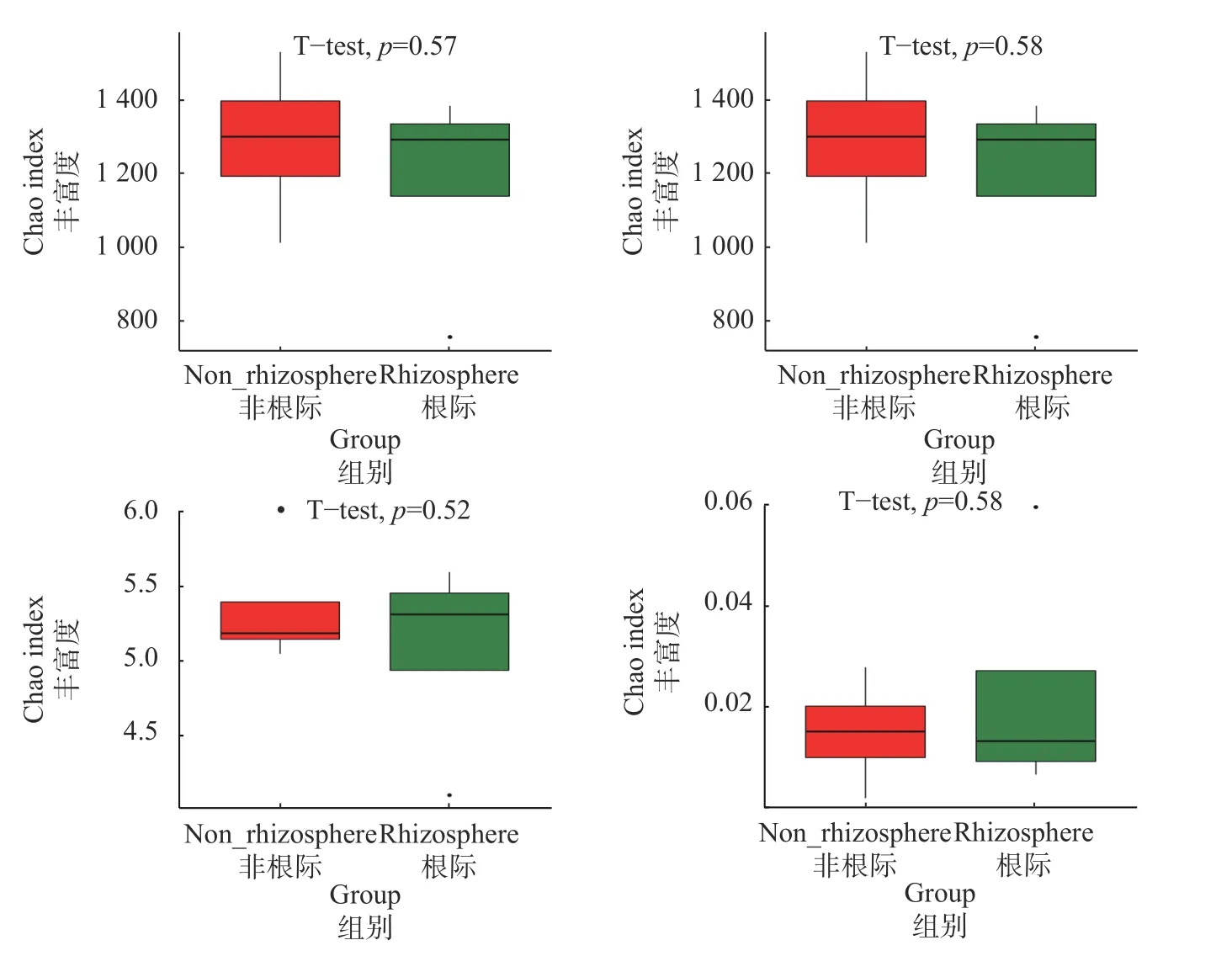
图 5 七叶一枝花土壤样本的Alpha多样性指数Fig. 5 Alpha? diversity of soils
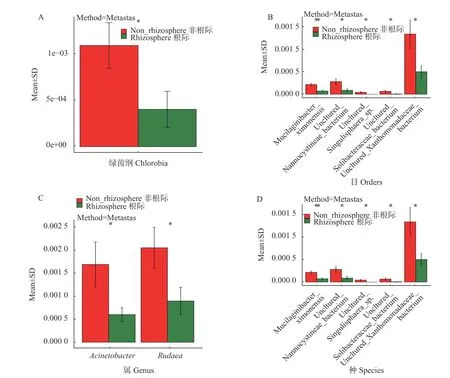
图 6 纲(A)、目(B)、属(C)和种(D)水平的微生物组间群落显著性差异Fig. 6 Differentially abundant groups on class level (A), order level (B), genus level (C), and species level (D)
图 7 LDA EffectSize组间群落差异Fig. 7 LDA Effect Size of differentially abundant groups
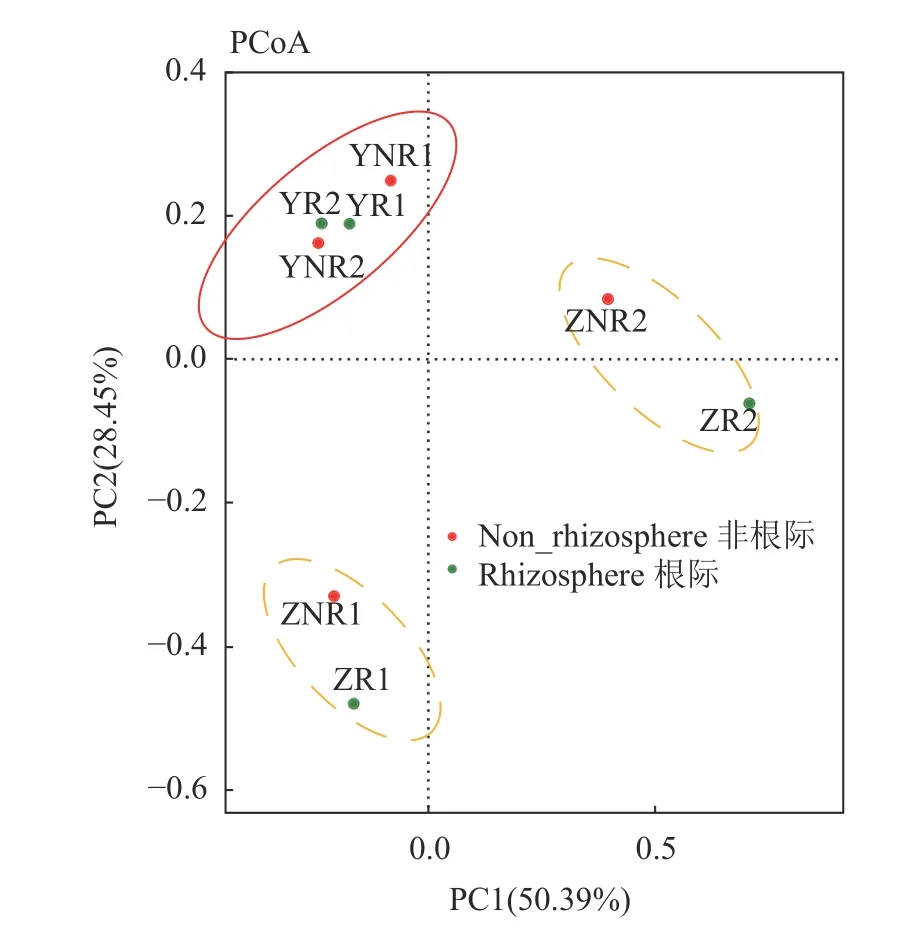
图 8 基于OTU水平的PCoAFig. 8 Principal co-ordinates analysis (PCoA) based on OTU of 8 samples
2.7 七叶一枝花根际和非根际的热图分析
七叶一枝花根际和非根际的热图分析如图9所示,按栽培模式的不同,样本聚成4类:野生七叶一枝花的土壤(YR1和YNR1)、野生七叶一枝花的土壤(YR2和YNR2)、移栽5年的七叶一枝花土壤(ZR1、ZNR1)和移栽2年的七叶一枝花土壤(ZR2和ZNR2),说明七叶一枝花的根际和非根际土壤没有显著差异。
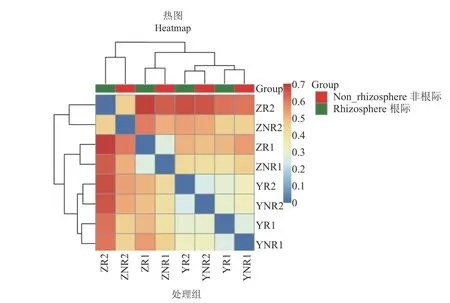
图 9 七叶一枝花根际和非根际土壤的unweighted.unifrac差异性矩阵热图(相似水平97%)Fig. 9 Heatmap of unweighted.unifrac dissimilarity matrix of soils
3 讨论与结论
土壤微生物是土壤的重要组成部分,土壤微生物群落多样性可敏感地反映出土壤质量的变化,土壤微生物种类和数量可以作为评价土壤肥力的指标[11]。在土壤生态系统中土壤微生物及其与生物环境之间的关系复杂多样,土壤生物之间存在相互依赖、彼此制约的关系,同时又与周围的环境因子相互作用、往复调控[12]。本研究中七叶一枝花土壤中共检测到包括变形菌门、酸杆菌门、放线菌门、厚壁菌门、拟杆菌门、硝化螺旋菌门和绿弯菌门等21门细菌。其中移栽后根际土壤微生物多样性低于非根际土壤。并且随着移栽后时间的推移,根际土壤中细菌的丰富度先升高后降低,说明七叶一枝花对根际的土壤细菌影响较大,可能是由于其根际形成优势菌群,所以根际土壤细菌的丰富度相对较低,并且在移栽2年后的丰富度最低,而移栽5年后的土壤细菌的丰富度与野生的土壤相当,说明七叶一枝花可能对土壤微生物群落具有调节作用[13]。殷全玉[14]研究表明延边地区植烟土壤中放线菌门为主要的土壤微生物类群。黄珍等[15]研究表明海南香蕉园中土壤样本中的主要细菌类群是变形菌门、厚壁菌门和酸杆菌门。本研究中七叶一枝花含量最为丰富的是变形菌门,其次是酸杆菌门和放线菌门。说明不同根际环境的微生物优势菌群存在差异,本研究的七叶一枝花土壤样本具有一般土壤微生物群落组成的共性。
七叶一枝花土壤样本在门水平和科水平没有显著差异。在纲水平,具有显著差异的是绿菌纲Chlorobia,其在七叶一枝花根际土壤中的含量低于非根际土壤。在目水平,七叶一枝花根际土壤中绿菌目Chlorobiales和粘球菌目Myxococcales含量显著低于非根际土壤。在属水平,在七叶一枝花根际土壤中不动杆菌属Acinetobacter的含量显著低于非根际土壤的含量。根际土壤中芽孢杆菌Bacillus、溶杆菌属Lysobacter、伯克氏菌属Burkholderia、类芽孢杆菌Paenibacillus、Bryobacter和嗜酸栖热菌属Acidothermus的丰度大于非根际土壤。芽孢杆菌Bacillus属于促生菌,具有促进植物生长,减少植物病虫害的作用[16]。类芽孢杆菌Paenibacillus具有良好的解钾溶磷促生和共生固氮功能[17],能够释放钾素,产生有机酸、氨基酸、激素等物质,改善植物营养,促进植株生长[18]。伯克氏菌属Burkholderia对于生物降解、农业中的生物控制及促进植物生长的根圈微生物的生长等具有重要作用[19]。在七叶一枝花的根际土壤中芽孢杆菌Bacillus、类芽孢杆菌Paenibacillus和伯克氏菌属Burkholderia等菌群的丰富度高于非根际土壤,说明根际土壤中有益菌群的数量多于非根际土壤,这些有益菌群可以增加七叶一枝花对土壤中钾、磷、氨基酸以及其他微量元素和有机物质的吸收,从而促进七叶一枝花的生长,对改善根际土壤环境具有重要的作用[20]。说明根际具有更优的微生物群落多样性。
