濒危半红树植物玉蕊对潮汐淹浸逆境的应答特性分析
2020-03-02潘艳菊吴玉霜梁泽锐赵仕花檀小辉
梁 芳,潘艳菊,邓 旭,吴玉霜,梁泽锐,赵仕花,檀小辉
(1. 玉林师范学院,广西 玉林 537000;2. 广西壮族自治区亚热带作物研究所,广西 南宁 530001)
0 引言
【研究意义】红树林在潮间带多重胁迫因子的作用下,造林的成活率比较低,海水盐度过高和海水淹浸时间太长是导致我国红树林造林成活率低的主要原因[1],半红树植物是构成红树林防风、消浪林带的重要组成部分,具有独特的生境适应性和生态功能,对湿地恢复和海陆的生态衔接具有极其重要的价值。玉蕊(Barringtonia racemosa)是典型的半红树植物,也是极具开发价值的园林景观树种,具有很强的观赏价值[2]及药用价值[3−5]。其原产于非洲、亚洲和大洋洲的热带和亚热带地区。在我国天然分布于海南、台湾、云南、广西和广东等省区[6],但数量极少,2017年玉蕊已被列为中国“濒危植物”[7]。玉蕊适生于高潮位低盐度的滨海沿岸,常与海滨红树植物混生,但对其潮汐淹浸逆境下的适应性和耐受性尚未见研究报道。因此,开展玉蕊对潮汐淹浸胁迫的生长生理及矿质元素的应答特性研究,获得玉蕊耐水淹能力和适应能力,对选择区域性耐水淹树种,恢复半红树林群落结构,增加红树林海域的物种多样性,保护玉蕊种群,平衡红树林生态系统,缓解生态危机,意义重大。【前人研究进展】蔡志全等[8]研究发现热带雨林4个冠层种(望天树Shorea chinensis、绒毛番龙眼Pometia tomentosa、团花Anthocephalus chinensis、滇南红厚壳Calophyllun polyanthum)的气孔密度和气孔导度的可塑性显著高于玉蕊,而在遮荫条件下,上层树种滇南红厚壳受到的影响比中层树种玉蕊大,表明玉蕊具有一定的耐阴性[9]。钟军弟等[10]研究显示雷州九龙山红树林国家湿地公园玉蕊种群已呈衰退趋势,亟需保护。同时,郭程轩等[11]研究认为雷州半岛红树林玉蕊群落主要受到植物入侵、河流改道及病虫害的共同干扰,这3种干扰造成玉蕊的潜在生态损失最大可达24.9万元·年−1。梁芳等[12]研究发现玉蕊对0‰~14‰浓度的盐胁迫具有一定的耐受性和适应性。【本研究切入点】目前,半红树植物玉蕊因原生境退化或丧失,栖息地质量下降已被列为中国濒危植物,玉蕊野生种质资源亟需引种保护,但国内外学者仅在园林应用、生态习性、种群动态、盐胁迫生理特性、生态价值及药用价值上研究,缺乏对玉蕊在潮汐淹浸逆境下适应机制的研究,从而限制了红树林造林树种选择及对玉蕊的迁地保护。【拟解决的关键问题】本研究对玉蕊进行不同淹水时间梯度胁迫试验,测定分析其幼苗在潮汐淹浸逆境下的植株形态、生理生化及矿质元素的应答特性,为玉蕊在城市内河、滨湖、湿地恢复等景观应用中的适宜淹水时长选择提供科学依据,为玉蕊种质资源迁地保护提供重要参考。
1 材料与方法
1.1 试验材料
玉蕊种子为海南省儋州市种源,于2016年9月随采随播于玉林师范学院桂东南花卉繁育基地温室大棚沙床内,试验于2017年3月,待出苗后苗高20 cm时,将供试玉蕊幼苗分别植入试验花盆(规格为口径30 cm,高28 cm)内,每盆栽1株,盆内装土1.5 kg,所用土壤为果园土∶ 椰糠=1∶1(体积比),待苗木移栽后,充分浇水,正常管护生长1年7个月后作为试验用苗。
1.2 主要仪器及试剂
根系扫描仪(MRS-3200A3L,MICROTEK,上海中晶科技有限公司);根系分析系统(万深LA-S);Varioskan LUX多功能酶标仪(Thermo Varioskan,新加坡);高智能多参数土壤肥料养分检测仪(锦农牌JN-G02型,郑州锦农科技有限公司);硝态氮、有效磷、有效钾、Fe及Cu元素的测定试剂均购自郑州锦农科技有限公司。
1.3 试验设计
试验在玉林师范学院桂东南花卉繁育基地温室大棚(22°64′N,110°14′E)中进行,起止时间为2018年11月11日至2019年7月19日,整个试验通过建立人工模拟湿地系统,由储水槽、植物培养槽,定时器、水泵、过滤系统、补光系统及遮阴系统等组成模拟潮汐自动控制装置,即用定时器来自动控制各处理槽里水泵的抽水时间,达到所设置的淹水水位和淹水时长梯度。槽内水为自来水,每7 d更换一次,每天补充适量自来水以保持水位稳定。胁迫试验于2018年11月11日开始进行,分别选择生长良好、长势基本一致的99盆玉蕊幼苗作为试材,模拟半日潮方式以每12 h为一个淹水周期,设10个淹水时长梯度(即按淹水2、4 、6 、8 、10 、12 、14、16 、18 、20 h·d−1的梯度)开展试验。每个处理9株幼苗,3次重复,淹水水位均设置为淹至枝下高;以不淹水、正常浇水的植株作为空白对照组(CK)。每28 d测定一次生长指标,250 d停止处理后采样,取玉蕊幼苗中上部成熟健康叶片测定玉蕊各生理指标。试验处理期间,温室大棚内环境使用温湿度记录仪监测,其中最高温度为46.7 ℃,最低温度为6 ℃,平均温度为22.4 ℃,最高湿度为99.9%,最低湿度为26.3%,平均湿度为86.6%。
1.4 测定项目与方法
1.4.1 生长指标的测定 形态指标以处理前后株高、地径、叶片数、叶面积、皮孔数、气生根数、主根表面积、侧根表面积的变化情况表示:
株高:在淹水处理前后,用卷尺测定植物株高(精确到 0.1 cm),每株测定 3 次,取平均值。按公式(1)计算株高增长量(H)。
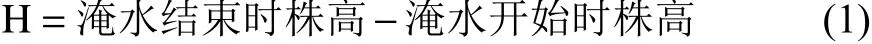
地径:每株用游标卡尺东西南北方向各测定两次(精确到 0.02 mm),取平均值,测定的植株选择同上。按公式(2)计算地径增长量(D)。
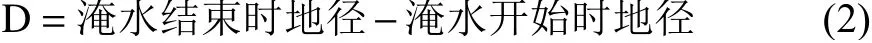
叶片数:植株叶片数直观且容易测定,直接读取,记录数据。按公式(3)计算叶片数变化量(L)。
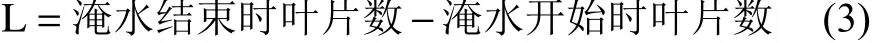
皮孔及气生根数:试验结束后将各处理植株从处理槽全部取出,皮孔以在玉蕊植株淹水部分茎干上产生膨大裂开外翻成白色突起物为主要识别特征。气生根是由植株茎基部的节上环生不定根,伸入水或土壤中,并继续产生正常的侧根,以长度大于等于1 mm为统计特征。从单株茎干基部往上至植株高处之间直接观察并统计茎干表面的皮孔及气生根数量,每株重复统计3次,取平均值。
主侧根表面积测定:在盛有清水培养皿中,待根系完全舒展后用根系扫描仪扫描,然后通过植物根系分析系统得到根系表面积数据。
1.4.2 生理生化指标的测定 试验停止处理后,从每个处理中长势均匀的植株上同一部位选取无病虫害的成熟功能叶测定生理生化指标,超氧化物歧化酶(SOD)活性测定采用氮蓝四唑(NBT)法;叶绿素a含量、叶绿素b含量、叶绿素总量及过氧化氢酶(CAT)活性测定均采用紫外吸收法;过氧化物酶(POD)活性测定采用愈创木酚法;丙二醛(MDA)含量的测定采用硫代巴比妥酸(TBA)氧化法;可溶性蛋白含量测定采用考马斯亮蓝G-250染色法;可溶性糖含量测定采用蒽酮法;游离脯氨酸含量测定采用茚三酮比色法。吸光值测定均使用Varioskan LUX多功能酶标仪测定,本实验中各生理生化指标测定均参照李玲主编的《植物生理学模块实验指导》中的方法测定[13]。
1.4.3 矿质元素的测定 取玉蕊植株同一部位新鲜叶片,用干布擦净剪成1~2 mm碎片,混匀后放入研钵中研磨至有汁液浸出,然后用低速离心机离心,用胶头滴管吸取上清汁液2滴置于10 mL量筒中,加水至10 mL,即为待测液,混匀备用,即为100倍稀释汁液,再加入该元素对应的试剂反应,待反应结束后立即使用高智能多参数土壤肥料养分检测仪测定硝态N、有效P、有效K含量。用胶头滴管取上清汁液4滴置于10 mL量筒中,加水至10 mL,即为待测液,混匀备用,根据不同元素加入不同药品试剂反应,反应结束后即可上机测定Fe、Cu元素。每个处理重复测定3次,取平均值。
1.5 数据处理
所有试验数据采用Excel 2007整理后再用GraPhPad Prism7.0软件制图,数据统计分析使用SPSS 19.0软件,平均值间的比较采用单因素方差分析(One-way ANOVA),多重比较采用邓肯多重范围检验(Duncan’s multiple range test);显著性检验水平均设置为0.05。同时采用主成分分析法明确各指标贡献值,基本参照张力等[14]的方法计算相关系数(r)及相关矩阵(R):应用Jacbi法,根据相关矩阵(R)得到特征矩阵,解得m个特征值λi(i=1,2,…,m)及对应的特征向量li(i=1,2,…,m);计算主成分zk的贡献率及 前p个主成分的累积贡献率如果的累计贡献率已达到80%以上,则表示前p个主成分已能反映原有变量的绝大部分信息。
2 结果与分析
2.1 淹浸逆境对玉蕊幼苗生长指标的影响
生长指标是反应植物响应逆境胁迫最直接的指标[15]。从图1可知,不同时长的潮汐淹水胁迫对玉蕊植株形态有显著影响。试验期间玉蕊植株的株高,地径、叶片数均有所增加,但随着淹水时长的增加,玉蕊株高及叶片数量的增长均呈下降趋势。各处理植株较CK组均呈显著差异(P<0.05)(图1-A、1-C),表明淹水胁迫显著减缓了玉蕊株高及叶片的生长。地径的生长随着时长增加呈先升高后降低的趋势。地径增量高峰值在淹水6 h·d−1处理组,是CK组的144%,较CK组呈显著差异(P<0.05);低峰值是淹水18 h·d−1处理组,是CK组的85%,较CK组差异不显著(图1-B),表明淹水时长≤14 h·d−1时可促进植株地径生长。同时,从图1-D可知,随着淹水时长的增加,各处理的玉蕊叶片面积呈明显下降趋势,各处理组叶面积较CK组均呈显著差异(P<0.05)(淹水2 h·d−1、4 h·d−1处理组除外,但均小于CK组)。可见淹水时长≥6 h·d−1时,玉蕊叶面积的生长受到显著抑制,在一定程度上降低了蒸腾速率,以适应淹水胁迫环境。
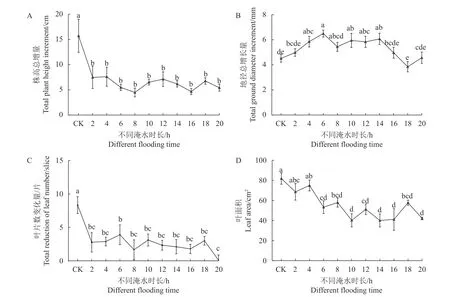
图 1 淹浸逆境对玉蕊株高、地径、叶片数及叶面积的影响Fig. 1 Effects of flooding on plant height, underground trunk girth, leaf number, and leaf area of B. racemose
由图2-A可知,气生根数量随着淹水时长的增加而增多。当淹水时长≥8 h/d时,玉蕊茎干基部气生根数量显著上升。根系穿袋数量先升后降,淹水时长为4~18 h/d时,穿袋数量显著大于CK组及2、20 h·d−1处理组(P<0.05,图2-B)。皮孔数随着淹水时长的增加呈持续增加的趋势,其中淹水10、16、18、20 h·d−1处理组植株茎干皮孔数较CK组呈显著差异(P<0.05,图2-C)。可见,当淹水时长越长,植株茎干气生根数、皮孔数及根系穿袋数就越多,表明玉蕊植株在形态上表现出较强的适应能力。同时,不同淹水时长显著影响玉蕊主侧根的表面积大小。随着淹水时长的增加,各处理组玉蕊主根根系表面积较CK组整体呈显著下降的趋势(P<0.05),但淹水2 、14 h·d−1的除外,这两处理组主根表面积均高于CK组,且淹水2 h·d−1组较CK组呈显著差异(P<0.05)(图2-D)。玉蕊各处理植株侧根根系表面积呈先升高后降低再升高的变化趋势,其中淹水2、4、12、14 h·d−1处理组的侧根根系表面积显著高于CK组(P<0.05)(图2-E)。可见当淹水时长为2 、14 h·d−1时,玉蕊的主侧根系更积极响应逆境胁迫。
2.2 淹浸逆境对玉蕊幼苗生理生化指标的影响
2.2.1 对玉蕊幼苗叶绿素含量的影响 叶绿素含量是反映逆境条件下叶片生理性状的重要指标[16]。由图3-A可知,随着淹水时长的增加,玉蕊叶片的叶绿素a含量整体呈下降趋势。最小值出现在淹水时长14 h·d−1处理组,其叶片叶绿素a含量是CK组的86.71%,较CK呈显著差异(P<0.05)。玉蕊叶片的叶绿素b含量随着淹水时长的增加有升有降,当淹水时长位于2、6、8、12、18、20 h·d−1时,各植株叶片叶绿素b含量较CK组呈显著差异(P<0.05)。最大峰值出现在淹水时长18 h·d−1处理组,是CK组的153.69%;最低值出现在淹水16 h·d−1,是CK组的96.22%,较CK组无显著差异(图3-B)。玉蕊植株叶片叶绿素总量整体呈下降趋势(淹水16 h·d−1组植株除外),较CK组均呈显著差异(P<0.05),但淹水处理10、16 h·d−1组植株除外(图3-C)。可见潮汐淹浸逆境对玉蕊植株叶片的叶绿素a、叶绿素b及叶绿素总含量影响较大。
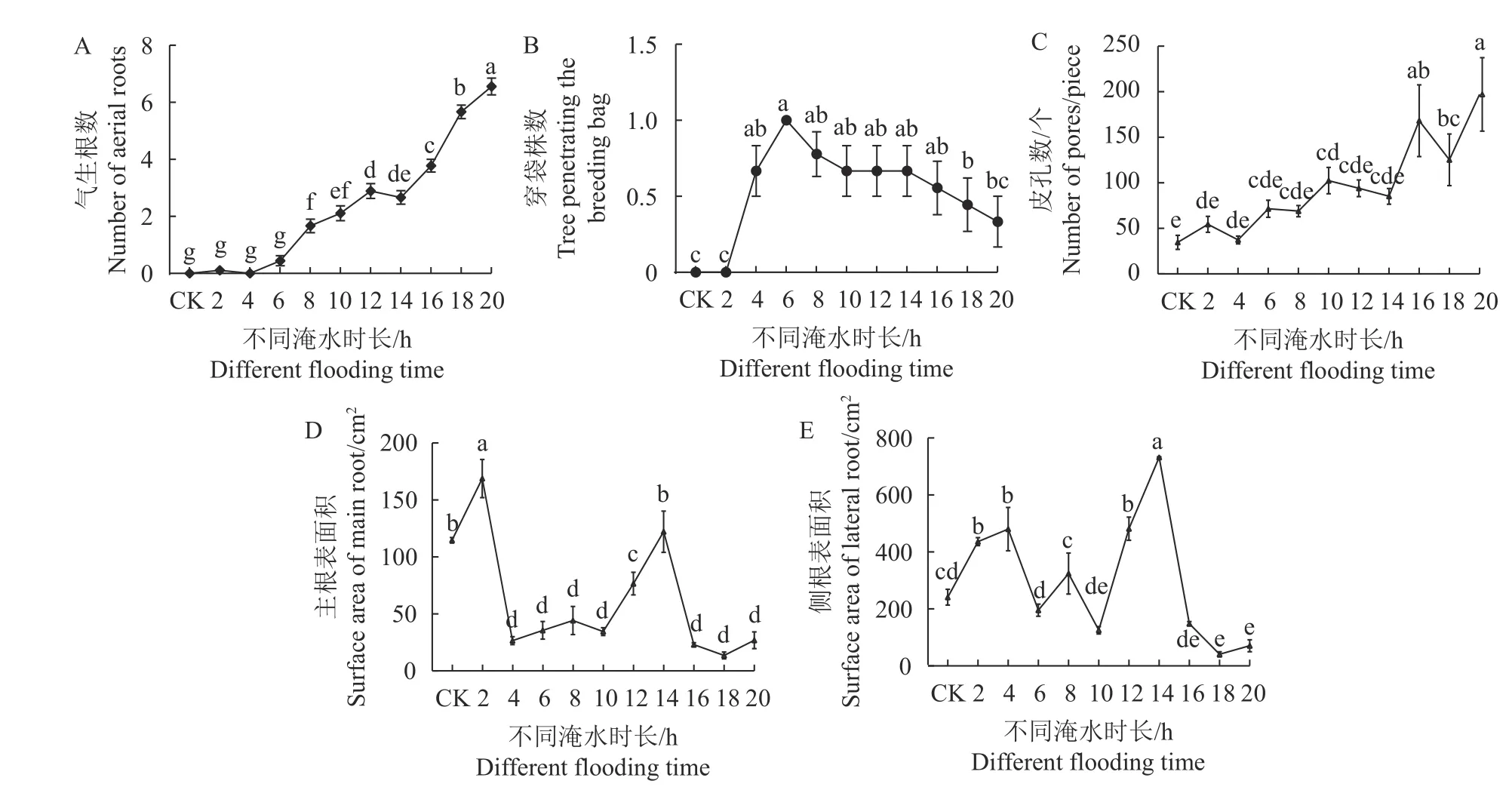
图 2 淹浸逆境对玉蕊气生根数、穿袋株数、皮孔数及主侧根表面积的影响Fig. 2 Effects of flooding on numbers of aerial roots, piercing plants, and lenticels and surface area of main and lateral roots of B. racemose
2.2.2 对玉蕊幼苗叶片酶系统的影响 SOD、POD和CAT作为植物内源的活性氧清除剂,属于保护酶系统[12]。由图4-A可知,随着淹水时长的增加,玉蕊幼苗叶片的SOD活性整体呈先降后升的趋势,其中最小值出现在淹水14 h·d−1处理组,是CK组的92.66%,较CK呈显著差异(P<0.05),其他处理组较CK均无显著差异。POD活性整体变化有升有降,其中最大值出现在淹水16 h·d−1处理组,是CK组的208.21%,最小值出现在淹水6 h·d−1,是CK组的38.21%,淹水16 h·d−1处理组较CK组呈显著差异(P<0.05),其他处理组较CK组均无显著差异(图4-B)。CAT活性整体呈双峰变化,即双高峰值分别出现在淹水时长6 、12 h·d−1,双低峰值分别出现在淹水时长2 、16 h·d−1,但各处理组CAT活性较CK组均差异不显著(图4-C)。可见,不同淹水时长处理下,玉蕊幼苗叶片的SOD、POD和CAT三种保护酶对潮汐淹浸
2.2.3 对玉蕊幼苗叶片渗透物质及细胞膜的影响 淹浸逆境下,植物细胞通过调节渗透物质的含量来保持渗透势的平衡,保证淹水条件下的生命活动[15]。随着淹水时长的增加,玉蕊幼苗叶片的游离脯氨酸含量整体呈先升后降的趋势。最大值出现在淹水10 h·d−1处理组,分别是CK组、最小值处理组的282.83%、412.99%,较CK组及其他处理组均呈显著差异(P<0.05,图5-A)。可溶性糖含量整体变化有升有降,淹水2、6、10、12、14 h·d−1处理组较CK组均呈显著差异(P<0.05),其中最大值出现在淹水10 h·d−1处理组,分别是CK组、最小值处理组(18 h·d−1)的196.94%、193.34%(图5-B)。淹水4、6、12、14、16、20 h·d−1处理组可溶性蛋白含量较CK组均呈显著差异(P<0.05),其中最大值出现在淹水20 h·d−1处理组,最小值出现在CK组(图5-C)。玉蕊叶片的MDA含量整体变化呈上升趋势(14 h·d−1除外),淹水2、4、8、10、20 h·d−1处理组的MDA含量显著高于CK组(P<0.05,图5-D)。可见,不同淹水时长的逆境胁迫下,玉蕊叶片细胞膜透性受到一定伤害,但其渗透调节物质游离脯氨酸、可溶性糖、可溶性蛋白均做出了积极的响应,尤其是淹水10 h·d−1处理组的玉蕊植株表现出最强的抗性。
2.3 淹浸逆境对玉蕊幼苗叶片矿质元素的影响
2.3.1 对玉蕊幼苗叶片大量元素的影响 N、P、K元素是植物生长发育不可缺少的营养成分[17]。由图6可知,潮汐淹浸逆境胁迫对玉蕊叶片的N、P、K元素含量的影响达到了显著水平。当淹水时长为12~20 h·d−1时,叶片的硝态N元素含量显著上升,其中最大峰值出现在淹水12 h·d−1处理组,是CK组的881.81%,较CK组与剩余处理组均呈显著差异(P<0.05,图6-A)。玉蕊叶片有效P元素含量随着淹水时长的增加,整体呈先升后降的趋势,最大峰值出现在淹水8 h/d处理组,是CK组的223.07%,较CK组及其他处理组均呈显著差异,最小值在淹水20 h·d−1处理组,是CK组的65.76%,较CK组及其他处理组均呈显著差异(P<0.05,图6-B),但淹水12、16、18 h·d−1处理组的除外。玉蕊叶片有效K元素含量随着淹水时长的增加,整体呈急剧下降的变化趋势,各处理组叶片有效K含量均显著低于CK组(P<0.05,图6-C)。表明淹浸胁迫在一定程度上促进叶片大量元素N和P的吸收,但显著抑制K元素的吸收。
2.3.2 对玉蕊幼苗叶片微量元素的影响 Fe、Cu元素是植物形成叶绿素所必需的微量营养元素,与植物叶片的光合作用相关[18]。由图7-A可知,随着淹水时长的增加,玉蕊幼苗叶片的Fe元素含量整体呈先升后降的趋势,但均大于CK组,最大值出现在淹水10 h·d−1,是CK组的180.02%,较CK组及其他处理组均呈显著差异(P<0.05),淹水8 h·d−1除外。淹水时长≤12 h·d−1的处理组叶片Cu含量较CK均无显著差异,淹水时长在14 ~20 h·d−1时,叶片Cu含量明显下降,较CK组均呈显著差异(P<0.05,图7-B)。可见淹水胁迫会促进玉蕊叶片对Fe元素的吸收,但当14 h·d−1≤淹水时长≤20 h·d−1时,会抑制叶片Cu元素的吸收,以减轻离子毒害。
2.4 主成分分析
由表1可知,本试验所测定的22个应答指标中,前7个特征根累积贡献率达82.462%,说明22个指标中的绝大部分信息可由这7个主成分来概括。
第1主成分的特征值4.679,贡献率为21.267%,逆境的响应程度不一。玉蕊叶面积在第1主成分中的特征值最大,说明叶面积是主成分的主要构成因素,其次是株高和叶片数,因此把第1主成分称之为叶面积因子。在此成分中,地径、皮孔数、叶绿素b、POD活性、CAT活性、脯氨酸含量、可溶性糖含量、可溶性蛋白含量、硝态N含量、Fe含量均为负值,这10个指标是植株受到胁迫环境的响应指标,若增大叶面积、株高及叶片数,在以提高玉蕊适应逆境为目标的方面考虑,第1主成分特征值不宜过大。
第2主成分的特征值为4.155,贡献率为18.888%,在第2主成分中叶片P元素含量的特征向量值最大,为0.877,说明对P元素含量第2主成分的影响最大,接着是可溶性糖含量、脯氨酸含量,将第2主成分称之为P元素含量因子。由第2主成分特征向量值看出株高、叶片数、皮孔数、叶绿素总量、POD活性、可溶性蛋白含量、硝态N含量、K含量均为负值,说明若要降低株高、叶片数、皮孔数、叶绿素总量的生长,可多施入P元素。
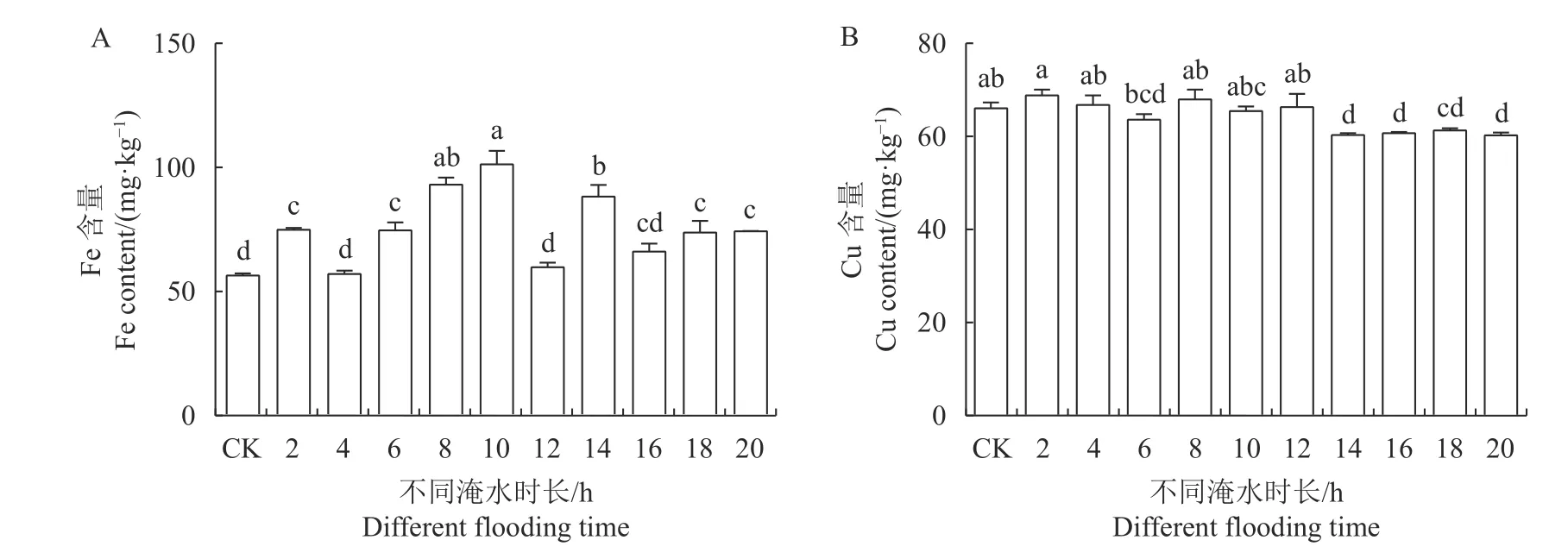
图 7 淹浸逆境对玉蕊叶片铁、铜离子的影响Fig. 7 Effects of flooding on Fe and Cu ions in B. racemosa leaves
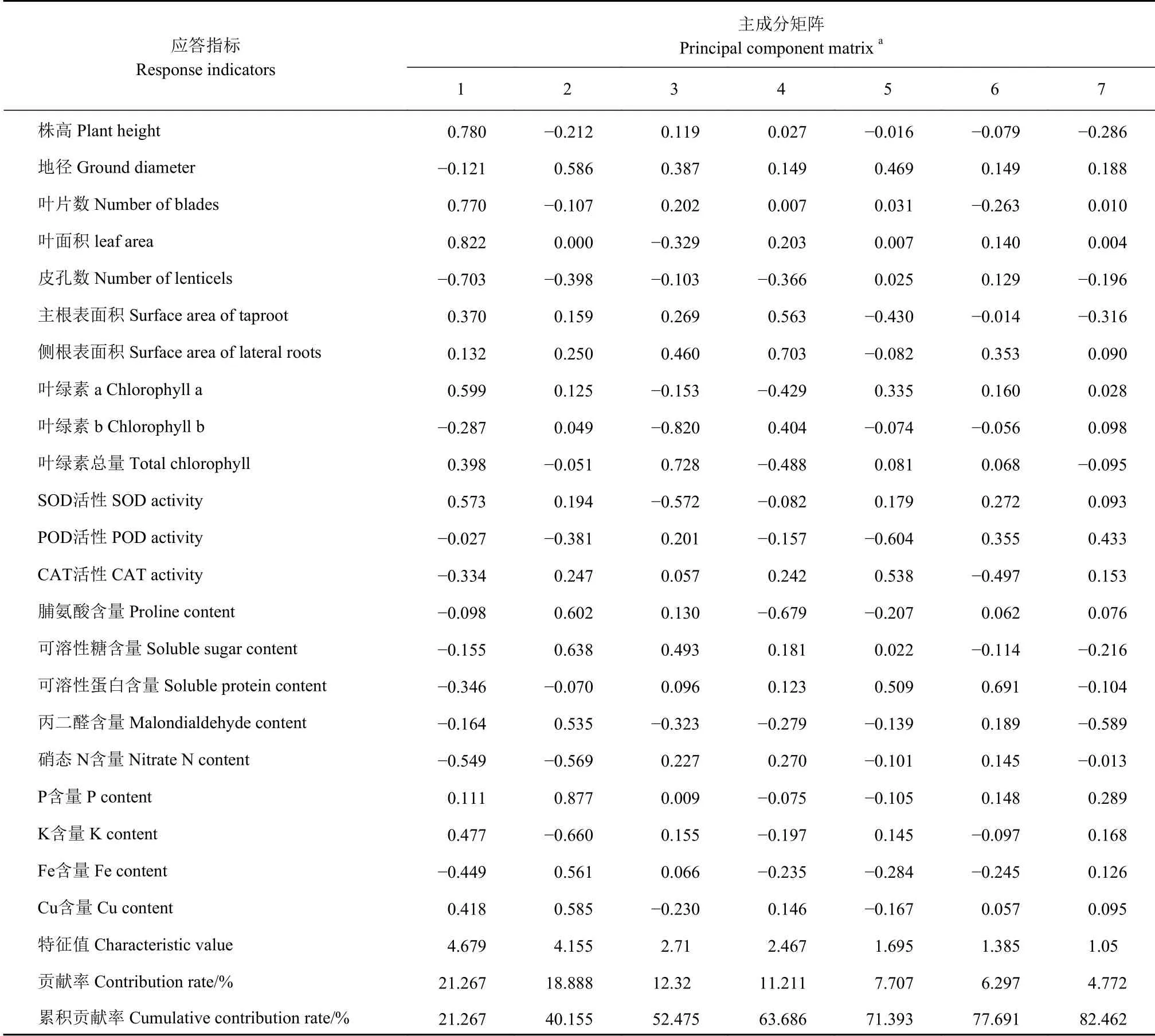
表 1 玉蕊对淹浸逆境应答指标的主成分分析Table 1 Principal component analysis on responses of B. racemosa to flooding
第3主成分的特征值是2.71,贡献率13.32%,在第3主成分中叶绿素总量的特征向量值最大,其次是侧根表面积、可溶性糖含量,故称第3主成分为叶绿素总量因子。第4主成分的特征向量值为2.467,贡献率12.211%,在第4主成分中侧根表面积的特征向量值最大,其次是主根表面积,所以称第4主成分为侧根表面积因子。在第4主成分中,叶绿素总量、叶绿素a及脯氨酸含量的特征向量值呈较低负值,说明侧根表面积越大,则会影响叶片脯氨酸、叶绿素总量及叶绿素a的含量,表明若加速玉蕊根系部分的生长会影响叶片的光合能力。
在第5主成分中CAT活性的特征向量值最大,所以称第5主成分为CAT活性因子,最小特征是POD活性且为负值;第6主成分为可溶性蛋白因子,最小特征是CAT活性且为负值;第7主成分为POD活性因子,最小特征值是丙二醛含量且为负值,综合第5、6、7主成分可见,CAT、POD及可溶性蛋白是玉蕊应答淹浸逆境重要的生理指标,叶片保护酶系统物质CAT与POD、可溶性蛋白均出现错峰调控响应,最终以降低丙二醛含量,减少细胞膜透性的损伤。
由主成分分析可知,叶面积、叶片磷元素含量、叶绿素总含量、侧根表面积、CAT活性、POD活性、可溶性蛋白含量是组成玉蕊植物应答胁迫的主要指标,若要提高玉蕊对潮汐淹浸逆境的耐受性和适应能力,玉蕊自身可通过减少叶面积、株高、叶片数的生长,增加侧根表面积、提高叶绿素总量以及CAT、POD活性、可溶性蛋白含量,同时管护中可适当施入N、P元素等抵抗逆境。
3 讨论
3.1 形态应答
形态指标是反映植株响应生长环境最直观的方法之一。淹水胁迫是整个植株甚至是单个叶片都可以对缺氧产生反应并发展出适应策略,淹水会造成低氧和低光照的环境条件,直接限制植物的根系有氧呼吸和叶片光合作用,从而影响其生长发育过程和生物量积累[15,19]。研究发现,盐碱湿地植物面对淹水胁迫时,绝大多数在形态和资源分配上表现出增加株高、改变叶片形状及面积、调整生物量积累与分配、增加根部通气组织等响应策略[20]。曹福亮等[21]研究报道,乌桕(Sapium sebiferum) 淹水胁迫时株高生长受到抑制。本研究中,玉蕊幼苗经过250 d的潮汐淹浸逆境胁迫处理都能存活,其株高、叶片数、叶面积都显著低于对照植株,穿袋株数量、产生气生根及皮孔的数量均显著高于对照组。而玉蕊在淹水逆境中通过增大地径,植株被水淹没的茎干形成皮孔,产生较多气生根,形成发达的通气组织,且各处理组部分植物根系穿袋从土壤中延伸至水里,均可促进氧气运送到根部,不同程度缓解其地下根系的低氧状态。可见玉蕊对潮汐淹浸逆境有较强的形态适应机制,从而保证自身的生存发育。研究结果与淹水胁迫下紫穗槐(Amorpha fruticosa)幼苗的形态响应结果一致,王瑞研究发现紫穗槐通过在水环境中的茎上长出水生不定根和发胀膨大的特化皮孔形成的通气结构,来适应淹水而导致的缺氧等不利生长条件[22]。
3.2 生理生化应答
植物淹水会导致植株光合作用和呼吸作用的减少,长期淹水迫使植物发展保护机制以减轻缺氧的有害影响。本研究中,玉蕊叶片叶绿素a及叶绿素总量随着淹水时长的增加整体呈下降趋势,叶绿素b含量有升有降,可见潮汐淹浸逆境迫使玉蕊叶绿素含量降解,降低了叶片光合能力,对植株有一定的损伤,与张博宇等[23]、吴红强等[24]、张晓平等[25]研究认为淹水胁迫会降低叶绿体活性的观点一致。
淹水胁迫引起弱光环境,使气体扩散受限,植物通过生理生化机制的调节来保证淹水条件下的生命活动[15],而对于淹水木本植物生存的最关键因素是调控和适应淹水和非淹水阶段的能量代谢和可利用能量[26]。本研究中,随着淹水时长的增加,玉蕊叶片的丙二醛含量整体变化呈上升趋势(14 h·d−1除外),且淹水2、4、8、10、20 h·d−1处理组的丙二醛含量均显著高于CK组。可见,不同淹水时长的逆境胁迫下,玉蕊叶片细胞膜透性受到一定伤害,但其通过启动SOD、POD和CAT保护酶系统,以清除自由基。同时提高渗透调节物质游离脯氨酸和可直接供能物质可溶性糖、可溶性蛋白含量,以适应淹水胁迫水下部分高能耗的能量需求,减轻或避免淹浸逆境对植株的伤害。各处理组中淹水10 h·d−1处理组的玉蕊植株表现出最强的抗性,而淹水14 h·d−1组植株MDA较CK组没有升高,说明叶片细胞膜透性未被损害,这可能是由于该处理组侧根面积最大,提高了根冠比,同时保护酶、渗透物质及供能物质以及Fe、P等离子共同调控的结果。这与张晓平等[25]研究认为耐淹涝胁迫植物有其自身的适应和保护机制的观点一致,Chen等[27]的研究发现耐淹能力强的植物秋茄(Kandelia obovata)当幼苗淹水8 h·d−1时,其通过提高叶片的SOD和POD活性来增强幼苗抗逆性。
3.3 矿质元素应答
植物通过根系吸收矿质元素,然后再输送到其他部位,而植物长时间淹水浸泡会使其根部严重缺氧,有机物利用率低,矿质元素吸收下降[28]。但对于耐水淹的植物情况并非完全如此,本研究中,淹浸胁迫在一定程度上促进叶片大量元素N、P吸收,当淹水胁迫时间≥12 h·d−1时,促进了叶片对N元素的吸收和积累;淹水胁迫时间在2~16 h·d−1时促进了叶片对P元素的吸收,这与罗美娟等[29,30]对红树植物桐花树(Aegiceras corniculatum)的研究结果相似。Rubio等[31]指出大多数红树植物中存在有效地吸收K的机制,本研中发现淹水胁迫反而显著抑制了玉蕊叶片对K元素的吸收,这与红树植物桐花树对淹水胁迫的响应相反。可能是由于半红树植物玉蕊与大多数红树植物应对淹水胁迫时离子调控机制不同的结果。
淹水条件下植物叶片Fe的部分积累可促进其光合作用,对其生长有利,但淹水时间过长,Fe等积累过量会对细胞造成毒害作用。有研究发现,由于受淹涝植物生长比较慢,植物体内的Fe含量反而下降[32]本试验中随着淹水时间的延长,叶片中的Fe含量先升高后降低,当淹水时长>12 h·d−1时,Cu含量显著降低,这表明玉蕊在淹水胁迫下具有一定的离子调控机制及保护机制,以避免离子毒害。
4 结论
玉蕊对淹水时长≤20 h·d−1的半日潮淹浸逆境有很强的耐受性和适应性,可配植于城市内河易淹水的岸域、滨湖绿带及淡水湿地等景观环境中;叶面积、叶片磷元素含量、叶绿素总含量、侧根表面积、CAT活性、POD活性、可溶性蛋白含量是玉蕊植物应答淹浸胁迫的主要指标;淹浸胁迫虽显著抑制植株形态生长,但逆境中玉蕊通过减少叶面积降低蒸腾速率、增多茎干皮孔数,形成大量气生根、根系穿袋及增大地径等途径,增强通气组织以适应逆境;当玉蕊幼苗淹水时长为10 h·d−1时,其通过提高脯氨酸、可溶性糖含量等途径,以适应淹水胁迫水下部分高能耗的能量需求,增强玉蕊对潮汐淹浸逆境的耐受性,从而保证自身的生存发育;当淹水时长为2~10 h·d−1时,管护中可适当施入P、Fe元素以提高玉蕊叶片的光合能力;当淹水时长≥12 h·d−1时,应增加硝态N的施入以提高玉蕊植株的抗逆性。
