乳清蛋白及其生物活性肽调节血糖功能研究进展
2020-03-01吴尚仪李乳姝石佳鑫李兰馨曹雪妍陶冬冰岳喜庆
吴尚仪,李乳姝,石佳鑫,李兰馨,曹雪妍,杨 梅,陶冬冰,岳喜庆*
(沈阳农业大学食品学院,辽宁 沈阳 110866)
糖尿病是一组以长期高血糖为主要特征的代谢综合征,由于胰高血糖素缺乏和/或胰岛素生物作用障碍导致糖代谢紊乱,同时伴有脂肪、蛋白质、水、电解质等代谢障碍,可并发眼、肾、神经、心血管等脏器的慢性损伤。糖尿病一般分为4 种:1型糖尿病、2型糖尿病、妊娠期糖尿病、其他糖尿病。1型糖尿病主要是因为胰岛B细胞被破坏、胰岛素绝对缺乏导致,绝大多数是免疫调节性疾病;2型糖尿病主要是从以胰岛素抵抗为主伴胰岛素分泌不足到胰岛素分泌不足伴胰岛素抵抗,是一种代谢疾病,这种慢性和多因素疾病的患病率和发病率正以惊人的速度在世界范围内不断增加,国际糖尿病联盟公布的第8版全球糖尿病地图显示,2017年全球糖尿病成人患者(20~79 岁)已达到4.25亿,我国为1.144亿,预计到2045年,糖尿病患者可能达到6.29亿[1];如果没有及时的预防治疗,2型糖尿病可引发严重的并发症,包括心血管疾病[2]、失明[3]、肾功能衰竭[4]等。糖尿病患者典型的症状为“三多一少”,即多饮、多食、多尿和体质量减轻,控制能量摄入是改善糖尿病症状的一种手段,我国唐代著名医学家孙思邈提出了糖尿病的运动饮食疗法[5],合理控制每日糖摄入量是预防控制糖尿病的有效手段之一。2017年新编的《AACE/ACE 2型糖尿病综合管理指南》、《中国糖尿病膳食指南(2017)》、《国民营养计划(2017ü2030)》中均提到通过膳食干预的方法来辅助治疗糖尿病。牛乳一直被营养专家评价为最好的营养品之一,民间还有“白色血液”之称,牛乳本身是低血糖生成指数(glycemic index,GI)食品,适合高血糖人群饮用;近年来研究表明,乳中的蛋白[6]、特定氨基酸序列[7]、游离氨基酸[8]均具有一定的调节血糖功能。乳清是奶酪或酪蛋白生产时,沉淀酪蛋白后剩余牛乳的液体部分,包含牛乳中55%的营养成分,其中乳清蛋白具有多种生物活性,可抑制饮食诱导的肥胖、葡萄糖不耐受和延迟2型糖尿病的发病[9];因此,乳清蛋白调节血糖生物活性的研究对于辅助治疗2型糖尿病、提升乳清蛋白产品附加值、开发调节血糖功能性产品都具有重要意义。国外对乳清蛋白的研究较多且较为深入,国内的研究相对较少。本文就近年来有关乳清蛋白及其生物活性肽调节血糖的研究进行综述,希望能为未来的研究提供方向和理论借鉴。
1 乳清蛋白简介
乳清蛋白是全价优质蛋白质,约占牛乳蛋白质的20%[10],乳清蛋白中主要组成蛋白有β-乳球蛋白(约占50%~55%)和α-乳白蛋白(约占20%~25%)[11],以及免疫球蛋白(约占10%~15%)、血清蛋白(约占5%)及少量乳铁蛋白[12],此外还含有高浓度的支链氨基酸亮氨酸、异亮氨酸、缬氨酸能够参与机体组织的修复和更新,对各种营养和激素信号产生响应,是组织生长和修复所需的重要成分[13]。目前关于乳清蛋白的研究集中于其抗氧化、调节血糖、调节血脂、抑菌[14]、缓解肌肉减少症[15]等功能性的研究,且基于乳清蛋白的功能已研发出了多种营养产品[16]。α-乳白蛋白和β-乳球蛋白氨基酸序列见图1,乳清蛋白产品及其功效见表1。

图 1 α-乳白蛋白和β-乳球蛋白氨基酸序列Fig. 1 Amino acid sequences of alpha-lactalbumin and beta-lactoglobulin

表 1 乳清蛋白产品及其功效[16]Table 1 Whey protein products and their health-promoting functions[16]
2 乳清蛋白调节血糖功能
早有学者报道摄入牛乳可一定程度降低血糖,Elmståhl等[17]研究了食用添加牛乳的高GI白面包粉和低GI面条粉对健康人餐后血糖和胰岛素反应的影响,在意大利面条粉中添加200 mL或400 mL的牛乳对志愿者葡萄糖曲线下面积没有影响;而与辅以水相比,辅以牛奶的意大利面条餐,显著提高了胰岛素曲线下面积,即辅以牛奶较辅以水可刺激更多胰岛素分泌。由此展开了对牛乳中主要调节血糖营养成分研究,其中对于酪蛋白的研究较多,目前已从牛乳中分离出具有较强生物活性的β-酪啡肽等,近年的研究逐渐集中于乳清蛋白。Jakubowicz[18]、Frid[19]等的研究均表明乳清蛋白有助于快速消化吸收碳水化合物、刺激血浆胰岛素浓度升高、降低餐后血糖水平,在健康人及2型糖尿病患者中均具有促胰岛素分泌作用。Olivos等[20]研究表明乳清蛋白能辅助增强降血糖药物的药效,乳清浓缩蛋白可增强西他列汀对二肽基肽酶-IV(dipeptidyl peptidase-IV,DPP-IV)的抑制活性;当乳清浓缩蛋白存在于胃肠道中时,能增强西他列汀对DPP-IV的抑制活性,从而促进胰高糖素样肽1(glucagon-like peptide-1,GLP-1)分泌,并改善血糖调节、抑制食物摄入。但有研究表明低分子质量的乳肽较未经酶解处理的乳清蛋白在体内能够发挥更大的生物价值[21]。Gaudel等[22]分别喂食ob/ob小鼠乳清蛋白水解物与乳清蛋白8 周,喂食乳清蛋白水解物组小鼠的胰岛素释放量明显高于喂食乳清蛋白组。对于乳清蛋白调节血糖的研究较多,初期大多数研究都基于受试者口服添加乳清蛋白食品,检测其餐后血糖等指标;随着调节血糖机理研究的不断深入,检测的指标变得更加具体全面,更利于推断其降糖机理。
3 乳清蛋白源生物活性肽调节血糖功能
目前已从乳中不同蛋白的降解产物中筛选出多种活性肽,如具有阿片肽活性的α-酪啡肽、β-酪啡肽、γ-酪啡肽[23]等,具有降血压活性的血管紧张素转换酶抑制肽[24],降胆固醇活性的IIAGLf(71~75)[25]等。大量实验证实了乳清蛋白的不完全酶解液中存在多种功能各异的生物活性肽类,这引起了学者的关注。乳清蛋白生物活性肽是乳清蛋白经肠道消化吸收、体外酶解或微生物发酵等方式切割成肽段,其中表达生物活性的固定氨基酸序列肽段称为乳源生物活性肽[26]。早有研究表明,乳清蛋白酶解物可通过促进葡萄糖转运至细胞内并储存于骨骼肌、增加促胰岛素分泌激素的释放等方式降低血糖[27]。而随着分离鉴定合成技术的发展进步,乳中生物活性肽的分离和分析应用研究更加深入,近年来有研究表明,乳清蛋白源生物活性肽调节血糖机理包括提高胰岛素敏感性[28]、抑制α-葡萄糖苷酶活性、抑制DPP-IV活性以及促进GLP-1、葡萄糖依赖性促胰岛素多肽(glucosedependent insulinotropic polypeptide,GIP)、胆囊收缩素(cholecystokinin,CCK)等促胰岛素释放激素释放[29-30]、控制血糖从而抑制食物摄入[20]、加速葡萄糖磷酸化过程进而提高体内葡萄糖代谢和利用[31]、增加腹饱感[32]等。
3.1 改善胰岛素抵抗
远端的胃、十二指肠、部分近端空肠等消化管腔黏膜上分布有大量K细胞,经食物刺激可分泌大量细胞因子-胰岛素抵抗因子,导致机体对胰岛素利用能力减弱,从而产生胰岛素抵抗。分别喂食ob/ob小鼠乳清蛋白水解物与乳清蛋白8 周,观察到喂食乳清蛋白水解物组小鼠血糖清除率升高,并恢复胰岛素分泌的能力,周围靶组织能够更有效地利用胰岛素,使胰岛素抵抗减少,高胰岛素血症得到缓解[22]。而Morato等[33]灌胃Wistar大鼠质量分数30%葡萄糖及乳清蛋白水解物,并进行葡萄糖转运蛋白(glucose transporter type 4,GLUT4)的Western blot分析,发现乳清蛋白水解物中L-异亮氨酸、L-亮氨酸-L-异亮氨酸可通过调节葡萄糖转运体GLUT4表达,增加骨骼肌、脂肪组织对葡萄糖的获取,从而改善胰岛素抵抗。GLUT4是一种膜蛋白,仅存在于胰岛素敏感的骨骼肌、心肌和脂肪细胞中,胰岛素含量高时GLUT4转位至膜外与葡萄糖结合,且对体外胰岛素水平反应敏感,产生胰岛素抵抗时这种转运机制受阻,血糖浓度升高[34]。但相关的人体实验较少,Turner等[35]研究食用乳制品与胰岛素敏感性关系,使受试者每日摄入牛乳或相同蛋白含量的红肉,评估增加乳制品或乳制品补充剂对糖代谢与胰岛素敏感性的影响。结果表明,在8 周内两组受试者胰岛素抵抗均无明显变化,在12~24 周之间食用高剂量乳制品组胰岛素抵抗得到改善,而6 个月的干预对于胰岛素抵抗无显著影响。推测未经酶解的乳清蛋白可能不具有改善胰岛素抵抗的功效,其对于改善人体胰岛素抵抗的效果有待于实验进一步验证。
3.2 抑制α-葡萄糖苷酶活性
Lacroix等[3]研究表明,实验中β-乳球蛋白、α-乳白蛋白水解物和α-乳清蛋白表现了一定的α-葡萄糖苷酶抑制作用。抑制α-葡萄糖苷酶是一种常见的治疗糖尿病的手段,通过抑制该酶的活性能够延缓小肠对碳水化合物的吸收,降低淀粉酶解为葡萄糖的速率,从而减缓血糖升高,达到降血糖的效果。在目前的研究中,乳清分离蛋白及其中的α-乳白蛋白、β-乳球蛋白、血清白蛋白、乳铁蛋白经消化道消化的水解物,均为天然来源的α-葡萄糖苷酶抑制剂[36]。
3.3 增加肠促胰素含量
20世纪80年代,研究人员发现通过不同方式口服或静脉注射葡萄糖,当达到相同血糖水平时,口服葡萄糖较静脉注射方式可促进更多胰岛素分泌,由此也证实了小肠分泌的物质具有促进胰岛素分泌的功能,此物质后被定义为肠促胰素,属于葡萄糖依赖型促胰岛素分泌剂,即不会引起低血糖的症状;但其在血液中易被DPP-IV水解,在体内的半衰期仅为2 min,若可增加肠促胰素的含量或抑制DPP-IV的活性,则可促进胰岛素的分泌,进而调节血糖水平[37]。乳清蛋白通过胃肠道消化过程中产生的生物活性肽和氨基酸可刺激CCK、肠抑素胃抑制肽和GLP-1等胃肠激素的释放,从而促进细胞的胰岛素分泌,调节食物摄取。乳清蛋白源生物活性肽也可作为近端肠内DPP-IV的内源性抑制剂,减少肠促胰素降解[18]。
通过检测C肽来反映胰岛素应答,证实了肠促胰素效应的存在;肠促胰素包括GLP-1、GIP两种,其作用于胰岛β细胞,增强葡萄糖依赖的胰岛素分泌,可减少肝糖原的输出,增加饱腹感,能起到一定的减肥作用[18]。在体内GLP-1易被DPP-IV降解灭活,半衰期约为2 min[38]。DPP-IV底物为内源性肠促胰素,肠促胰素减少会导致β细胞敏感性降低、功能衰退。DPP-IV抑制剂是一种新型调节血糖药物,属于促胰岛素合成与分泌类降血糖药物,通过抑制DPP-IV对GLP-1的水解,增强GLP-1的活性,从而促进胰岛素的合成与分泌,达到调节血糖的作用[20,39-40]。DPP-IV抑制肽氨基酸序列对其活性影响显著,具有抑制活性的肽段通常包含支链氨基酸,N端或P1位的脯氨酸残基侧链带有极性基团的芳香族残基,C端的氨基酸也有一定影响,通过运用动态分析法及分子对接模型,发现不同的肽段对酶的抑制行为不同,包括竞争、非竞争及混合行为,早期的研究表明具有Xaa-Pro、Pro-Xaa、或Xaa-Ala结构(Xaa表示所有氨基酸)的二肽对酶的抑制行为通常为竞争性[7]。
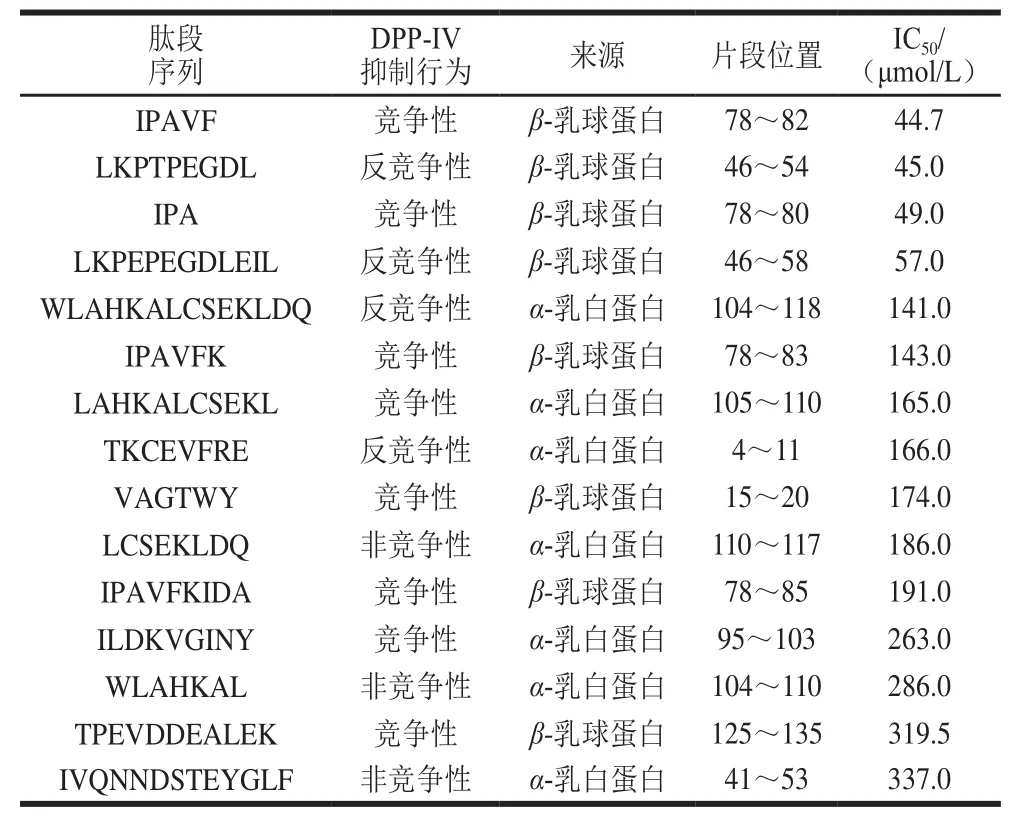
表 2 乳清蛋白水解物中DPP-IV抑制活性肽[7,43,45]Table 2 DPP-IV inhibitory peptides from whey protein hydrolysates[7,43,45]
Gillespie等[41]利用胰岛内分泌(enteroendocrine,EE)细胞模型,研究了乳清、乳清蛋白、α-乳白蛋白、β-乳球蛋白及其水解物对EE细胞模型及对GLP-1、GIP分泌的影响,结果表明,乳清蛋白中的β-乳球蛋白可刺激EE细胞增殖和GLP-1的分泌,促进胰岛素的合成和胰岛素在β细胞中的储存,还可促进前体细胞向β细胞分化,导致β细胞增殖,减少胰岛细胞凋亡,保护β细胞免于功能障碍/破坏。16 名成年健康男子摄入乳清蛋白水解物,发现其促进了胰岛素分泌,且机理与胃排空无关[42]。GLP-1的分泌活性在被蛋白水解酶水解后丧失或显著降低,α-乳白蛋白是一种强效GLP-1促分泌剂,能够增加细胞内GLP-1水平,实验结果显示乳清蛋白及其水解物对GIP分泌影响不大[9,41]。Silveira等[43]用富含β-乳球蛋白的浓缩乳清蛋白经胰蛋白酶水解、分离、纯化,鉴定出DPP-IV抑制肽和IPAVF,测定其半数抑制浓度(half maximal inhibitory concentration,IC50)为44.7 μmol/L。Tulipano等[44]分离得到最佳降糖肽的序列为Ile-Pro-Ala,利用固相合成得到的该肽段进行实验,发现其在一定程度上可以抑制DPP的活性。众多研究表明乳是DPP-IV抑制肽很好的天然来源[7],其中的α-乳清蛋白及β-乳球蛋白是最主要的DPP-IV抑制肽来源,其水解物中分离纯化出多种DPP-IV抑制活性肽(表2)[7,43,45]。乳清蛋白源的肽可作为功能性食品成分用于调节血糖水平,但目前对于肠促胰素的释放、膜的去极化、钙敏感受体[46]、G蛋白偶联受体的激活刺激cAMP的产生[47]等机制研究尚不深入,活性肽结构与功能特性之间的关系还缺乏相应的研究,其在体内递送途径、生物利用率仍不明确。DPP-IV不仅能发挥蛋白酶的作用,还具有活化、增殖T细胞的功能,且底物除了肠促激素外还有一些神经肽、生长因子,而目前在体内未发现DPP-IV的抑制剂,但相关人体实验较少,尚未发现有相应副作用。常见的DPP-IV抑制剂或GLP-1促进剂的代谢器官为肝脏或肾脏,而乳清蛋白酶解物对于人体器官的损伤作用及可能引起的副作用需要进一步研究确认[48]。
3.4 其他影响
肥胖,尤其是内脏性肥胖是2型糖尿病、高血压和血脂紊乱等代谢异常疾病较严重的危险因子。内脏脂肪比周围脂肪细胞对胰岛素代谢作用更抵抗,且对脂激素更敏感;内脏肥胖使游离脂肪酸释放进入门静脉的含量增加,从而增加甘油三酯浓度,损害了胰岛素的首过代谢效应;DPP-IV抑制剂类药物较磺脲类、GLP-1促进剂类药物可以改善血糖调节,并有希望治疗肥胖症[18]。肥胖受试者摄入乳清蛋白水解物可减少其对能量的摄入,但能量摄入量仍高于正常受试者,两者的能量摄入依赖于蛋白至小肠的运输率,且与GLP-1、胰岛素、胰高血糖素等激素的浓度呈负相关[49];另一方面,在人体实验中已证实消化、吸收、代谢乳清蛋白所消耗的能量高于碳水化合物或脂肪,餐后产热较碳水化合物或脂肪更多,且乳清蛋白较酪蛋白或大豆蛋白组成的蛋白质会产生更大的热原反应[50]。
乳清蛋白及其生物活性肽对能量摄入的调节与调节血糖水平存在一定联系。Hutchison等[49]分别选取了12 位无糖尿病的正常身材男性和肥胖男性,并分别对其十二指肠输注乳清蛋白水解物,研究其CCK、GLP-1、GIP等激素分泌情况。结果表明,肥胖受试者血清中CCK、GLP-1、GIP、胰岛素、胰高血糖素水平与十二指肠中乳清蛋白水解物剂量呈正相关,而能量的摄入水平与上述激素分泌情况呈负相关。在摄入乳清蛋白的年轻受试者中,性别与能量摄入之间具有相关性,年轻女性的能量摄入低于年轻男性,可能由于蛋白质在年轻女性中的饱腹感低于年轻男性[51-52],但老年人的性别差异对能量摄入影响不明显[53]。
4 结 语
乳清蛋白及其生物活性肽具有调节血糖、消除氧自由基、提高谷胱甘肽抗氧化水平等作用,且已有学者提出水解乳清蛋白可能成为新型糖尿病治疗药物。对于糖尿病小鼠,饮食补充乳清蛋白可增强创伤愈合过程中正常的炎症反应,有助于恢复氧化应激和炎性细胞因子水平,减少糖尿病并发症的发生;对于饮用乳清蛋白强化发酵乳品人群,其可以提高抗肥胖作用,抑制脂肪合成、减少氧化应激[54]。此外,乳清蛋白调节血糖的效果一般不如乳清蛋白源生物活性肽,但后者的制备成本较高,急需寻找一种高效、快捷、适合工业化生产的制备方法。对于乳清蛋白及其生物活性肽中必需氨基酸的研究已较为深入,目前对乳清蛋白中非蛋白氨基酸组成含量及其构效关系的研究较少,非蛋白氨基酸在生物体的新陈代谢、生殖发育、信息传递等生理过程中发挥着重要作用,且具有抗酶解的能力,未来可结合同位素相对标记与绝对定量技术等检测手段,研究乳清蛋白及其酶解物中非蛋白氨基酸的组成、含量及其对调节机体血糖的影响。
由于调节血糖的机理较为复杂,目前对于乳清蛋白的研究集中于改善胰岛素抵抗、抑制α-葡萄糖苷酶活性、增加肠促胰素含量等方面,对乳清蛋白及其生物活性肽调节血糖的机理尚未探寻清楚,对于其代谢组学、通路研究等机理研究较少。随着研究的深入,乳清蛋白生物学功能及其机理必会得到进一步明确。目前研究对象的选择较全面,覆盖孕期妇女、老年患病者等特殊人群,但多数实验周期较短,结果缺乏中长期实验验证。
通过对乳清蛋白及其调节血糖生物活性肽的降糖功效的综述,有望为辅助治疗2型糖尿病、提升乳清蛋白的生物利用率、提供乳源调节血糖功能产品的研发等方面提供新的思路。
