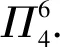分子或离子中大π键(离域π键)的确定
2020-02-29李朝旭
李朝旭
近年来,有关分子或离子中大π键的判断屡次出现在全国高考化学试题和各地模拟考试化学试题中,那么到底如何确定分子或离子中大π键呢?
1 形成大π键的条件
1)形成大π键的原子必须在同一平面上.即中心原子采用sp杂化(直线形分子)或sp2杂化(平面三角形或V形分子).
2)这些原子要有互相平行的p轨道.
3)p轨道上的电子总数小于p轨道总数的2倍.
2 确定π电子数常用方法
1)确定分子中各原子价电子总数.
若为阳离子,应减去所带电荷数;若为阴离子,应加上所带电荷数.
2)画出分子中的σ键以及端位原子(与中心原子相结合的原子)上与中心原子杂化轨道处于同一直线或同一平面上的孤电子对.
可以假设端位原子也采用了与中心原子相同的杂化方式,其中1个杂化轨道用于与中心原子的杂化轨道形成σ键,其余杂化轨道则用于容纳孤电子对.
3)价电子总数减去σ键电子总数和孤电子对中的电子总数,差值即为π电子数.
最后,对相关工艺文件进行标准化及要求现场操作者按工艺进行操作,检验时增加MT磁粉检测。经改善后,小吨位铸造引导轮的感应淬火裂纹发生率大幅降到0.15%以下,改善效果明显有效。
即:π电子数=价电子总数-(σ键电子对数+孤电子对数)×2;若π电子数大于原子总数的2倍,则应平均分成2套大π键.
3 实例
1)直线形分子.
例如,CO2分子的价电子总数为16e-,中心原子C原子采用sp杂化,假设端位的氧原子也采用sp杂化,每个氧原子各出1个sp杂化轨道与C原子的sp杂化轨道形成2个σ键,氧原子的另外1个sp杂化轨道则容纳了1对孤电子对,如图1所示.
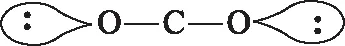
图1
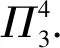
2)V形分子.
例如,SO2分子的价电子总数为18e-,中心原子S采用sp2杂化,假设端位的氧原子也采用sp2杂化,每个氧原子各出1个sp2杂化轨道与S原子的2个sp2杂化轨道形成2个σ键,S原子的另1个sp2杂化轨道则容纳了1对孤电子对,氧原子的另外2个sp2杂化轨道也各自则容纳了1对孤电子对,如图2所示.

图2
3)平面三角形分子.
例如,SO3分子的价电子总数为24e-,中心原子S采用sp2杂化,假设端位的氧原子也采用sp2杂化,每个氧原子各出1个sp2杂化轨道与S原子的3个sp2杂化轨道形成3个σ键,氧原子的另外2个sp2杂化轨道则各自容纳了1对孤电子对,如图3所示.

图3
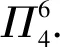
4 练习


图4


图5
2) (2017年全国卷Ⅲ,节选) 硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在________.
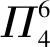
3) (2018年全国卷Ⅱ,节选) 气态三氧化硫以单分子形式存在,其分子的立体构型为________形,其中共价键的类型有________种.
答案平面三角; 2(σ键和大π键).
4) 尿素分子的结构简式为CO(NH2)2,该分子中σ键数目为________,实验测得:分子中的所有原子在同一平面内,尿素中的碳氧键(125pm)比典型的碳氧双键(121pm)长,而尿素中的碳氮键(137pm)比典型的碳氮单键(147pm)短,说明分子中存在________.

图6