IL-34诱导肺成纤维细胞IL-6、IL-8表达机制研究
2020-02-29吴夏楠赖晓霏
吴夏楠 罗 艳 邹 鳞 赖晓霏
(重庆医科大学附属第一医院医学检验科,重庆 400016)
IL-34是集落刺激因子1受体(colony stimulating factor 1 receptor,CSF-1R)的新配体,在心脏、肝脏、大脑、肾脏及胸腺多个组织均有表达[1]。尽管IL-34与集落刺激因子1(colony stimulating factor 1,CSF-1)具有相同的受体及相似的功能,但在原始序列中几乎没有同源性[2]。有报道认为,IL-34与CSF-1R结合的亲和力高于CSF-1,可诱导CSF-1R及其下游分子发生更强的酪氨酸磷酸化[3];而与其他两个受体PTP-ζ及syndecan-1亲和力较低[4,5]。
越来越多临床研究表明,IL-34与多种炎症性疾病相关。例如,过敏性紫癜患者急性期血清中IL-34显著上调[6];类风湿关节炎患者滑膜液、成纤维滑膜细胞和血清中IL-34表达升高,进一步的研究确认,IL-34可作为预测TNF-α拮抗剂治疗效应的潜在标志物[7]。IL-34在炎症黏膜上皮层和结缔组织浸润的免疫细胞中表达显著增加[8]。IL-34也可作为慢性乙型肝炎病毒感染患者肝纤维化的一种炎症生物标志物[9]。
IL-34作为一种新的促炎性细胞因子,影响着免疫和炎症反应的多个方面。IL-34的产生还与神经元保护、感染、自身免疫疾病和血管生成有关[10]。IL-34在肺癌和肺部感染中表达上调,提示IL-34在肺免疫中发挥重要作用。然而,IL-34是否通过分泌炎症介质直接作用于肺组织细胞来启动、放大和维持炎症反应机制尚不清楚。本研究的主要目的是确定IL-34对人肺成纤维细胞的影响,并揭示其调节肺免疫应答的潜在机制。
1 材料与方法
1.1材料
1.1.1细胞 原代人肺成纤维细胞(human lung fibroblasts,HLF)购自美国ScienCell Research,细胞专用培养基购自美国Gibco Invitrogen。原代人成纤维细胞样滑膜细胞(fibroblast-like synoviocytes,FLS) 购自Cell Applications (San Diego,CA),用含10%滑膜细胞生长因子(Cell Applications)的培养基于37℃、5%CO2恒温培养箱中培养。
1.1.2试剂 重组IL-34蛋白购自美国R&D公司,重组IL-4、IL-17A、TNF-α购自美国Peprotech公司;小分子抑制剂 JAK(AG490)、IкB-α(BAY11-7082)、PI3K(LY294002)、ERK(U0126)、MAPK(SB203580)、JNK(SP600125)购自美国Calbiochem,JAK、NF-κB、IкB-α、PI3K、ERK、MAPK、JNK总蛋白抗体及磷酸化蛋白抗体均购自美国Cell Signaling Technology(CST);抗CSF-1R抗体(AFS98)购自美国GeneTex。
1.2方法
1.2.1实时荧光定量PCR(RT-qPCR)法检测细胞IL-34、IL-6及IL-8 mRNA表达水平 细胞总RNA提取使用RNeasy columns试剂盒(Qiagen)进行,所有RNA样品在进一步处理前均采用DNase I (Invitrogen)处理。RNA样品逆转录为cDNA应用TaqMan反转录试剂盒(Biosystems)进行,GAPDH作为内参对照,检测数据采用标准曲线和比较Ct值法(2-ΔΔCT法)进行相对定量分析。
1.2.2ELISA、蛋白印迹法 (Western blot) 检测蛋白表达水平 细胞培养上清液IL-6及IL-8表达采用美国Millipore公司ELISA试剂盒检测,所有操作按试剂说明书进行。细胞接种于10 cm培养皿中(5×106个/培养皿,用IL-34(50 ng/ml)处理细胞0、10、30、60 min 后,提取细胞总蛋白,BCA 法检测蛋白浓度;等量蛋白质上样、电泳、转膜及封闭,一抗(1∶1 000)4℃ 孵育过夜;适当稀释的二抗室温孵育2 h,滴加ECL显色液,凝胶成像仪观察结果。以β-actin为内参,目的蛋白灰度值/β-actin灰度值为目的蛋白的相对表达量。

表1 RT-qPCR引物序列Tab.1 Sequence of RT-qPCR primer

2 结果
2.1人肺成纤维细胞中IL-34受体CSF-1R的表达 为研究IL-34是否能直接作用于肺组织细胞,我们检测了原代人肺成纤维细胞中CSF-1R的表达,成纤维样滑膜细胞作为阳性对照。结果显示,CSF-1R在这两种细胞中均有表达。当我们用抗CSF-1R抗体(10 μg/ml)处理肺成纤维细胞24 h时(图1B),与未处理组细胞(图1A)相比,CSF-1R表达显著降低(P<0.05)。因此,进一步证实肺成纤维细胞表达IL-34受体CSF-1R。

图1 CSF-1R在人成纤维样滑膜细胞(FLS)和肺成纤维细胞(HLF)中mRNA的表达情况Fig.1 Expression of CSF-1R mRNA levels in human fibroblast-like synoviocytes(FLS) and lung fibroblasts (HLF)
2.2IL-34刺激人肺成纤维细胞产生IL-6、IL-8 mRNA表达 为了研究IL-34对肺成纤维细胞的影响,重组IL-34在不同时间点以相应剂量作用于细胞。结果显示,IL-8 mRNA水平在6 h时增加了近3倍,IL-6 mRNA在24 h时增加了46倍 (图2A、B)。此外,IL-6和IL-8蛋白表达水平呈剂量和时间依赖性增加(图2C、D);重组IL-34刺激之前,用抗CSF-1R抗由于肺内多种免疫细胞都可以分泌细胞因子和趋化因子,本研究评估了IL-34诱导IL-6和IL-8 表达是否为其他细胞因子共同刺激的结果。采用重组TNF-α (50 ng/ml)、IL-4 (100 ng/ml)和IL-17A (100 ng/ml) 蛋白单独作用或与IL-34(50 ng/ml)共同作用于肺成纤维细胞,结果显示,IL-34分别与这三种炎性细胞因子联合作用时,IL-8和IL-6蛋白水平表达显著升高(图3A~F)。
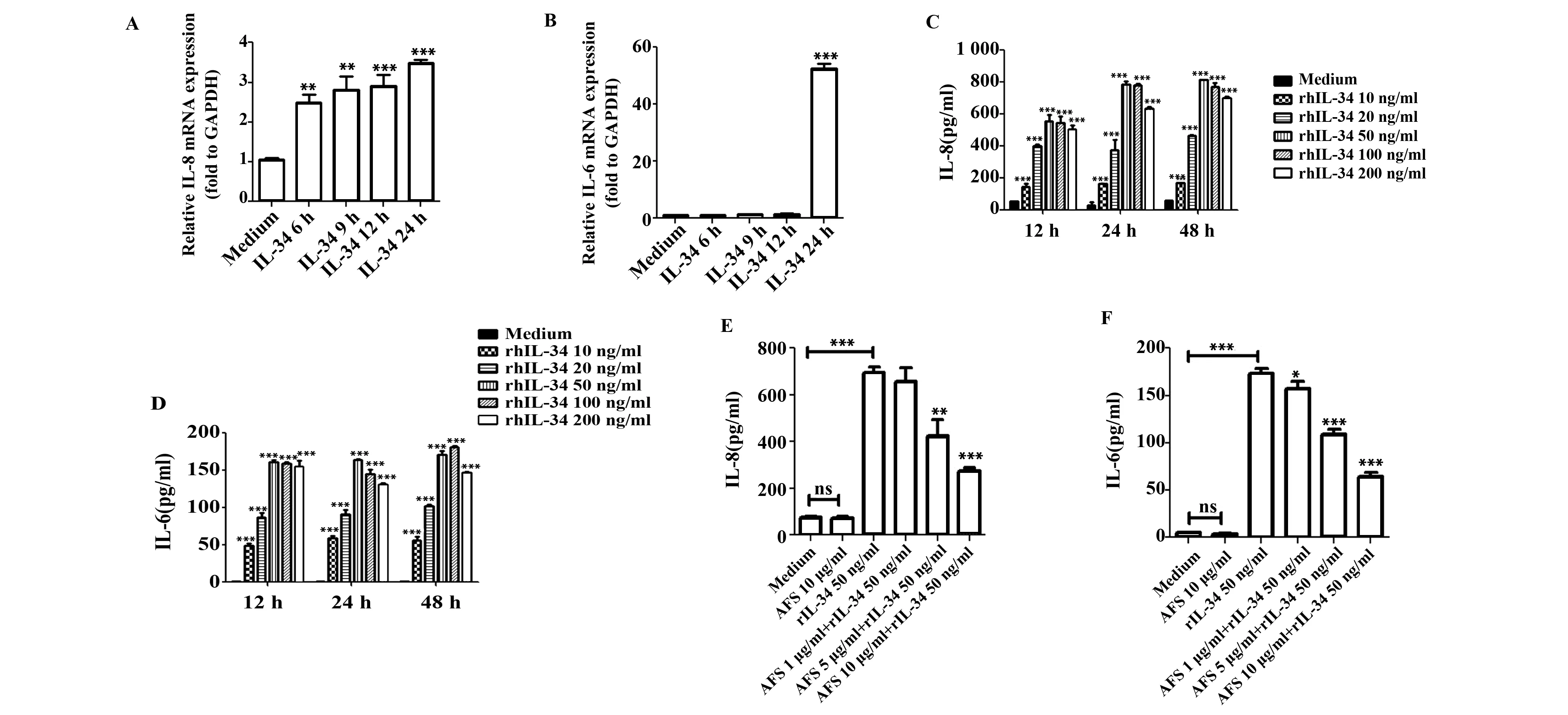
图2 IL-34刺激肺成纤维细胞诱导IL-8和IL-6 mRNA和蛋白的表达Fig.2 mRNA and protein expression of IL-8 and IL-6 in human lung fibroblasts induced by IL-34Note: Compared with Control group,*.P<0.05,**.P<0.01,***.P<0.001.

图3 IL-34单独或联合TNF-α、IL-4、IL-17A 作用肺成纤维细胞后IL-8 和IL-6 的蛋白表达情况Fig.3 Protein expression of IL-8 and IL-6 in human lung fibroblasts treated with IL-34,TNF-α,IL-4,IL-17A either alone,or in combinationNote: Compared between groups,*.P<0.05,**.P<0.01,***.P<0.001.
体(AFS,10 μg/ml)处理细胞24 h,IL-6和IL-8 mRNA表达显著减弱(P<0.001,见图2E、F)。
2.3信号分子抑制剂可逆转IL-34诱导人肺成纤维细胞IL-6和IL-8表达升高 MAPK、NF-κB、PI3K-Akt和JAK是肺成纤维细胞内炎性因子表达的重要信号转导通路。为了阐明这些激酶的功能作用,本研究应用特异性信号通路抑制剂AG490(5 μmol/L),BAY11-7082 (1.2 μmol/L),LY294002 (10 μmol/L),SB203580 (20 μmol/L), SP600125(5 μmol/L),U0126 (10 μmol/L) 预处理肺成纤维细胞1 h,紧接着IL-34(50 ng/ml)刺激24 h后检测上清液细胞因子表达变化。结果显示,p38MAPK、ERK、Akt、NF-κB抑制剂可以逆转IL-34诱导IL-8表达升高(图4A),IL-6表达主要被JAK、NF-κB、Akt、p38MAPK抑制剂阻断(图4 B),其中p38MAPK抑制剂对二者阻断效应最明显。提示p38MAPK通路可能在IL-34诱导IL-6和IL-8的产生中起关键作用。

图4 信号通路抑制剂对IL-34诱导IL-8和IL-6蛋白表达的影响Fig.4 Effects of signaling pathway inhibitors on IL-34-induced IL-8 and IL-6 expressionNote: Compared with IL-34 groups,*.P<0.05,**.P<0.01,***.P<0.001.
2.4IL-34诱导人肺成纤维细胞信号通路磷酸化 为了进一步探索IL-34在人肺成纤维细胞中活化的具体分子途径,外源性重组IL-34 (50 ng/ml)刺激细胞,并检测0、10、30、60 min蛋白的磷酸化。结果显示,IL-34作用细胞后10 min内诱导p38MAPK和JAK通路强磷酸化(P<0.01);Akt、NF-κB信号也在30~60 min诱导较强磷酸化(P<0.001,图5)。结果显示IL-34可能通过MAPK、PI3K-Akt、JAK、NF-κB信号通路诱导肺成纤维细胞产生IL-6和IL-8。
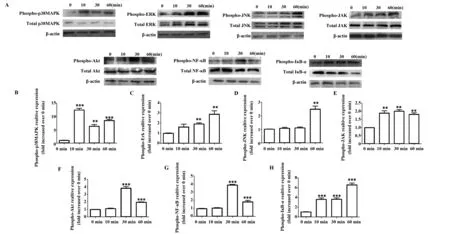
图5 IL-34对肺成纤维细胞 p38 MAPK,ERK,JNK,JAK,Akt,NF-κB细胞信号分子的影响Fig.5 Effects of IL-34 on activation of p38 MAPK,ERK,JNK,JAK,Akt and NF-κB signaling pathwaysNote: Compared with Time(0) groups,**.P<0.01;***.P<0.001.
3 讨论
IL-34参与许多疾病的免疫调节。近年来在自身免疫性疾病、炎症性肠病、感染及神经系统功能障碍中研究较多[9],在癌症中的作用也正在显现:在急性白血病中,IL-34诱导白血病细胞向类似单核细胞的细胞类型分化,为白血病的治疗提供新的思路[11];IL-34和CSF-1均由增强巨噬细胞浸润的乳腺上皮细胞产生,可用于评估复发和转移的风险[12]。在肝细胞癌中,IL-34表达上调诱导肿瘤相关巨噬细胞浸润,在肿瘤生长及转移中发挥着重要作用[13]。
在肺癌脑转移灶中发现了CSF-1、CSF-1R和IL-34的差异表达,提示阻断IL-34信号通路可能是一种新的治疗策略[14,15]。此外,阻断CSF-1R靶向TAM是治疗小鼠肺癌的一种方法[16]。在甲型流感感染中,血清和外周血单核细胞中IL-34水平较高,提示抑制IL-34介导的炎症通路可能是一种预防流感的方法[17]。这些研究共同显示,IL-34参与肺癌和肺部感染免疫调节。然而,IL-34作为一种免疫调节分子在肺免疫反应中的作用机制尚不清楚。
先前的研究已经表明,在成纤维样滑膜细胞中炎性因子TNF-α和IL-1β诱导IL-34的表达[18,19]。TNF-α与TLR配体共同刺激固有层单核细胞,IL-34表达上调[20]。此外,TNF-α增强由脂肪细胞分泌的IL-34表达[21]。然而,当我们采用重组TNF-α、IL-1β或脂多糖作用人肺成纤维细胞和支气管上皮细胞24 h,没有检测到细胞培养上清液中IL-34的表达。当然,还需要更多研究来证实IL-34在肺中的来源。IL-34在中枢神经系统和皮肤中具有稳定的选择性表达,在自身免疫性疾病、感染性疾病、炎症和癌症等病理状态下被诱导产生,因此,IL-34在病理条件下可通过循环在肺部表达[22]。
之前的研究强调人肺成纤维细胞和支气管上皮细胞在肺部感染和免疫中发挥重要作用[23,24]。IL-6是一种典型的促炎细胞因子,在炎症中起关键作用;IL-8是一种中性粒细胞趋化剂,参与白细胞浸润[25]。在本研究中,我们检测了CSF-1R及炎性因子IL-6、IL-8在人肺成纤维细胞中的表达情况。结果显示,IL-34作用细胞后IL-6和IL-8转录和蛋白表达水平显著升高;阻断CSF-1R引起IL-6和IL-8表达减弱,提示IL-34/CSF-1R通路可能参与IL-34对肺部炎症反应的免疫调控。
TNF-α、IL-4和IL-17A在气道炎症中扮演着重要角色,如哮喘、慢性阻塞性肺病中Th1细胞因子TNF-α表达上调[26,27];Th2细胞因子IL-4促进B细胞IgE的产生,在哮喘发生中起关键作用[28]。除此之外,IL-4在COPD小鼠模型中也有上调[29]。
Th17细胞因子IL-17A在哮喘患者中升高,诱导中性粒细胞募集,与严重气道炎症相关[30]。本研究发现,IL-34联合TNF-α、IL-4和IL-17A共同刺激可显著增强肺成纤维细胞中IL-6和IL-8的表达,这可能促进严重肺部炎症和疾病的发生发展。在原代人支气管上皮细胞中,TNF-α活化Akt、p38 MAPK、IkB-α通路磷酸化诱导IL-6、ICAM1表达[31];TNF-α和IL-4促进IL-8的释放[32];IL-17激活ERK信号通路诱导IL-6、IL-8表达[33]。这些数据表明,IL-34与IL-4、TNF-α、IL-17A诱导IL-6、IL-8表达可能激活共同的信号通路。
本研究结果提示,IL-34通过激活MAPK、PI3K-Akt、JAK、NF-κB信号通路诱导IL-6、IL-8表达,而且这些通路与受体磷酸化相关。另外,尽管IL-34与其他受体(PTP-ζ和syndecan-1)亲和力较低,但是PTP-ζ可以增强IL-34的生物效应[4],syndecan-1是IL-34 /M-CSFR一个关键的调节点[5]。因此,在未来的研究中,我们将深入研究人肺成纤维细胞PTP-ζ和syndecan-1是否参与IL-34介导IL-6、IL-8表达。总之, IL-34通过激活人肺成纤维细胞MAPK、PI3K-Akt、JAK、NF-κB信号通路诱导IL-6、IL-8表达,阐明了IL-34在肺成纤维细胞中的炎症作用,提示IL-34/CSF-1R通路可能是未来肺部疾病治疗策略的潜在靶点。
