RT-PCR结合高分辨率熔解曲线对两种致病菌的快速检测
2020-02-29姚艳玲
姚艳玲
(嘉兴市食品药品检验检测院,浙江嘉兴314050)
近年来,生食海产品、果蔬沙拉、水果饮料等现制现售即食类食品因其鲜嫩的口感、丰富的营养在餐桌上频频出现,且备受欢迎。但由于其未经熟制加工,存在致病菌污染风险。而金黄色葡萄球菌、单核增生李斯特氏菌是肉类、奶类、果蔬等食品中常见的污染致病菌,易感人群尤其容易感染[1-2]。其中金黄色葡萄球菌产生的肠毒素能引起食物中毒[3],据报道,每100 g食物中含有不足18 μg 的肠毒素便能引起金黄色葡萄球菌食物中毒症状[4];而单核增生李斯特氏菌广泛存在于土壤、人和动物的粪便中,容易污染食品,引起食物中毒的致病因子为李氏溶血素和内化素[5]。有报道显示,金黄色葡萄球菌、单核增生李斯特氏菌等致病菌在奶类、肉类、鲜切蔬菜等产品中均有不同程度的检出[6-10]。而现制现售类食品由于涉及原料种类繁多,制作过程、销售形式和食用方式具有多样性,因此对微生物的控制则显得更加重要。传统的微生物检测方法大都需要经过增菌、分离、纯化和鉴定等步骤,过程繁琐,耗时较长,对现制现售类食品的微生物情况不能作出迅速反应。因此,开展致病菌快速检测方法的研究,是食品安全检测的一个重要方向。
目前,针对金黄色葡萄球菌、单核增生李斯特氏菌的检测方法多集中于聚合酶链式反应方法(polymerase chain reaction,PCR)[11-13]和实时荧光 PCR(realtime polymerase chain reaction,RT-PCR)的检测方法[14-16],而利用PCR 技术结合高分辨率熔解曲线(high-resolution melting curve,HRM)的多重检测报道则较少。因此,本试验以现制现售的果蔬饮料为样本,采用实时荧光PCR 结合高分辨率熔解曲线分析方法,建立快速检测食品中金黄色葡萄球菌、单核增生李斯特氏菌的多重方法体系。
1 材料与方法
1.1 材料
1.1.1 菌株
试验采用的菌株均采购自美国菌种保藏中心(american type conservation center,ATCC),如表 1 所示。

表1 菌株名称及编号Table 1 Name and number of the bacteria
1.1.2 主要试剂
缓冲蛋白胨水(buffered peptone water,BPW):北京陆桥技术股份有限公司;LightCycler 480 高分辨率熔解分析预混液:罗氏诊断产品(上海)有限公司。
1.1.3 引物
查阅标准,参考SN/T 1689-2007《食品中多种致病菌快速检测方法PCR 法》标准中列出的引物序列,见表2,所有引物由生工生物工程(上海)股份有限公司合成。
1.1.4 主要仪器
LightCycler 480-Ⅱ荧光定量PCR 仪:罗氏诊断产品(上海)有限公司;MK-10 干式恒温器:杭州奥盛仪器有限公司;Legend Micro 21R 冷冻离心机:赛默飞世尔科技(中国)有限公司;XK96-A 快速混匀器:江苏新康医疗器械有限公司;NanoDrop OneC超微量分光光度计:赛默飞世尔科技公司;SPX-400-Ⅱ生化培养箱:上海跃进医疗器械有限公司。

表2 两种致病菌的引物序列Table 2 Primers of 2 pathogenic bacteria
1.2 试验方法
1.2.1 样本制作及DNA 模板提取
将目标菌人工接种于果蔬汁样本中,作为原始试验样本,并进行梯度稀释。36 ℃培养24 h,培养过程中每隔一定时间进行平板计数。培养完成后,吸取1 mL 样液到1.5 mL 灭菌离心管中,12 000 r/min 离心5 min,弃上清液;随后加入50 μL 灭菌蒸馏水,并用快速混匀器混匀,放入100 ℃干式恒温器中裂解10 min,12 000 r/min离心10 min,吸取上清液于另一灭菌离心管中,该溶液即为DNA 提取液,同时测定DNA 模板浓度及纯度。吸取上清液时注意不要吸到底部沉淀物。
1.2.2 RT-PCR 体系的建立
根据LightCycler 480 High Resolution Melting Mas ter 试剂盒说明书,配置 20 μL 的 PCR 反应体系,其中包含 10 μL Master Mix(2×conc.),1μL 上游引物(4 μmol/L),1μL 下游引物 (4 μmol/L),2 μL MgCl2(25 mmol/L),5 μL DNA(样品以目标菌 DNA 为模板,对照以无菌去离子水为模板)。
反应程序为:95 ℃预变性10 min;以95 ℃变性10 s,58 ℃退火 15 s,72 ℃延生 15 s,扩增 40 个循环。PCR 产物随后进行高分辨率熔解曲线分析,熔解程序为:95 ℃ 1min,40 ℃ 1 min,65 ℃ 1 s;然后升温至 95 ℃(此时熔解速率为0.01 ℃/s),最后40 ℃冷却。
1.2.3 RT-PCR 反应特异性
在RT-PCR 反应体系建立的基础上,混合表1 所示的5 种常见致病菌的DNA 模板,分别对金黄色葡萄球菌、单核增生李斯特氏菌进行了特异性试验。
2 结果与讨论
2.1 样本的培养及DNA模板测定
人工接种两种目标菌的样本在BPW 培养液中培养,按 10 倍梯度稀释成 10-1、10-2、10-3、10-4、10-5、10-6、10-7、10-8的培养液,分别在 0、3、6 、24 h 进行平板计数,选取原始试验样本在0 h 时平板计数结果数量级为102的样本进行统计,此时的金黄色葡萄球菌稀释梯度为10-5,单核增生李斯特氏菌的稀释梯度为10-6,结果见表3。

表3 样本中两种致病菌的平板计数Table 3 The content of 2 pathogenic bacteria in samples
由表3 可知,金黄色葡萄球菌、单核增生李斯特氏菌在BPW 培养液中均能有效繁殖,且呈现相似的生长速率,因此试验采用的BPW 培养液能应用于实际样品。试验按1.2.1 方法对制作的原始样本液进行DNA 提取,并测定其浓度及纯度。检测结果显示,含金黄色葡萄球菌样本的DNA 浓度为12.3 μg/mL,纯度范围为1.67~1.86,含单核增生李斯特氏菌的DNA 浓度为 19.7 μg/mL,纯度范围为 1.75~1.82,均能满足 PCR试验要求。
2.2 RT-PCR方法的建立
在RT-PCR 反应时,由于引物长度不同、碱基不同,因此退火温度对两种菌的检测影响较大。针对以上两种目标菌的退火温度,在55 ℃~60 ℃范围内进行预试验。结果表明,在55 ℃~59 ℃金黄色葡萄球菌能有效扩增,58 ℃~59 ℃时单核增生李斯特氏菌能有效扩增,且非特异性扩增均不明显。虽然单重试验时,退火温度在58 ℃和59 ℃时两种菌均能扩增,但结合熔解曲线分析,发现58 ℃时扩增效果更好,因此建立方法时选取58 ℃作为退火温度,DNA 浓度稀释10 倍时的结果见图1、图2。

图1 DNA 浓度稀释10 倍时金黄色葡萄球菌熔解曲线峰Fig.1 The HRM peak of Staphylococcus aureus at the DNA concentration of 10-1

图2 DNA 浓度稀释10 倍时单核增生李斯特氏菌熔解曲线峰Fig.2 The HRM peak of Listeria monocytogenes at the DNA concentration of 10-1
把2.1 制备的两种目标菌的DNA 溶液进行梯度稀释,分别稀释至原来浓度的 10-1、10-2、10-3、10-4、10-5,按建立的方法进行扩增,并计算两种目标菌的平均Tm 值,结果显示金黄色葡萄球菌的Tm 值为77.05 ℃,最大偏差为0.51 ℃;单核增生李斯特氏菌的Tm 值为79.39 ℃,最大偏差为 0.46 ℃。由图1、图 2 可见,两种目标菌的熔解曲线峰型均较好,且无非特异性熔解峰,因此退火温度选取58 ℃时,该方法针对两种致病菌能进行有效地定性分析。
2.3 双重RT-PCR试验
试验在做双重反应时,将两种目标菌的原始DNA提取液经适度稀释后,按等比例混合,制成混合模板,然后将混合模板按10 倍比例梯度稀释。PCR 反应体系中同时加入两种目标菌的引物及DNA 混合模板,按1.2.2 配制反应体系,不足20 μL 用无菌去离子水补足。然后按2.2 方法条件进行双重试验,PCR 扩增曲线结果见图3。
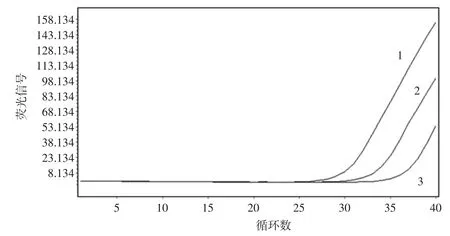
图3 双重试验的扩增曲线Fig.3 The RT-PCR curve of duplex reaction
在双重试验中,也比较了58 ℃和59 ℃两种退火温度。结果发现,退火温度为59 ℃时,单核增生李斯特氏菌扩增较好,且熔解曲线峰明显,但金黄色葡萄球菌扩增效果不理想,熔解曲线峰型较小,与单核增生李斯特氏菌区分不明显,存在交叉区域;而当退火温度设置为58 ℃时,两者均得到有效扩增,且熔解曲线峰能彻底分开。
双重试验的高分辨率熔解曲线图见图4、图5。

图4 双重试验的高分辨率熔解曲线图Fig.4 The HRM of duplex reaction
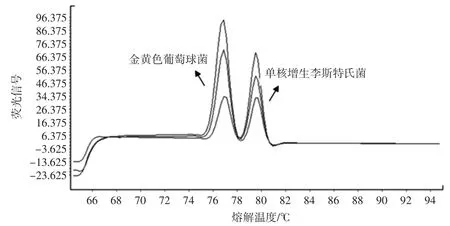
图5 双重试验的熔解曲线峰Fig.5 The HRM peaks of duplex reaction
由此推测,在双重试验时两种目标菌的扩增存在竞争,不同退火温度下竞争效果不同,试验结果显示,退火温度设置为58 ℃时,混合体系能实现最优扩增。
由图3~图5 可知,退火温度设置为58 ℃时双重试验效果较为理想,金黄色葡萄球菌的Tm 值范围为76.72 ℃~76.90 ℃,单核增生李斯特氏菌的Tm 值范围为 79.54 ℃~79.85 ℃,与 2.1 结果相符,均在偏差范围内。因此,试验建立的双重试验方法,扩增时退火温度选择58 ℃,能同时对两种目标菌进行定性分析。此时,金黄色葡萄球菌、单核增生李斯特氏菌的检测灵敏度分别达到 2.29×10-3、2.08×10-2μg/mL;按平板计数结果计算,金黄色葡萄球菌检测灵敏度达到102CFU/g,单核增生李斯特氏菌的检测灵敏度达到103CFU/g。
试验中还发现,在双重反应中利用高分辨率熔解曲线进行分析时,采用高饱和染料比SYBR GREEN 效果好,荧光信号采集更为灵敏;另外,熔解速率对试验影响也较大,温度分辨率越高越好,本试验在设定熔解速率为0.01 ℃/s 时,2 种目标菌的熔解曲线峰彻底分开。
2.4 RT-PCR反应体系中引物的特异性
在特异性反应试验时,混合表1 中5 种致病菌的DNA 模板,分别对2 组引物进行特异性试验,结果见图6。

图6 2 种致病菌的高分辨率熔解曲线峰Fig.6 The HRM peaks of 2 pathogenic bacteria
由图6 可知,两种目标菌均能很好地扩增,未受其他菌的干扰,金黄色葡萄球菌和单核增生李斯特氏菌的Tm 值分别为76.67、79.68 ℃,与2.2 试验中偏差范围相符。由此可见,该反应体系中2 种目标菌的引物均具有较好的特异性。
3 结论
本试验建立了RT-PCR 结合高分辨率熔解曲线对金黄色葡萄球菌、单核增生李斯特氏菌的双重检测方法。试验通过对退火温度的比较,确定双重试验的退火温度为58 ℃,这时的检测灵敏度分别可以达到金黄色葡萄球菌102CFU/g,单核增生李斯特氏菌103CFU/g。两种目标菌的Tm 值分别为金黄色葡萄球菌77.05 ℃,单核增生李斯特氏菌79.39 ℃。试验采用直接提取法提取样品中的DNA,其操作简单,提取时间短,DNA 纯度范围均在1.6~1.9 之间,能满足PCR 检测要求。通过双重检测方法体系的建立,针对以上两种致病菌,检验过程简单方便,与常规微生物检测方法比较,大大提高了检测时效性,且该方法的灵敏度、特异性均满足要求,为实现餐饮食品中微生物的快速筛选提供参考。
通过试验发现,反应体系建立时,退火温度至关重要,根据目标菌的特性适当调整退火温度,使得在相同退火温度等PCR 参数条件下实现多重检测的目的。另外,在做高分辨率熔解曲线时,采用高饱和染料在多重试验中有更好的应用,且试验条件中熔解速率较为关键,本试验经比较,最终确定熔解速率为0.01 ℃/s,在该条件下,荧光信号采集较为灵敏,能很好地利用高分辨率熔解曲线进行定性分析。由此可知,在做高分辨率曲线时,高饱和染料、温度分辨率等条件是影响试验结果的主要因素。
