建立实时荧光LAMP法检测肺炎支原体*
2020-02-28吴亮夏雯阴晴戴晓玥邹治情王海波陈盛霞易承学
吴亮,夏雯,阴晴,戴晓玥,邹治情,王海波,陈盛霞,易承学
(1. 江苏大学医学院,江苏镇江 212013;2. 江苏大学附属医院检验科,江苏镇江212000;3. 镇江市第一人民医院儿科,江苏镇江212000;4. 镇江市高等专科学校医药与化材学院,江苏镇江 212028)
肺炎支原体(Mycoplosmapneumonia, Mp)是社区获得性肺炎的重要病原体之一。5~20岁的儿童和青少年是Mp感染的主要人群。虽然Mp感染具有自限性,但早期诊断和早期治疗可以有效缩短病程并减少并发症的发生[1]。支原体肺炎与其他病原体感染的肺炎在临床症状和影像学上并无明显差异,并且Mp对常规治疗肺炎或上呼吸道感染的药物(如青霉素或头孢菌素)天然耐药,因此及时准确的Mp实验室诊断技术对于支原体肺炎治疗具有重要意义[2]。
近年来发展的环介导等温扩增(loop-mediated isothermal amplification, LAMP)技术已经应用于临床各种病原体检测[3]。LAMP技术较经典PCR法或实时荧光PCR法具有快速、高效、特异、灵敏和经济等优点,其检测的灵敏度和特异性高于PCR法[4]。现有报道的Mp-LAMP检测技术在反应完毕后需打开PCR管盖,加入SYBR Green Ⅰ染料或通过琼脂糖电泳判读结果,开盖操作会增加发生气溶胶污染的概率,造成假阳性[5]。通过在LAMP反应体系中添加特殊荧光染料SYTO-9,可以实现在反应过程中实时监测反应产物生成,免去开盖操作,有效避免气溶胶污染[6]。实时荧光LAMP法尚未见应用于Mp检测。本研究建立实时荧光LAMP法检测Mp,现将结果报道如下。
1 材料与方法
1.1材料和仪器
1.1.1样本和质粒 收集2018年2—6月江苏大学附属医院儿科收治的呼吸道感染住院患儿102例(男56例,女46例,年龄2~11岁)。受试患儿均为使用头孢类抗菌药物3 d以上而症状无改善者,采集上述患儿咽拭子并提取基因组DNA用于后续检测。肺炎支原体P1基因载体(Mp-P1/pET28a)由本室在前期研究中构建,质粒保存于DH5α菌中。Mp标准菌株(M129株)和Mp标准株(Cpn AR-39株)基因组DNA由南华大学游晓星教授惠赠。
1.1.2主要试剂和仪器 质粒小量提取试剂盒、蛋白酶K溶液(20 mg/mL)和dNTP(上海捷瑞生物公司),BstDNA聚合酶(哈尔滨新海基因公司),肺炎支原体核酸检测试剂盒(荧光PCR法,上海之江生物科技股份有限公司),PPLo培养基(英国Oxoid公司),荧光染料SYTO-9(Thermo Fisher Scientific公司);实时荧光定量PCR仪(Bio-Rad公司)。
1.1.3LAMP引物 根据Mp标准菌株(M129)P1基因序列,使用Primer Explorer V4软件设计实时荧光LAMP扩增引物,见表1。引物由苏州泓迅生物科技公司合成。

表1 Mp-P1基因实时荧光LAMP引物序列
1.2方法
1.2.1构建P1基因标准品 携带Mp-P1/pET28a质粒的DH5α菌于LB培养基中扩增,采用质粒小量提取试剂盒提取Mp-P1/pET28a质粒,根据公式:质粒拷贝数(/mL)=(6.02×1023)×质粒浓度(g/mL)/(质粒碱基数×660),计算质粒拷贝数,并稀释制备不同浓度质粒标准品(101copies/μL~106copies/μL)用于后续研究。
1.2.2咽拭子基因组DNA提取 Mp基因组DNA提取方法参照冯燕玲等[7]报道,方法如下。在咽拭子中加入2.5 mL生理盐水,洗涤后取400 μL洗涤液,以12 000 r/min离心10 min,弃上清液。在沉淀中加入50 μL TE缓冲液和2 μL蛋白酶K溶液,55 ℃温浴1 h,95 ℃温浴10 min灭活蛋白酶K,以12 000 r/min离心5 min,上清液用于实时荧光PCR和实时荧光LAMP法检测。
1.2.3实时荧光LAMP法检出限 25 μL反应体系中含有:0.04 μmol/L引物F3,0.04 μmol/L引物B3,0.5 μmol/L引物FIP,0.5 μmol/L引物BIP,0.08 μmol/L LoopF引物,0.08 μmol/L LoopB引物,8 UBstDNA聚合酶,0.6 mol/L甜菜碱,0.8 mmol/L dNTP,2.5 μL 10×Thermopol反应缓冲液,5 μmol/L SYTO-9染料,不同拷贝数Mp-P1质粒标准品5 μL,以灭菌双蒸水补足体系至25 μL。LAMP扩增时间设置为60 min,反应温度为63 ℃,间隔1 min读取荧光。
1.2.4SYBR Green Ⅰ 染料LAMP法检出限 按1.2.3操作方法配制LAMP反应液,并进行反应。反应结束后,在反应体系中加1 μL SYBR Green Ⅰ工作液(1∶10 000),置于紫外灯下观察反应结果并拍照记录。
1.2.5实时荧光LAMP法灵敏度 接种Mp标准菌株至PPLO培养基,于37 ℃温箱培养至培养液变成黄色,吸取100 μL培养基,并进行10倍连续梯度稀释。稀释倍数依次为10-1、10-2、10-3、10-4、10-5、10-6、10-7和10-8。提取肺炎支原体基因组DNA,分别采用实时荧光LAMP法和实时定量PCR法检测。
1.2.6实时荧光LAMP法特异性试验 在实时荧光LAMP反应体系中分别加入肺炎链球菌、金黄色葡萄球菌、表皮葡萄球菌、肺炎克雷伯菌、鲍曼不动杆菌、铜绿假单胞菌、大肠埃希菌和肺炎衣原体基因组DNA各5 μL,以灭菌蒸馏水补足体系至25 μL。采用实时荧光LAMP法检测,观察上述病原体基因组DNA的扩增结果。
1.2.7临床应用评价 所收集的临床标本分别采用实时荧光LAMP法和肺炎支原体核酸检测试剂盒(荧光PCR法)检测。荧光PCR法严格按试剂盒说明书操作。
1.3统计学分析 使用Stata 9.0统计学软件,χ2检验法分析临床咽拭子标本中肺炎支原体检出率的差异。以P<0.05为差异有统计学意义。
2 结果
2.12种LAMP方法检出限 使用实时荧光LAMP法扩增含有Mp-P1基因的标准品时,当标准品浓度为104和105copies/μL时,仅需5 min即可产生明显扩增,20 min时即可达到最大扩增拷贝数;当标准品浓度为103copies/μL时,实时荧光LAMP法仍可以获得较好扩增,达到最大扩增拷贝数需要1 h(见图1)。SYBR Green Ⅰ染料LAMP法中,在反应体系中加入SYBR Green Ⅰ染料后,当标准品浓度为104和105copies/μL时,可以获得较好的显色效果,在紫外灯下可见明亮的黄色荧光;当标准品浓度为103、102和101copies/μL时,未见明显黄色荧光(见图2)。
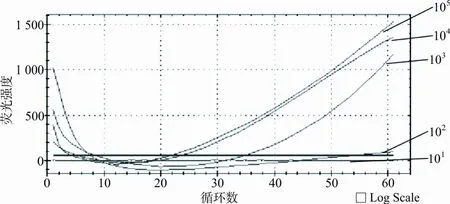
图1 实时荧光LAMP法检测Mp-P1基因标准品

注:1—5,标准品浓度分别为105、104、103、102、101copies/μL。
图2常规LAMP法(SYBR Green Ⅰ 法)检测Mp-P1基因标准品
2.2实时荧光LAMP法灵敏度和特异性结果 Mp经10-6稀释后,实时荧光LAMP法仍可检出,而实时定量PCR法仅可以检出经10-4稀释后的样本,实时荧光LAMP法灵敏度高于实时定量PCR法100倍(见图3)。本研究中建立的实时荧光LAMP法对呼吸道感染中常见菌,包括肺炎链球菌、金黄色葡萄球菌、表皮葡萄球菌、肺炎克雷伯菌、鲍曼不动杆菌、铜绿假单胞菌、大肠埃希菌和肺炎衣原体无反应,其特异性强(见图4)。
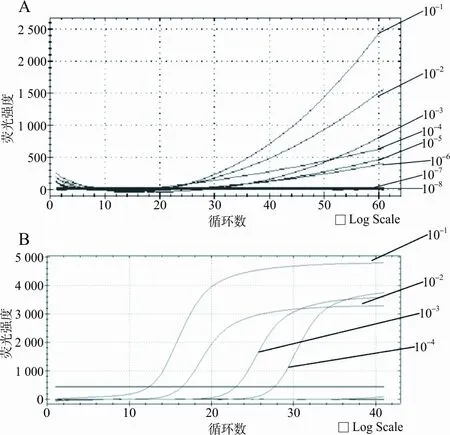
注:A,实时荧光LAMP法;B,实时定量PCR法。

图4 实时荧光LAMP法特异性分析
2.32种方法检测临床患儿咽拭子中Mp-DNA结果 所采集的102位患儿咽拭子基因组DNA分别采用实时荧光LAMP法和肺炎支原体核酸联合检测试剂盒(荧光PCR法)检测Mp-DNA,结果实时荧光LAMP检出率为52.0%(53/102),肺炎支原体核酸联合检测试剂盒(荧光PCR法)检出率为49.0%(50/102),两者检出率差异无统计学意义(χ2=0.176 5,P>0.05)。
3 讨论
目前常用的Mp感染检测方法主要为快速培养法和血清学检测,但快速培养法需耗时1周以上才能获得结果,敏感性低,且可能出现真菌污染而引起假阳性结果,无法满足临床诊断需求。血清学检测是临床常用的检测方法,而支原体基因序列中含有大量终止密码子,无法通过原核表达技术获得重组抗原,难以制备高特异性Mp抗体,尚无法解决检测中出现的假阳性和假阴性过高的问题。并且患儿治愈后体内仍存一定滴度的抗体,易造成假阳性[8]。而某些免疫力低下的患儿,感染后体内抗体滴度较低,处于检测下限,从而出现假阴性[9]。
以实时荧光定量PCR为代表的快速核酸检测技术,凭借其快速、特异、灵敏的特点逐渐成为Mp检测的“金标准”。但该方法反应时间长,对设备要求高,难以在基层医院中推广。LAMP的核酸扩增方法较传统PCR具有较多优势,其扩增效率极高,60 min内扩增产物可达靶基因的109~1010倍;扩增条件简单,只需维持60~65 ℃恒温扩增即可,不必复杂的温控设备;设计4条引物识别靶基因上6个不同区域,方法的特异性高。本研究中加入环引物,可以进一步缩短扩增时间,极大地提高检测效率。本研究结果表明,实时荧光LAMP法的灵敏度较实时荧光定量PCR法高100倍,并且对呼吸道常见病原体DNA无交叉反应。
虽然目前已有采用LAMP法检测Mp的报道,但常规LAMP法是通过直接观察反应副产物或加入染料后(如SYBR Green Ⅰ染料等)直接观察显色变化,或通过浊度仪实时监控,以及琼脂糖电泳等方式判读,都存在较大缺陷。仅依靠LAMP反应副产物或浊度仪检测,敏感度较低。由于LAMP法扩增效率极高,在开盖加入染料或电泳操作过程中极易发生气溶胶污染,甚至造成整个实验室无法使用。本研究在LAMP反应体系中添加一定浓度SYTO-9染料,可以实时监测LAMP反应产物生成情况。SYTO-9为第三代饱和型荧光染料,与SYBR Green Ⅰ等第二代非饱和荧光染料相比,其在饱和浓度下不会抑制DNA链合成,荧光信号更强,十分适合于LAMP反应[10]。本研究结果表明,加入SYTO-9染料后,当样本中靶基因拷贝数达到104时,仅需30 min样本组荧光即与对照组荧光出现显著差异。同时使用实时荧光LAMP法和商品化肺炎支原体核酸联合检测试剂盒(荧光PCR法)检测临床疑似患儿咽拭子标本,Mp-DNA检出率差异无统计学意义。由于实时荧光LAMP法反应对仪器要求简单,反应速度快,检测灵敏度高,值得推广使用。
致谢:感谢首都儿科研究所附属儿童医院孙红妹教授和南华大学医学院游晓星博士给予的帮助和指导。
