不同校准品复溶方式影响碱性磷酸酶和乳酸脱氢酶检测结果*
2020-02-28郭琦汪静曾洁易喜连周伟燕赵海建张传宝
郭琦,汪静,曾洁,易喜连,周伟燕,赵海建,张传宝
(1.北京医院 国家老年医学中心 国家卫生健康委临床检验中心,北京100730;2.中国医学科学院北京协和医学院,北京100730)
碱性磷酸酶(ALP)和乳酸脱氢酶(LDH)是临床实验室重要的检测项目。国际临床化学与检验医学联合会(IFCC)已于2002年、2011年分别发布了LDH和ALP的参考测量程序,并推荐厂家试剂校准品量值溯源至酶学参考系统。目前,酶校准品的制备有以下几种方式:基因工程,如罗氏、和光等;提取动物组织,如贝克曼等;还有直接使用人血清制备,如德赛等。
据国家卫生健康委临床检验中心(NCCL)2012—2016年正确度验证计划结果显示,以3.23%作为精密度的评价标准时,ALP精密度合格率超过85%;然而,以6.72%为偏倚评价标准时,ALP偏倚的通过率小于50%,其中贝克曼的偏倚通过率为25.0%~61.8%、罗氏的偏倚通过率为7.2%~27.5%,不同实验室的检测结果差异较大[1]。酶学项目常规方法的量值溯源通过校准实现,校准需要注意校准品量值溯源的有效性,其中复溶方式会对量值溯源产生一定影响。本研究主要考察不同酶校准品复溶方式对检测结果的影响。
1 材料与方法
1.1材料、试剂与仪器
1.1.1血清样品 21份单人份血清样品(HIV抗体阴性,每份0.5 mL)由北京医院提供。
1.1.2试剂 贝克曼(Beckman)、罗氏(Roche)、德赛(Diasys)、和光(Wako)的ALP和LDH活性测定试剂盒及其配套校准品,分别用B、R、D、W代表。试剂与校准品相关信息见表1。
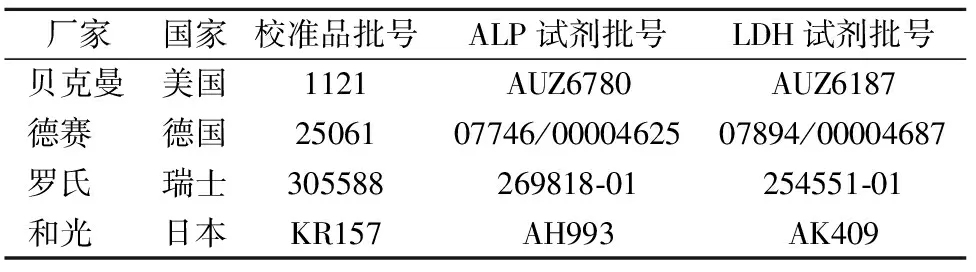
表1 试剂盒和校准品信息
1.1.3校准品 用移液管分别准确吸取5 mL去离子水加入3个校准品瓶,颠倒校准品瓶3次,放置10 min,为消除瓶间差,将3个校准品瓶的校准液混合。然后重新分装到3个校准品瓶中,其中2个校准品瓶在滚筒混匀器上(25 ℃)放置30 min。随后取数支在4 ℃放置至少2 h,记为B0(贝克曼标准校准品);另取数支放置于4 ℃ 0.5 h、1 h、3 h,分别记为B-4-0.5、B-4-1、B-4-3;另取数支放置于25 ℃ 0.5 h、1 h、2 h、3 h,分别记为B-25-0.5、B-25-1、B-25-2、B-25-3;从另一瓶未在滚筒混匀器上放置30 min的校准品瓶中取数支放置于4 ℃ 0.5 h、2 h,分别记为B-4-0.5-N、B-4-2-N。对于罗氏校准品,用移液管分别准确吸取3 mL去离子水加入3个校准品瓶,颠倒校准品瓶数次,将校准品瓶内的校准液混合,取数支在25 ℃放置0.5 h,记为R0(罗氏标准校准品);另取数支在4 ℃分别放置0.5 h、1 h、2 h、3 h,分别记为R-4-0.5、R-4-1、R-4-2、R-4-3;另取数支在25 ℃分别放置1 h、2 h、3 h,分别记为R-25-1、R-25-2、R-25-3。以同样的方式复溶德赛和和光校准品,取数支放置在25 ℃ 2 h,记为D0(德赛标准校准品),取数支放置在25 ℃ 0.5 h,记为W0(和光标准校准品),其余放置在相应条件下,分别记为D-4-0.5、D-4-1、D-4-2、D-4-3、D-25-0.5、D-25-1、D-25-3,W-4-0.5、W-4-1、W-4-2、W-4-3、W-25-1、W-25-2、W-25-3。
1.1.4仪器 贝克曼AU5400、日立7180全自动生化分析仪,罗氏、德赛、和光方法均根据厂家推荐的参数设置表在日立7180全自动生化分析仪上设置参数。
1.2方法
1.2.1挑选待评校准品 分别用B0、R0、D0、W0对方法进行校准,检测不同复溶方式下的贝克曼校准品ALP和LDH的值,包括B0、R0、D0、W0;每种校准品测定3次,同一厂家的校准品于一批内完成测定,测定结果取均值并计算不同方式复溶的校准品与厂家标准校准品之间的偏倚。
1.2.2方法偏倚评价 由于B0校准品是按厂家推荐的标准复溶方式复溶,故以B0为校准品的检测方法为比对方法;以B-25-2为校准品的检测方法为待评方法1,以B-4-0.5-N为校准品的检测方法为待评方法2,用上述3种方法测定21份单人血清,每个重复测定3次,结果取均值后使用最小二乘法估算简单线性回归的参数。根据美国临床和实验室标准化协会(CLSI)EP9-A3计算2种待评方法的绝对偏倚、相对偏倚和3个医学决定水平处的偏倚。
1.3统计学分析 用WPS软件进行统计分析。
2 结果
2.1不同方式复溶的校准品检测结果 见表2。德赛、罗氏和和光的校准品ALP和LDH值在4 ℃和25 ℃下3 h内不随时间变化。其中贝克曼校准品B-25-2和B-4-0.5-N的ALP检测结果偏倚较大,分别为5%和-4%。对于LDH未发现明显偏倚。
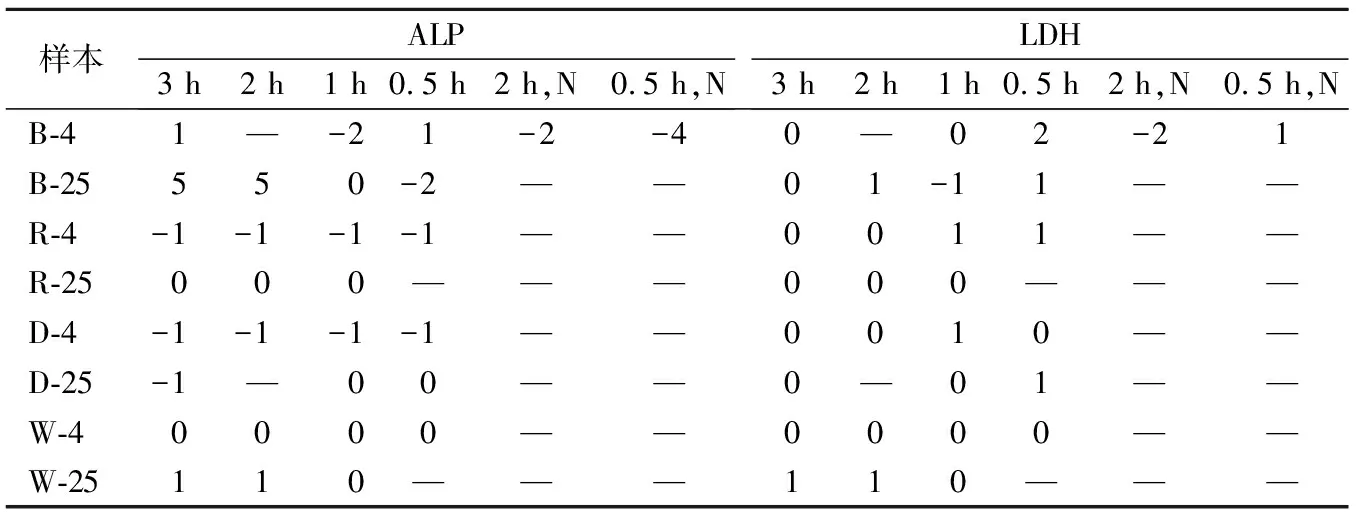
表2 不同复溶方式下校准品与标准校准品测定值的偏倚(%)
注:“2 h,N”专指未在混匀器上混匀,且放置2 h的贝克曼校准品。
2.2对血清酶测定结果的影响 2种贝克曼校准品校准后测定21份血清ALP的待评方法斜率分别为0.973 3和1.041 4,截距分别为-1.823 4和1.790 1,R2均为0.999。由于本实验结果的绝对偏倚和相对偏倚的分布不是正态分布,因此计算偏倚/相对偏倚的中位数;2种待评方法与比对方法相比,绝对偏倚分别为-4.00 U/L、7.17 U/L;相对偏倚分别为-3.92%、5.06%。由图1可知,待评方法与比对方法间的相对偏倚较大,部分检测结果的相对偏倚已超过来源于生物学变异的允许偏倚6.4%。2种待评方法测定ALP在3个医学决定水平处的相对偏倚范围分别为-5.71%~-3.13%、4.59%~7.12%,见表3。
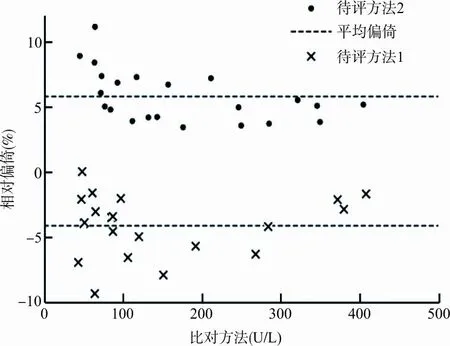
图1 2种待评方法与比对方法检测结果的相对偏倚分布
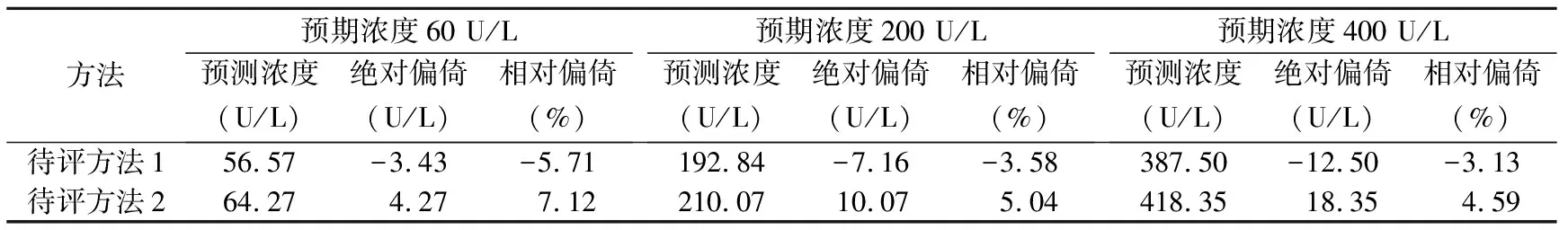
表3 2种待评方法在3个医学决定水平处的偏倚
3 讨论
血清中的ALP包括了4种结构基因型:肝脏-骨骼-肾脏型、肠型、胎盘型和生殖细胞型[2]。不同的ALP最佳反应条件也不一样,2017年的一篇文献[3]指出人肝/骨型ALP的最佳pH值为10.2,胎盘型ALP的最佳pH值>10.4,其余来源ALP的最佳pH值<10.2。贝克曼校准品中的ALP来自于牛肠黏膜,罗氏校准品的ALP来自于基因工程合成的人胎盘型ALP,德赛的ALP来自于人血清,和光的ALP来自于基因工程合成的肝型ALP。这说明不同厂家的试剂需要使用配套校准品的必要性。贝克曼、德赛、罗氏、和光均声称其ALP检测原理是基于IFCC建议的方法。在pH=10.4条件下,2-氨基-2-甲基-1-丙醇(AMP)作为磷酸酯受体,通过测定磷酸对硝基苯(pNPP)到对硝基苯酚(pNP)的转化率来判断ALP的活性[4]。德赛、罗氏的ALP试剂1的pH值分别为10.4、10.44。贝克曼和和光的ALP试剂说明书未写明pH值。
除了必须使用配套的试剂和校准品以外,校准品的复溶方式对检测也有极大的影响,2014年林素平等[5]主要探讨试剂用水量取方式不同对干粉校准品复溶后测量系统的影响。本实验主要探讨复溶方式不同对校准品复溶后测定结果的影响,结果表明,应用相同的试剂和仪器,3种校准品(B-25-3、B-25-2、B25-4-0.5-N)测定的临床血清ALP均值比较,平均偏倚高达5.07%,接近生物学变异率中推荐的偏倚指标6.4%。
在复溶干粉校准品时,酶蛋白结构的完全展开和酶活性的恢复需要一定的时间和条件。在其尚未完全展开恢复活性时,其实测值低于校准品的标示值,如果用此校准品对方法进行校准,那么得到的检测结果就会相对偏高。本实验中的待评方法2所用校准品未按照厂家推荐的复溶方法操作,没有经过30 min的滚筒混匀器且只放置了半小时就进行检测,所得结果大幅偏高,其原因可能是因为未经完全混匀,导致物质在溶液内分布不均。而待评方法1中的校准品是在25 ℃下放置2 h后进行检测,检测结果相对偏低,其原因可能是酶蛋白在温度相对高的环境下,展开得更加完全。所以复溶校准品时应注意保证与其定值时的复溶条件尽量一致。
目前欧洲已强制要求医学实验室的酶学检测方法溯源至参考方法。本实验中的4个厂家的检测系统在其说明书上均声称其校准品溯源至IFCC参考方法,但事实上,由于厂家为了自动化分析的需要或生产过程等原因,会有意无意地对IFCC推荐的参考方法作不同程度的改动,因而实际上各厂家的试剂盒仍存在一定差异[6]。另外各厂家使用的校准品原料也大不相同。本次实验中4个厂家的校准品均不相同,只有贝克曼的ALP为非人源性。实验结果发现贝克曼校准品在针对ALP项目时不同复溶方式对检测结果有影响。对LDH项目,尚未发现类似影响;针对其他厂家的校准品,也未发现类似影响,这可能与贝克曼校准品中ALP的特殊结构有关。此外,结合2012—2016年ALP正确度评价结果分析[1],校准品复溶不规范可能是贝克曼的偏倚通过率偏低的原因之一。
正确复溶校准品是实施准确检测的前提。如实验室工作人员按照不同的方式复溶校准品再进行检测,偏倚将会更大,严重影响临床医生在诊断疾病时的判断。所以临床实验室的工作人员在使用相关校准品时,应严格按照校准品说明书进行操作。
