自组装核酸适配子探针在深部真菌感染可视化检测中的应用*
2020-02-28孟伟王雯章宏祥周发友唐晓磊
孟伟,王雯,章宏祥,周发友,唐晓磊
(1. 邹城市人民医院输血科,山东邹城 273500;2. 滨州市人民医院检验科,山东滨州 256600;3. 皖南医学院第二附属医院基础实验室,安徽芜湖 241000)
深部真菌感染(deep fungal infection, DFI)目前呈现上升趋势,且其以进展快和致死率高为临床广泛关注[1]。对真菌特异性的(1,3)-β-D-葡聚糖检测,能够反映机体感染真菌的情况。目前临床对DFI(尤其是酵母型真菌)诊断主要利用G试验,而临床标本取材质量对G试验检测结果有不同程度的影响;药物、饮食、纱布甚至空气等不同来源的葡聚糖等也可引起结果假阳性。本研究通过指数富集的配体系统进化技术(systematic evolution of ligands by exponential enrichment,SELEX)筛选获得能够特异性结合(1,3)-β-D-葡聚糖的核酸适配子,利用单链核酸适配子折叠的特定空间构象识别靶标,能够有效区分不同来源的葡聚糖,减少假阳性。并通过对配基的设计使其带有自组装显色系统,从而实现通过肉眼观察颜色判读结果。
1 材料和方法
1.1菌株及临床样本 白念珠菌ATCC 900291(武汉大学细胞典藏中心);E.coliDH5α菌体(上海基尔顿生物科技公司)。68例DFI患者血清来源于滨州市人民医院和邹城市人民医院,其中男46例、女22例,年龄42~87岁,诊断标准如下:(1)患者具有真菌感染的相关症状;(2)培养检出酵母型真菌或标本镜检查出孢子;(3)G试验阳性;(4)用抗真菌药物治疗效果显著,纳入本研究中的患者必须达到至少3个标准。68例患者均存在感染症状,且其中59名G试验阳性数据分布为116~282 pg/mL,在使用抗真菌药物治疗后61例明显好转,21例患者培养出真菌(样本分布为4例静脉导管尖端、2例胸腔积液、2例皮下脓肿、13例痰液,检出菌株为白念珠菌13例、热带假丝酵母菌3例、克柔假丝酵母菌1例、毛霉菌3例,曲霉菌1例);32例患者涂片染色检出孢子或菌丝。健康人对照组血清来源于皖南医学院第二附属医院无临床感染症状的体检健康者,共81例,男55例,女26例,年龄22~71岁。
1.2主要仪器及试剂 ssDNA文库和引物合成(上海生工公司),pUC19质粒(上海基尔顿生物公司),血晶素(hemin)和鳜鱼精DNA(Sigma公司),PCR mixture(Promega公司),限制性内切酶XbaⅠ和Hind Ⅲ(TaKaRa公司),葡聚糖酶(上海源叶公司),G试验试剂(湛江安度斯生物公司),其余化学试剂(国药化工);HH-4型水浴锅(苏州威尔实验用品公司),DYCZ-24DN电泳仪(北京六一仪器厂),Multiskan FC酶联仪(赛默飞公司),GC Smart气相色谱(岛津公司),H2500R离心机(湘仪有限公司),ABI 2700 PCR仪(ABI公司)。
1.3(1,3)-β-D-葡聚糖的提取、水解及鉴定 采用碱酶解法从白念珠菌ATCC 900291菌株中提取高聚合度的葡聚糖[2]。经过1 mg/mL β-葡聚糖酶37 ℃酶解4 h,10 000×g10 min,取上清液15 μL与2 μL 10×loading混合,行SDS-PAGE分离和糖原染色分析。通过HPLC(Agilent 1260)分离纯化丰度较高的低分子量(1,3)-β-D-葡聚糖,行气相色谱鉴定。取2 mg多糖样品,加入4 mL 2 mol/L三氟乙酸(TFA)溶液,于110 ℃下酸水解2 h。反应完成后,冷却至室温,溶液于40 ℃减压蒸发至干,再加3 mL甲醇蒸干,完全水解后的样品溶解于2 mL去离子水中,加入20~30 mg NaBH4,间歇振荡,室温下进行还原反应4 h,然后用体积分数为25%的醋酸中和未反应的NaBH4,至溶液不再产生气泡为止,加甲醇5次(每次3 mL),减压蒸干。100 ℃加热15 min,除去残留水分,加3 mL乙酸酐,密闭后于100 ℃下反应1 h,冷却至室温,加甲苯5次(每次3 mL),反复减压蒸发,直至完全干燥。将乙酰化产物用8 mL氯仿萃取,经等体积去离子水洗涤4次,氯仿层用无水硫酸钠干燥,浓缩至体积约0.2 mL后直接进行气相色谱法分析。
1.4适配子的筛选及鉴定 设计适配子文库为:5′-TCTAGAATCCCAATCCCAATCCCA-N50-ACCCTAAAGCTT-3′(共计86个碱基,N为随机碱基:A、T、G及C,单下划线为限制性内切酶XbaⅠ和HindⅢ识别位点序列,双下划线为G四联体反向序列,N50为长度50个碱基的随机序列);引物P1:5′-TCTAGAATCCCAATCCCAATCCCA-3′,P2:5′-AAGCTTTAGGGT-3′。将50 μL/孔(1,3)-β-D-葡聚糖(10 μg/mL)包被于聚苯乙烯微孔中,37 ℃湿盒1 h,鳜鱼精DNA经超声裂解15 min后以100 μg/mL进行封闭。将合成的ssDNA文库(10 nmol)溶于筛选缓冲液(1.8 mmol/L CaCl2,2.68 mmol/L KCl,1.47 mmol/L KH2PO4,3.98 mmol/L MgSO4, 136.9 mmol/L NaCl,8.06 mmol/L Na2HPO4),95 ℃ 10 min后立即冰上冷却5 min,每孔加入1 nmol文库,37 ℃湿盒1 h,弃上清液,使用洗涤缓冲液(含0.1%吐温-20的筛选缓冲液)洗涤微孔3次,每次3 min。每孔加100 μL去离子水,95 ℃ 10 min,取上清液为模板行不对称PCR。50 μL PCR体系:模板2 μL,P1和P2(0.1 μmol/L)各1 μL,2×PCR mixture 25 μL,ddH2O 21 μL。PCR反应条件:95 ℃ 5 min;95 ℃ 30 s,60 ℃ 30 s,72 ℃ 20 s,12个循环;72 ℃ 10 min。经过8轮正向筛选以及4轮微孔和血清的负向筛选,将其克隆至pUC19质粒并导入E.coliDH5α菌体,挑取单克隆并利用酶联寡聚核苷酸吸附试验(enzyme-linked oligonucleotide assay,ELONA)比较单克隆适配子的相对结合力高低,并选取结合力较高的适配子验证其识别结合位点的一致性。
1.5适配子序列的结构改造及结合力验证 对1.4中筛选所得的阳性克隆进行添加G四联体序列。并利用ELONA比较单克隆适配子的相对结合力大小及特异性。取(1,3)-β-D-葡聚糖(10 μg/mL)包被聚苯乙烯微孔,每孔50 μL,加入10 nmol/L生物素标记的适配子以及等摩尔数改造后的含G四联体适配子,前者使用链霉亲合素标记的过氧化物酶显色系统,后者加入hemin使之形成独立的显色系统,催化H2O2生成游离氧氧化四甲基联苯胺(TMB)底物,2 mol/L硫酸终止反应,通过酶联仪检测A450 nm。
1.6添加G四联体适配子的检测性能 将不同浓度(1,3)-β-D-葡聚糖(400 pg/mL、200 pg/mL、100 pg/mL、50 pg/mL、25 pg/mL、12.5 pg/mL、6.25 pg/mL、3.125 pg/mL、1.6 pg/mL、0.8 pg/mL、0 pg/mL)包被聚苯乙烯微孔(每孔50 μL),鳜鱼精DNA封闭,加入100 nmol/L G四聚体加尾的适配子,加入hemin使之形成独立的显色系统,经过20 min显色,2 mol/L硫酸终止反应,通过酶联仪检测A450 nm。
1.7适配子自显色系统对临床标本检测 149份样本同时用G试验试剂盒和适配子自显色系统检测,G试验严格按照试剂盒说明书操作,阳性判读根据仪器说明书。适配子自显色系统由81例阴性血清与68例阳性(确诊为DFI患者)血清测得A450 nm值拟合后形成的ROC曲线,根据约登指数(敏感性+特异性-1)拟合确定cut off值,≤cut off值为阴性,>cut off 值为阳性。
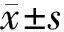
2 结果
2.1水溶性低聚合度(1,3)-β-D-葡聚糖的分离及鉴定 碱酶解法提取(1,3)-β-D-葡聚糖经内切型葡聚糖酶消化处理后,热变性除去蛋白质成分离心后取上清液行SDS-PAGE分离且使用糖原染色,可见水溶性(1,3)-β-D-葡聚糖相对分子质量主要分布在3个范围:<1 700、4 600和10 000~15 000,见图1A。且分子量<1 700的低聚合度葡聚糖丰度较高。使用切胶回收方式将其提取并行190~900 nm波长扫描发现,其在196 nm处显示有吸收峰,见图1B;对其进行元素分析显示,C∶H∶O 3种元素的比值约为1∶2∶1(C、H、O、N元素摩尔数之比为1.012∶2.034∶1.068∶0.027),符合糖类碳水化合物的元素组成特征。且经气相色谱分析,提取的低聚合度糖出峰保留时间为5.896 min,与所使用葡萄糖标准品出峰时间6.079 min较为一致,见图1C和图1D。
注:A,SDS-PAGE分离水溶性(1,3)-β-D-葡聚糖后经糖原染色鉴定,箭头示低聚合度;B,波长扫描分析水溶性(1,3)-β-D-葡聚糖吸收峰;C,气相色谱法用于分析单糖对照(单糖标准品从左向右箭头指示分别为:鼠李糖、葡萄糖、阿拉伯糖、甘露糖、半乳糖和木糖);D,气相色谱法用于分析提取的水溶性(1,3)-β-D-葡聚糖的单糖成分,箭头表示提取的水溶性低聚合度(1,3)-β-D-葡聚糖。
图1水溶性(1,3)-β-D-葡聚糖的分离及鉴定
2.2适配子的筛选及鉴定 经过8轮正向筛选和4轮负向筛选,其每一轮文库之间相对结合力的比较发现,第8轮文库的相对结合力与第7轮比较差异无统计学意义,提示筛选接近平台期。将第8轮文库克隆进pUC19质粒,挑起单克隆,将单克隆中相对结合力及特异性较高的6个适配子(分别命名为A1、A2、A3、A4、A5和A6)进行结合位点的验证。结果显示,6个适配子中能够分别识别4个不同的位点,即A1与A3识别同一个位点,A2与A4识别同一个位点,A5与A6分别识别不同的位点。见图2。

注:A,不同适配子ssDNA文库相对结合力的比较;L,起始文库;1st—8th,分别为第1轮至第8轮筛选所得的文库。B和C,为竞争法验证适配子A1—A6结合位点,Bio-为生物素标记的适配子,其余为未标记适配子。
图2适配子的筛选及结合位点的鉴定
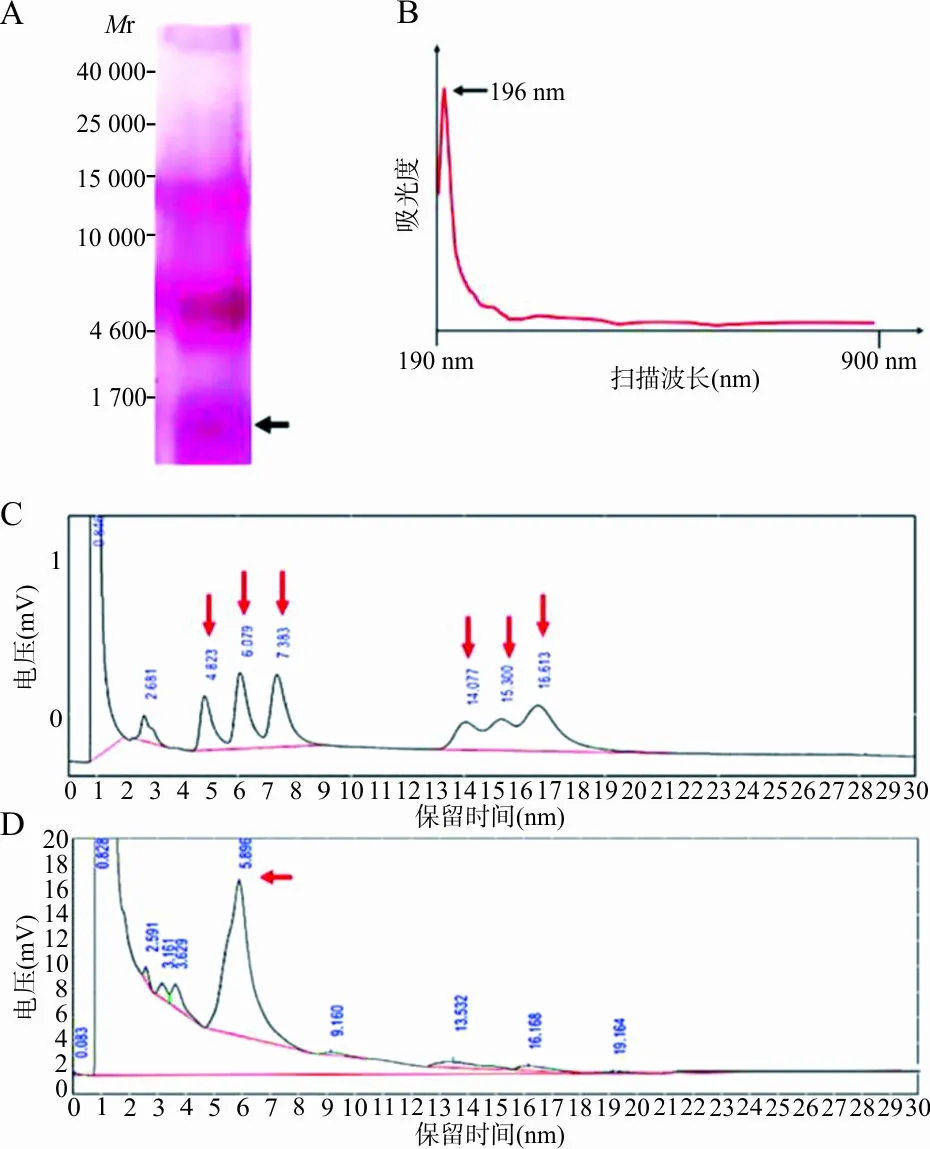
2.3适配子加G四联体序列的性能比对 将核心序列与改造后的序列进行相对结合力检测,结果显示,4种适配子结合力差异无统计学意义(P>0.05),见图3。将4种改进的适配子等摩尔数配制对不同浓度的(1,3)-β-D-葡聚糖进行检测,表明其灵敏度在3.125 pg/mL时仍有肉眼可见的颜色,用酶联仪检测发现,其在1.6~400 pg/mL呈现良好的线性关系,见图4。

图3筛选的适配子及适配子/G四联体复合物的结合性能比较
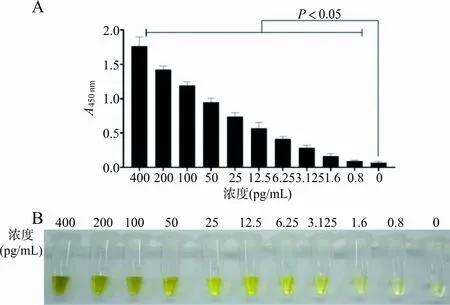
2.4适配子自组装显色系统与G试验的结果比对 对149份(68份DFI患者血清和81份体检健康者血清)标本分别使用2种方法进行检测,适配子自组装显色系统使用酶联仪测得的A450 nm值绘制ROC曲线,见图5,其cut off值为0.613;G试验说明书中说明结果大于等于20 pg/mL为阳性。检测数据显示,适配子显色法的敏感性和特异性分别为98.53%和88.89%;G试验的敏感性和特异性分别为86.76%和96.29%;2种方法检测效能比较,差异有统计学意义(χ2=4.373,P=0.036 5),见表1。
注:A,适配子联合检测对不同浓度(1,3)-β-D-葡聚糖在450 nm波长处吸光度的测定; B,适配子联合检测对不同浓度(1,3)-β-D-葡聚糖的显色。
图44种适配子联合使用自组装显色系统的检测性能
注:A,适配子自组装显色系统检测健康组与DFI组血清中(1,3)-β-D-葡聚糖,DFI组显著高于健康组(P<0.01);B,根据149例血清检测结果拟合出的ROC曲线,由约登指数计算适配子自组装显色系统本批次检测敏感性为98.53%,特异性为88.89%。
图5适配子自组装显色系统对149份血清的检测结果

表1 适配子自组装显色系统与G试验检测性能的比对
3 讨论
本研究通过带有自显色系统的核酸配基对外周血中释放的真菌细胞壁(1,3)-β-D-葡聚糖进行检测,从而为DFI的辅助诊断提供依据。(1,3)-β-D-葡聚糖是葡萄糖单体以不同的化学键耦连的聚合体,其在自然界中广泛存在,而其聚合度和支链的不同使其构象不一[3]。因此本研究根据临床酵母型真菌,尤其是白念珠菌的高感染率[4-5],选用了白念珠菌ATCC 900291标准菌株,并从中提取了高聚合度的(1,3)-β-D-葡聚糖。
机体感染酵母型真菌后被吞噬细胞吞噬消化,细胞壁(1,3)-β-D-葡聚糖被细胞内的葡聚糖酶消化,高聚合度的葡聚糖被酶切为低聚合度的葡聚糖,从而溶解性也随之增大并被释放入体循环。G试验以循环中的低聚合度葡聚糖为靶标,但G试验的活化并非(1,3)-β-D-葡聚糖特异,其他来源的葡聚糖均具类似功能,甚至是空气中悬浮的葡聚糖微粒。因此本研究对白念珠菌细胞壁来源的葡聚糖通过体外葡聚糖酶消化的方法使之转化为可溶性的低聚合度葡聚糖。针对低聚合度的(1,3)-β-D-葡聚糖,本研究使用SELEX技术对抗体制备较困难的靶标筛选核酸配基,该配基具有高特异性、高亲和力特点,且易于合成或改造,从而应用于不同的场景[6-7]。其核酸的不同折叠构象能够精细地识别区分配体的微小差异,因此本研究利用这一特性,在经过正向负向筛选后获得4条识别(1,3)-β-D-葡聚糖不同位点的高亲和力的适配子,并利用G四联体结合hemin后能够催化TMB显色的特性[8]:即利用适配子两端添加G四联体互补序列的部分序列,同时在系统中添加一条完整的G四联体序列,在没有靶标的环境中,则适配子的5′末端和3′末端添加的序列与G四联体序列配对,形成部分双链结构,自组装显色系统则无法形成,溶液不变色;当有靶标时,适配子形成构象与靶标结合,而G四联体序列则由于靶标的影响无法与适配子的5′末端和3′末端添加的序列配对,G四联体作为单链,其游离则会与溶液中hemin形成拟过氧化物酶的特性,进而催化底物显色,从而可以肉眼观察或酶联仪比色定量[8-9]。而针对靶标的不同位点,本研究投入不同的配基,具有一定的放大作用,这对于低水平物质的检测不可或缺。同时DNA的稳定性也是其一大优势,相较蛋白质类的配基,其效价稳定可控且造价低廉,对后期试剂研发有重要意义。
本研究利用上述显色系统对81名体检健康者和68名DFI患者血清中(1,3)-β-D-葡聚糖进行检测,描绘出ROC曲线,根据约登指数拟合确定cut off值。由此获得自建系统敏感性和特异性分别为98.53%和88.89%,高于G试验(敏感性和特异性分别为86.76%和96.29%)。同时,本研究建立的显色系统检测耗时为40 min,少于G试验耗时(90 min)。鉴于本研究是可视化的检测手段开发,而(1,3)-β-D-葡聚糖在机体中的基础浓度远高于我们的检测灵敏度,导致其肉眼分辨的界线不明显,尤其是临界值的判定。因此我们目前正着手优化系统,并辅以比色卡进行结果判读。
综上所述,本文利用SELEX技术筛选了白念珠菌来源的(1,3)-β-D-葡聚糖的配基,并通过对配基改造后能够自主显色,整个过程操作简单、快速。本研究对后期深部真菌感染的床旁检测试剂盒的开发及应用奠定了理论基础。
