新型表面辅助激光解吸附/离子化质谱基质及其在生物检测中的应用
2020-02-28刘虎威
马 雯,白 玉,刘虎威
(1.天然药物及仿生药物国家重点实验室,北京大学 药学院,北京 100191;2.北京分子科学国家实验室,北京大学 化学与分子工程学院,北京 100871)
基质辅助激光解吸附/离子化技术(Matrix-assisted laser desorption ionization,MALDI)是上世纪80年代兴起的一种“软电离”质谱离子化技术。其可实现难挥发、高极性、热不稳定分子,尤其是生物大分子(如多肽、蛋白质、核酸、聚糖等)的检测[1-2]。传统的MALDI-MS采用小分子有机酸,如芥子酸(SA)、2,5-二羟基苯甲酸(DHB)、α-氰基-4-羟基肉桂酸(CHCA)等作为基质,小分子有机酸作为良好的质子供体,可吸收激光能量并将其传递给待测物,从而实现待测物的解吸附和离子化。然而,在激光照射下,小分子基质的自身离子化造成了质谱图中小于700 Da的低质量端严重的背景干扰,从而限制了MALDI-MS在小分子化合物分析中的应用[3]。此外,有机基质结晶不均一通常也会导致信号的重现性较差,难以进行定量分析。为了实现MALDI-MS对小分子化合物的分析,研究者们不断发展新型的有机基质,如Nie课题组[4]开发了2,3,4,5-四(3′,4′-二羟基苯基)噻吩基质用于小分子胺类化合物的分析,该基质背景干扰小,能够实现pmol~fmol级别的灵敏度。近年来,1,5-萘二胺[5]、5,9-氨基吖啶[6]等基质也被用于小鼠组织中内源性小分子的成像。与传统的有机酸基质相比,这些基质在低质量端的干扰普遍较小,能够用于特定小分子化合物的检测,但结晶不均一的现象常常存在,易产生“甜点效应”。表面辅助激光解吸附/离子化质谱技术(SALDI-MS)则利用无机纳米粒子或纳米结构表面为基质,辅助待测物的解吸附离子化[7-8],成为解决MALDI-MS检测小分子化合物问题的另一种有效策略。与MALDI-MS相比,SALDI-MS具有信号重现性好,低质量端干扰小,耐盐度高等优点,已被广泛应用于小分子化合物的分析检测。
1988年,Tanaka等[9]报道了利用Co纳米粒子混合在甘油中作为基质,用于蛋白质和高分子聚合物的检测,随后,Sunner等[10]将粒径2~150 μm的石墨颗粒混在甘油中作为基质用于多肽等物质的分析,并提出石墨SALDI的概念。一般而言,SALDI-MS基质的选择通常需满足以下条件:备选材料在激光波长范围内有足够的光吸收系数,能有效吸收激光的能量;具备一定的热容量,能够将能量传递给待测物;材料表面能够提供质子等基团,以促进待测物的离子化。围绕这些要求,研究人员探索了一系列不同组成、不同粒径、不同形貌的纳米材料作为SALDI-MS基质的可能性。这些基质材料各具特性,大大拓展了可分析化合物的种类和质量范围,使得SALDI-MS技术广泛应用于食品安全、环境监测、生命科学等领域。本综述基于该领域的相关研究,主要总结了最近5年SALDI-MS基质的发展及其在生物检测中的应用。
1 SALDI基质的发展
1.1 金属及金属氧化物材料
金属及金属氧化物纳米材料在紫外-可见光区域具有较高的光吸收系数、较宽的质量分析范围、易于合成的尺寸和形貌可控的颗粒,以及易于修饰不同的官能团等优点,因而在SALDI-MS基质研究中应用最为广泛。目前文献报道的金属及金属氧化物类SALDI-MS基质主要包括Au、Ag、Ge、Pt、Se、TiO2、ZnO、ZrO2、NiO、Fe3O4等[11-13]。上述基质材料均有其独特的性质,如Au与巯基基团具有特异性配位作用,常被用作测定体液或细胞中巯基化合物的基质;TiO2能够与磷酸基团配位使其广泛应用于磷酸化肽和磷酸化蛋白质的富集检测;Fe3O4具备磁性,易于分离,将其表面改性或与其他材料复合后,可同时实现目标物的快速磁分离和原位检测。表1总结了金属类SALDI-MS基质及其在生物检测中的应用实例。

表1 金属类SALDI-MS基质及其分析对象
(续表1)

NanoparticleornanostrctureAnalyteRealsamplePublicationyearReferenceDopamine-modifiedTiO2monolithMetabolitesandlipidsMousebraintissue2017[28]Doxorubicin/polyethyleneglycol-MoS2DrugsMousetissue2018[29]
金属纳米粒子(Au/Ag)是应用最为广泛的金属类SALDI基质材料,常被用于小分子代谢物的检测和成像。Qian课题组[14]设计合成了等离子体银纳米层包覆的颗粒用于体液中药物和代谢物的直接检测。由于SiO2@Ag颗粒具有粗糙表面,在激光照射下可产生热载流子,促进了代谢物的解吸附离子化。利用该基质,通过对脑损伤术后病人脑脊液中葡萄糖含量的测定和脑水肿病人血清中甘露醇的药代动力学研究,可直接监测病人的预后情况。对比常用的医学检测方法,该工作具有简单、快速、直接的优势。此外,Ag纳米粒子与Fe3O4复合,除具备SALDI-MS基质功能外,还具有捕获细菌的功能[15]。材料粗糙的表面可以用来捕获细菌,Fe3O4内核有利于后续分离,同时Ag离子可起到抑菌作用。研究人员利用该复合材料,对抑菌过程中细菌代谢物进行原位检测,发现苹果酸和赖氨酸水平明显下调,进而提出细菌的细胞膜破裂和蛋白质合成功能紊乱可能是Ag离子抑菌最主要的原因。2018年,该课题组通过粒子合成、溶液浸润、金溅射等方式制备了等离子激元金芯片[16]。芯片上的微阵列可实现500 nL体液和外泌体中代谢物的高通量检测。利用该方法测定非小细胞肺癌病人和正常人的代谢物含量,展现了两者之间代谢图谱的差异。同样以Au纳米粒子为基质,Chang课题组[17]利用三氯蔗糖为内标,测定了乳腺癌细胞(MCF-7,MDA-MB-231)和非癌细胞(MCF10A)中5种代谢物甘氨酸、丙氨酸、胆碱磷酸、葡萄糖和谷胱甘肽的含量,发现不同种类细胞的代谢物含量具有较大差异。利用该方法可实现不同抑制剂和抗癌药物刺激下细胞中代谢物水平的定量分析,有利于药物筛选过程。
同一类金属材料的不同组成、尺寸、形貌或表面修饰均影响其在SALDI-MS中的性能[18-20]。Lu课题组[21]设计了超疏水的金纳米锥基质,该纳米锥阵列在355 nm处可吸收99.65%的激光能量,而基质尖端可以聚焦更高的能量以促进待测物的解吸附离子化。其超疏水性可以实现待测物的富集,SALDI-MS的检测灵敏度显著提高,可实现低至100 ymol/μL谷胱甘肽和精氨酸的检测。Shen课题组[22]探究了不同粒径的Ag纳米粒子在检测阿尔茨海默症关键物质——β-淀粉样蛋白中的影响。对比大粒径颗粒,2.8±1.0 nm 的小粒径Ag纳米粒子表现出最优异的检测性能。同样,材料的不同组成成分也会显著影响SALDI-MS的检测结果。Ng课题组[23]探究了不同组成的金属合金纳米粒子在指纹成像中的应用。对比单纯的Ag纳米粒子,Au的加入有效抑制了Ag的团聚,从而增加了成像结果的稳定性;而对比单纯的Au纳米粒子,Ag的加入则提高了光吸收效率,因而成像对比度和清晰度显著提高。该结果也表明,对比金属单质,金属合金在检测指纹中化合物时灵敏度更高,具备更加优异的性能。与检测小分子化合物相比,生物大分子的检测同样面临挑战。通过对金属纳米粒子表面修饰和功能化,可实现对蛋白质、核酸、聚糖等生物大分子的检测和成像。本课题组[24]设计开发了基于Au纳米粒子的双功能激光可裂解探针用于细胞表面聚糖的检测(图1)。Au纳米粒子表面修饰上不同的凝集素和质谱标签形成质谱探针,在激光作用下,结合不同糖苷的Au纳米粒子会产生对应的质谱标签的信号,从而反映细胞表面聚糖的表达水平。该探针表面修饰的大量质谱标签起到信号放大作用,检出限低至20个细胞,且探针间无相互干扰,可在同一体系中实现对多种聚糖的同时测定。此外,该探针还可实现肿瘤患者组织表面聚糖分布的可视化成像,反映出患者癌和癌旁组织、同一组织不同病理变化区域和具有不同微观结构区域中多种聚糖表达水平的变化。该工作提供了一种原位、高灵敏、多目标、定性定量的质谱检测及成像方法,不仅有助于揭示各类肿瘤聚糖含量的变化,也有望应用于临床诊断和肿瘤标志物的筛选。
金属氧化物比金属纳米粒子具有更好的稳定性,一些金属氧化物与待测物产生特异性相互作用或具备强磁性,因而既能作为基质材料,又能用作富集材料。Qian课题组[25]将抗上皮细胞黏附因子修饰在Fe3O4表面,用于捕获全血中浓度极低的循环肿瘤细胞,并实现细胞中代谢物的原位检测。随后,该课题组设计合成了透明质酸修饰的磁性纳米粒子,利用透明质酸与生物标志物CD44间的相互作用开发了无需抗体识别的CD44富集及SALDI-MS检测新方法,该方法的检出限低至0.6 ng/mL,且在1 ng/mL~10 μg/mL范围内具有很好的线性响应[26]。近来,半导体TiO2材料也被用于研究细菌的耐药性机制,当细菌接触到修饰有多孔TiO2的MALDI靶板时,会被TiO2孔洞捕获并在其表面聚集[27]。光敏性TiO2在吸收激光能量的同时使细菌的细胞膜破裂,促进细菌内蛋白质,尤其是大于15 kDa蛋白质的解吸附离子化。依据检测到蛋白质种类和表达水平的不同,该方法可区分耐药性细菌和非耐药性细菌,从而为临床细菌分型提供了一种简单、快速的检测方法。然而,TiO2纳米粒子一般具有较低的紫外吸收效率及酯水解催化活性,从而限制了其在磷脂和很多低丰度化合物检测中的应用。为改善这一缺点,Sweedler课题组[28]发现将多巴胺修饰至TiO2时,材料的紫外光吸收能力显著提升,表面pH值升高,使其对Lewis碱性化合物具有更好的选择性和检测灵敏度,磷脂检测的信噪比也较之前有10~30倍的提升。该基质材料最终被用于幼鼠及老年鼠鼠脑中代谢物的成像,揭示了与衰老过程相关的神经化学物质的变化。此外,Nie课题组[29]利用负载阿霉素的MoS2纳米片,结合激光解吸附/离子化质谱(LDI-MS)成像技术,实现了组织中药物原位释放的可视化研究。该研究发现在荷瘤小鼠模型中,阿霉素具有组织依赖性释放行为,肿瘤中释放最多,肝组织中释放最低。组织成像结果表明,载药MoS2纳米片层主要分布在肺、脾、肝组织,而在肿瘤组织中的积累却低于正常组织。这一策略同样适用于其他药物载体系统,从而为评价亚器官水平的纳米载体药物的释放研究开拓了新路径。
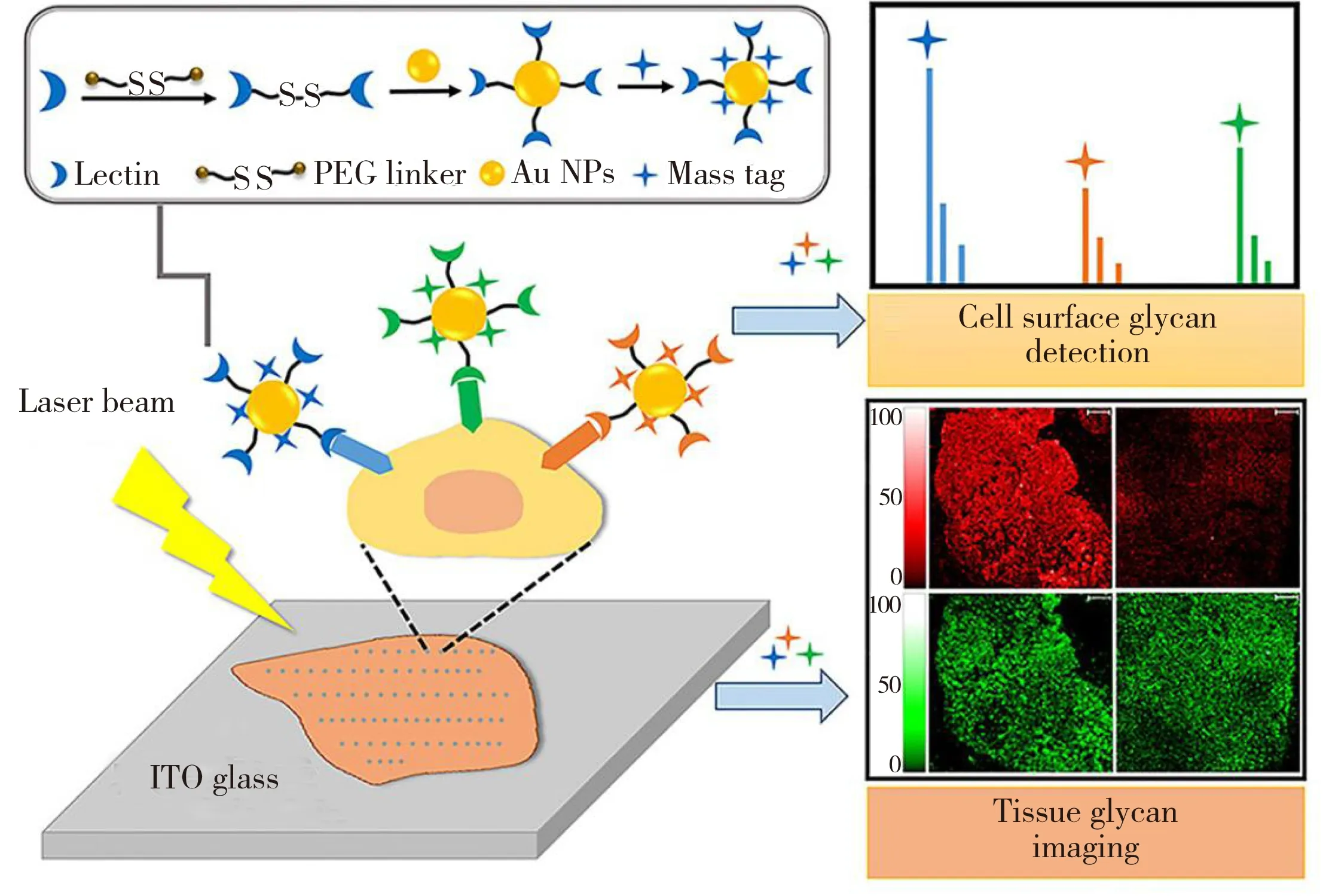
图1 双功能激光可裂解探针的合成及其在细胞表面聚糖的检测和成像应用[24]
1.2 碳材料
碳纳米材料是研究较早、较为充分的一类SALDI-MS基质,其包括石墨烯、富勒烯、碳量子点、碳纳米管和碳纳米纤维等一系列材料[30-33]。大部分碳材料对激光有强烈吸收,且易于与待测物形成均一的共结晶,提高结果的重现性。
石墨烯是二维、单层,具有sp2杂化碳的六方堆积结构,其具有超高比表面积、较高的热传导性和光吸收效率,是SALDI-MS的优异基质。Nie课题组[34]利用一步超声剥离合成法制备了氟化石墨烯纳米片用于负离子模式下小分子化合物的检测。与氧化石墨烯和碳纳米管基质性能对比,氟化石墨烯纳米片在低质量端(<200 Da)具有更简单的背景,且检测过程中不会因放电造成质谱真空腔的污染,能够用于一系列化合物包括氨基酸、药物、小分子代谢物、有机氮化物、多肽等的检测。此外,由于该基质与生物样本兼容性好,还成功实现了尿液中外源性褪黑素和唾液中内源性唾液酸的检测。Ouyang课题组[35]通过原位光聚合反应制备了均一的多孔乙烯二氧噻吩/石墨烯薄膜,该薄膜克服了纳米材料团聚的缺陷,因而提高了SALDI检测的重现性和定量能力。另外,通过固相微萃取方式,该材料还可用于体外和活体中5种雌激素的检测。氧化石墨烯表面具有羧基和羟基等官能团,在水中的分散性更好,不易团聚,上述活性基团也能促进待测物的离子化。Cha课题组[36]制备了氧化石墨烯嵌入的溶胶-凝胶薄膜用于天然样本中代谢物指纹图谱的获取。该薄膜同时适用于质谱的正离子和负离子检出模式,可实现脑脂质粗提物、番茄的甲醇提取液和微藻培养样本中代谢物的直接检测。Jiang课题组[37]利用氧化石墨烯具有高比表面积这一优势,通过聚乙二醇连接臂修饰抗体,使其成为双功能材料,在捕获氯霉素的同时实现SALDI原位检测,测得水样和血清中氯霉素的检出限为10 pg/mL,远低于酶联免疫吸附测定和气相色谱法的结果。
碳点是一类新兴的碳材料基质,其为一类极细微粒,几乎各向同性,生物相容性好且易于后修饰。Liu课题组[38]合成了N、S元素掺杂的碳点,并将其用于氨基酸、多肽、核苷和抗癌药的检测。该碳点材料表现出较高的检测灵敏度、耐盐度和重现性,能直接应用于血清中代谢物的检测及乳腺癌病人血清中葡萄糖的定量分析。与9-氨基吖啶基质相比,碳点基质获得的细胞代谢物检测结果可以更好地区分乳腺癌细胞亚型。Cai课题组[39]则探究了N、S掺杂的碳点在鼠组织中双酚S成像中的应用。得益于碳点极小的粒径,该研究的成像分辨率达50 μm,且双酚S的检出限低至pmol。小鼠口服双酚S后,利用SALDI-MS成像方法可监测出不同口服时间后鼠组织(鼠肝脏、肾脏、脾脏、心脏)中双酚S的分布。Liu课题组[40]制备了表面富含羟基的石墨点材料用于生物样本中小分子的监测和原位成像。该材料在低质量端背景干扰小,能实现fmol小分子的检测,灵敏度比DHB、CHCA等有机基质提高了3个数量级。在小鼠腹腔注射葛根素后,该材料可监测小鼠血清中葛根素的含量,药代动力学曲线证实了服药30 min后,小鼠体内的葛根素浓度最高。而随后的成像实验则证实了葛根素及其代谢物黄豆苷元和二氢黄豆苷元在小鼠肾脏中的分布。此外,该工作还对石墨点作为SALDI基质的机理进行了初步探究,实验和密度泛函理论计算结果证实了石墨点表面的大量羟基在促进待测物离子化方面有降低能垒的作用。
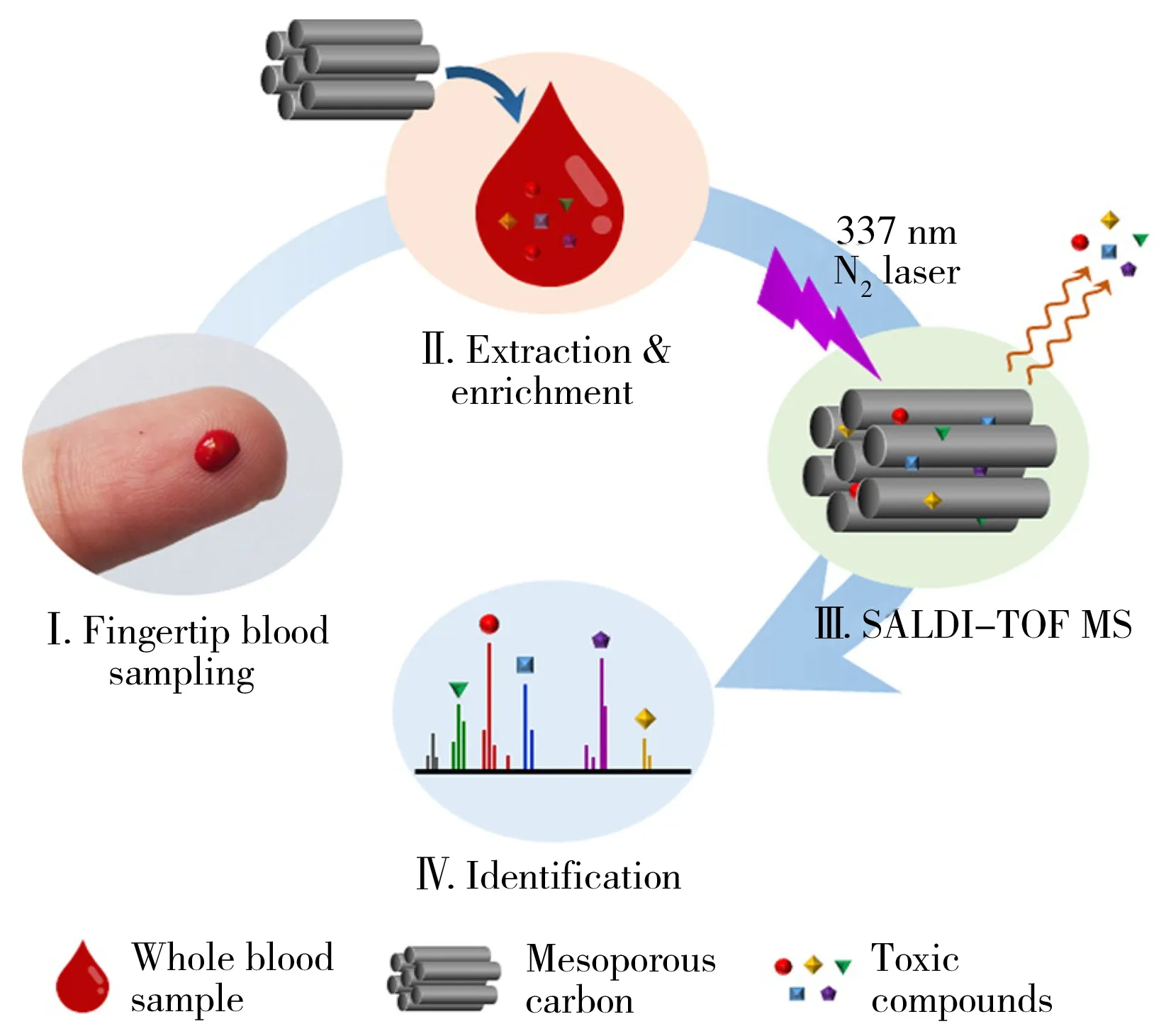
图2 利用介孔碳材料检测人的单血滴中有害化合物的步骤[42]

1.3 硅材料
另一类常用的SALDI-MS基质为硅材料,如多孔硅、硅纳米线、硅纳米柱阵列、硅片等[45-47]。由于部分硅材料具有较强的疏水性质,在作基质的同时常被用于特异性富集或除盐。早在2001年,Siuzdak课题组[48]就提出了多孔硅解吸附/离子化质谱(DIOS-MS)的概念,近年来,这一技术被用于指纹汗液中外源性和内源性小分子药物的成像[49]。通过构建多孔硅薄膜芯片,无需复杂的样品前处理步骤,即可实现指纹中多种药物及其代谢物的直接成像。SALDI-MS成像策略也为体液中药物检测、美沙酮用药依赖性以及药物筛选等领域提供了新的方法。Voelcker课题组[50]制备了纳米多孔硅微粒,用于检测体液中的处方药物和非法用药。在系统优化了尺寸、孔径、孔深以及表面功能化后,多孔硅基质实现了临床样本中美沙酮、可卡因、3,4-亚甲基二氧甲基苯丙胺和氧可酮等物质的高灵敏检测。Lu课题组[51]利用多孔硅材料对全血中的药物进行液相微萃取,经过简单分离后直接进行原位检测。该方法对于全血中维拉帕米和美沙酮的检出限分别为10-11和10-13mol/L,尿液中检出限分别为10-13和10-14mol/L,其定量范围横跨8~9个数量级。Vertes课题组[52]采用硅纳米柱阵列作为基质,用于标准品和人血清中代谢物的轮廓分析。在非靶向代谢组学分析中,该基质能从代谢物混合标准品中检出374种化合物,其中287种化合物能获得较好的二级质谱图。这些化合物种类繁多,包括了氨基酸、核苷酸、糖类、脂质等,涉及到31条代谢通路,而利用硅纳米柱阵列能检测到通路所涉及的63%的代谢物。通过优化实验,针对20种氨基酸,该基质能实现所有目标氨基酸的靶向检测。这一研究展示了硅纳米柱阵列在代谢物大规模鉴定中的应用。
除单一的硅材料外,研究人员通常将其他材料与硅复合,制备灵敏度更高、性能更好的SALDI基质。Tsao课题组[53]通过两步无电镀沉积法和一步电镀刻蚀法制备Au包覆的硅纳米柱阵列材料,用于体液中葡萄糖的定性定量分析(图3)。在金纳米粒子的催化下,葡萄糖被氧化成葡萄糖酸,继而在负离子模式下被检出,检测灵敏度显著提高。具有核壳结构的SiO2@Au材料作基质时,可实现体液中低至pmol~fmol浓度代谢物的检测[54],而将核酸适配体修饰至SiO2@Au表面时,材料则具备双重功能,能对卡那霉素进行有效富集和原位检测,检出限为200 pmol/L。最近,Lu课题组[55]在玻璃表面覆盖氟硅酸修饰的二氧化硅纳米粒子层,并在其上沉积金纳米粒子。由于修饰后的二氧化硅层具有强疏水性,能对待测物进行除盐和富集,再结合金的解吸附/离子化作用,可实现对1 pmol/μL罗丹明6G的高重现性检测,且罗丹明6G在1~50 fmol/μL浓度范围内具备很好的检测线性(r2>0.99)。最终,该复合基质被用于湖水中痕量孔雀绿和人血清中血管舒缓肽1-7的检测。除与金属纳米粒子复合外,硅材料还能与碳材料复合,用于抗抑郁药物的测定[56]。

图3 金修饰的硅纳米柱阵列用于葡萄糖的定性定量分析[53]
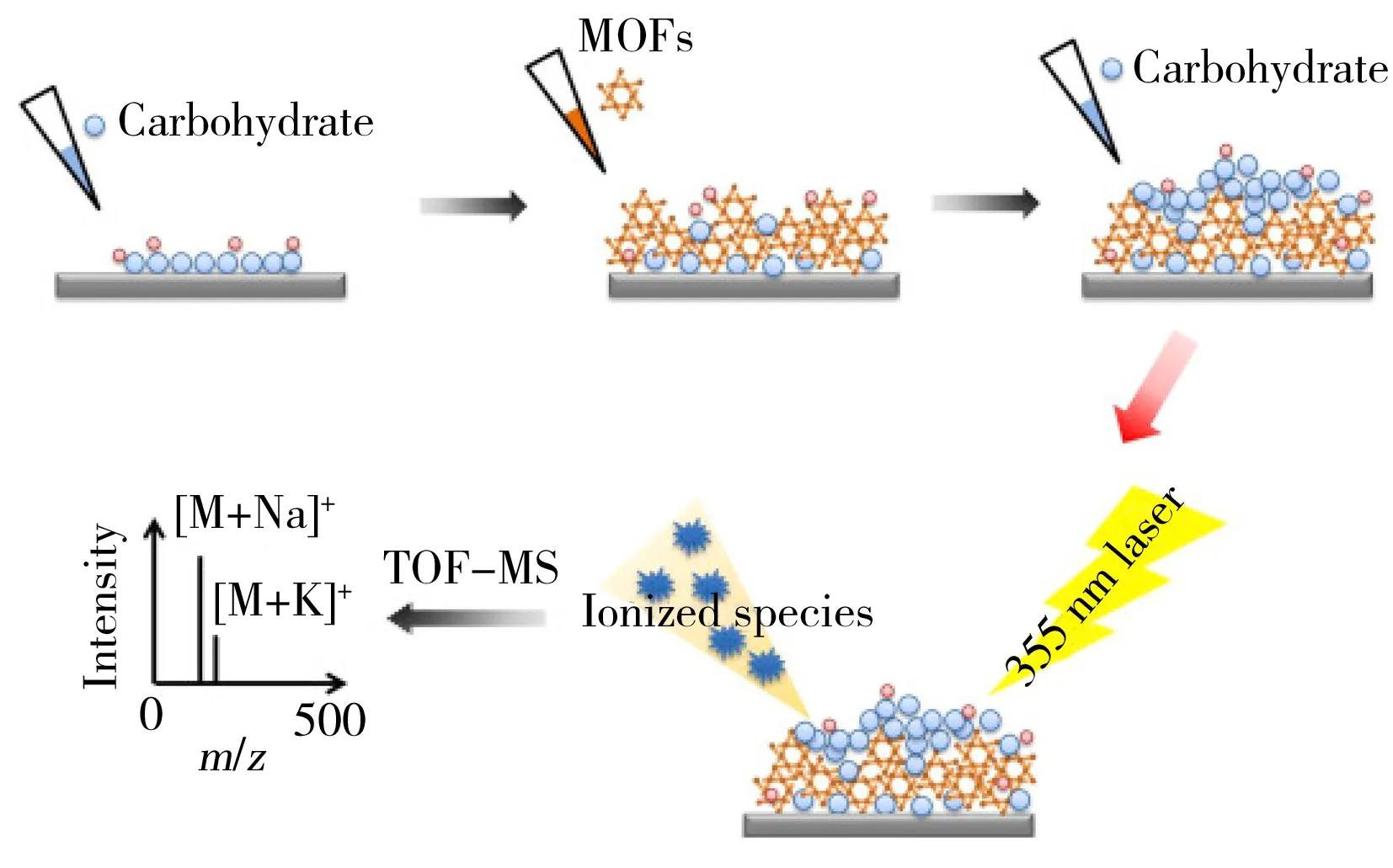
图4 利用MOF作SALDI-MS基质时的样品前处理流程[61]
1.4 金属有机骨架化合物
金属有机骨架化合物(Metal-organic framework,MOF)是近十几年来兴起的纳米多孔类“明星”材料[57]。由于该类材料普遍具有高比表面积、可调的多孔性结构、较好的热稳定性以及易于修饰等优点,已经被广泛应用于气体存储、生物传感、反应催化、样品前处理等领域[58-59]。2013年,Huang课题组[60]首次将MIL-100(Fe)引入SALDI-MS中用于多环芳烃的检测。随后,该课题组将3D MOF作为极性单糖检测的基质(图4),尝试了MIL-100(Fe)、MIL-100(Cr)、MIL-100(Al)、MIL-101(Cr)和UiO-66(Zr)等多种材料,结果证实MIL-100(Fe)的效果最好[61]。这是由于该MOF材料作为Lewis酸(Fe3+)与糖发生相互作用或作为Lewis碱(Fe2+)用于稳定糖-碱金属加合物。
近年来,随着MOF材料和后修饰技术的发展,用作SALDI-MS基质的MOF种类及可分析化合物的种类明显增多,通过与功能性材料复合或修饰特定的官能团,MOF材料可以兼具基质和富集两种功能[62-63]。Cai课题组[64]报道了以ZIF-8包覆的磁性纳米材料作为SALDI-MS基质,在负离子检测模式下实现了一系列小分子化合物包括脂肪酸、多肽、性激素等的高灵敏响应,且待测物以丢失质子的形式被检测,避免了正离子模式下复杂的碱金属加合物峰。该基质用于血清和尿液中褪黑素的定量分析,检出限低至0.5 μmol/L。此外,由于ZIF-8的Zn离子与组氨酸间的配位作用,该材料还可用于痕量组蛋白的富集检测。Zou课题组[65]合成了两种新型MOF材料,UiO-66-PDC和UiO-66-(OH)2,与传统有机基质DHB相比,MOF材料结晶致密、均一,检测小分子时具有很好的重现性并可对磷酸吡哆醛和葡萄糖实现定量分析(r2>0.99)。UiO-66骨架中的Zr离子与磷酸根基团存在静电吸引作用,利用这一特性,材料还可用于生物样本中磷酸化肽的富集。尽管文献报道了多种作为SALDI-MS基质的MOF材料,然而大多数MOF材料的选择呈现随机性,且不经修饰的MOF由于缺少可解离的官能团而限制了待测物的离子化效率,导致可分析的化合物种类十分有限。本课题组设计了简单的两步MOF后修饰策略合成了一系列官能团修饰的MOF材料用作SALDI基质[66]。这些官能团含有羧基、氨基或羟基基团,能够有效提高待测物的离子化效率。其中,半胱氨酸后修饰MOF材料表现出最好的基质效果,在检测脂质、糖类、药物、氨基酸、小分子肽和聚合物时均表现出很高的灵敏度。该基质在1 mol/L氯化钠存在情况下,α-环糊精的信号仍未受到较大影响,表现出很强的耐盐能力。此外,得益于半胱氨酸的高亲水性和静电作用,该材料能从卵白蛋白中高选择性富集30条糖苷,进一步拓展了其应用。
1.5 其他材料
2 总结与展望
SALDI-MS是利用无机纳米粒子或纳米结构表面为基质的一种促进待测物解吸附离子化的质谱技术,其具有耐盐度高、信号重现性好、低质量端干扰小等优点,特别适用于小分子化合物如氨基酸、脂质、药物、肽段、激素等的检测,弥补了传统MALDI-MS技术在小分子分析中的不足。本综述总结了近5年来新型SALDI-MS基质(金属类材料、碳材料、硅材料、金属有机骨架材料等)及其在生物检测和成像中的应用。SALDI-MS技术作为一种新型的高灵敏、操作简便、高通量的质谱检测方法,将在生物、环境、药物等诸多研究领域中发挥作用。
然而,尽管科学家们报道了大量的SALDI-MS材料,对于这些材料促进待测物解吸附/离子化的物理和化学机理却鲜有研究,对于不同特性的材料具有相似的离子化效率这一现象也缺乏理论支撑,这导致在针对特定化合物时需要谨慎地“挑选”合适的基质。近年来,新型纳米材料在样品制备中的应用方兴未艾,发展兼具样品制备功能的SALDI-MS新型基质将是该领域的研究方向;SALDI-MS具有操作简便和检测速度快的优点,因而探索其在临床快速诊断领域的应用显得尤为重要;此外,现有材料大多对1 000 Da以内的小分子物质具有很好的响应,而对于核酸、聚糖等生物分子的检测却有局限,因此,发展新型纳米基质,扩展检测的质量范围和分析物种类也是该领域研究人员需探索的方向。
