胰腺癌中Circ_0001946的表达及其与患者预后的相关性
2020-02-28邓颖白义凤杨兰王林周晓刚
邓颖,白义凤,杨兰,王林,周晓刚
0 引言
胰腺癌(pancreatic cancer,PC)是一种起源于胰腺腺管上皮细胞的恶性程度极高的消化道恶性肿瘤,其发病率和死亡率呈明显上升趋势,尽管胰腺癌在手术、放疗、化疗、免疫治疗等领域取得了一些进展[1],但由于缺乏敏感度和特异性的早期诊断指标、大部分患者发现时已是中晚期,患者一般情况差,难以耐受有效的治疗手段[2]。因此,寻找胰腺癌早期诊断及疗效评估生物标志物,对于改善预后及提高患者生存具有十分重要的意义。
环状RNA(circRNA)是一类特殊的非编码RNA分子,呈封闭环状结构,不受RNA外切酶影响,表达稳定,不易降解[3]。近年研究表明,circRNA分子富含miRNA结合位点,在细胞中起到miRNA海绵的作用,进而解除miRNA对其靶基因的抑制作用,升高靶基因的表达水平。通过与疾病关联miRNA相互作用,circRNA在疾病中发挥着重要的调控作用[4]。有研究发现,circRNA参与多种肿瘤的发生、发展,与肿瘤的预后相关[5]。然而关于circRNAs在胰腺癌中的作用机制尚未完全阐明。课题组前期通过基因芯片在胰腺癌组织及癌旁组织中检测差异表达的circRNA,结果发现Circ_0001946在胰腺癌组织中高表达。然而关于Circ_0001946在胰腺癌中的作用目前少见报道,本研究旨在探讨Circ_0001946在胰腺癌患者中的表达及临床意义。
1 资料与方法
1.1 标本来源
经医院伦理委员会的批准,所有患者签署了书面知情同意书。收集2014年1月—2018年12月于四川省人民医院确诊的胰腺癌患者癌组织及配对癌旁组织55例,同时收集患者的血清标本。所有胰腺癌组织及配对的癌旁组织均经病理学确诊。所有患者术前均未接受过放化疗和(或)中药抗肿瘤。所有切除的新鲜组织标本均立即用液氮冷冻直至使用。同时收集30例健康体检者的血清标本作为对照。所有入选病例确诊后即刻用含抗凝剂的紫色采血管采集10 ml静脉血4℃冷藏30 min后,室温下3 000 r/min离心15 min,留取上层血清,置于-80℃冰箱备用。
1.2 随访
所有患者出院后均进行了随访。随访起点为手术或病理活检日期,末次随访时间为2019年4月30日,至随访截止日,生存15例,死亡37例,失访3例。
1.3 qRT-PCR法分析Circ_0001946的表达水平
TRIzol法提取组织及血清标本中总RNA。将提取的总RNA,参照AMV反转录试剂盒说明书将其反转录成cDNA。采用2×SYBR Green PCR Master Mix,以cDNA为模板,进行实时荧光定量PCR。PCR反应在定量PCR反应仪上进行。三次独立实验后得到的数据运用公式RQ=2-ΔΔCt进行分析。
1.4 统计学方法
采用SPSS13.0统计软件进行数据分析。Circ_0001946在血清及组织标本中的差异表达采用t检验分析。Circ_0001946与各临床病理参数之间的关系使用Chi-Square检验;Kaplan-Meier法分析Circ_0001946的表达与生存时间及预后的关系,应用单因素及多因素Cox比例风险模型分析影响胰腺癌预后的因素,P<0.05为差异有统计学意义。
2 结果
2.1 Circ_0001946在胰腺癌组织及血清中的表达
qRT-PCR法检测结果发现与对照组比较,Circ_0001946在胰腺癌患者组织及血清中的表达明显增高,差异有统计学意义(均P=0.000),见图1A~B。
2.2 血清Circ_0001946的表达与患者临床病理特征的关系
根据血清Circ_0001946的平均表达水平,将其分为Circ_0001946高表达组(≥8.430)及低表达组(<8.430)。结果发现Circ_0001946的表达与患者的性别(P=0.911)、年龄(P=0.567)、CEA的表达(P=0.509)无关;与淋巴结转移(P=0.015)、CA199的表达(P=0.000)、疾病分期(P=0.027)及脉管癌栓(P=0.000)明显相关,见表1。
2.3 胰腺癌患者生存分析
Kaplan-Meier法分析发现高表达Circ_0001946的患者中位无进展生存时间及总生存时间均较低表达者明显缩短,差异有统计学意义(均P=0.000),见图2。
2.4 血清Circ_0001946与CA199的相关性研究
进一步分析发现血清Circ_0001946与CA199的表达量呈正相关关系(r=0.765,P=0.000),见图3。
2.5 血清Circ_0001946诊断胰腺癌的效能
ROC曲线分析血清Circ_0001946诊断胰腺癌的生物效能,结果发现ROC曲线下面积为0.805(95%CI:0.754~0.927,P=0.000),见图4。
2.6 单因素及多因素分析影响胰腺癌患者预后因素
单因素及多因素Cox比例风险模型分析结果显示,疾病分期(P=0.007)、Circ_0001946表达(P=0.004)及脉管癌栓(P=0.014)是胰腺癌患者预后的独立影响因素,见表2。
3 讨论
胰腺癌临床表现隐匿,由于缺乏敏感度和特异性的早期诊断指标,因此早期诊断困难,发现时已是中晚期,预后极差[6],是癌症相关死亡的主要原因[7]。寻找胰腺癌早期诊治的新靶标,对于改善预后及提高患者生存时间具有重要的临床意义。
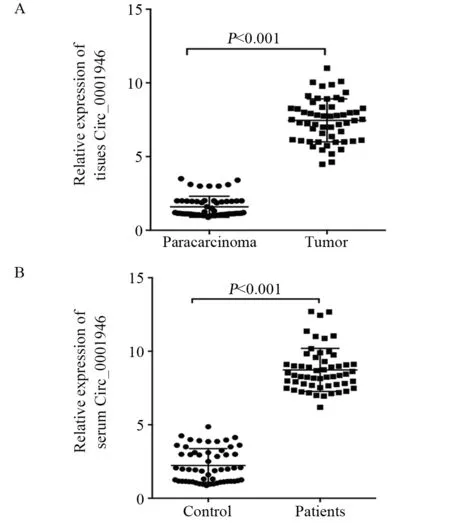
图1 qRT-PCR法检测Circ_0001946在胰腺癌患者组织(A)及血清(B)中的表达Figure 1 Circ_0001946 expression in tissues(A) and serum(B) of pancreatic carcinoma patients detected by qRT-PCR
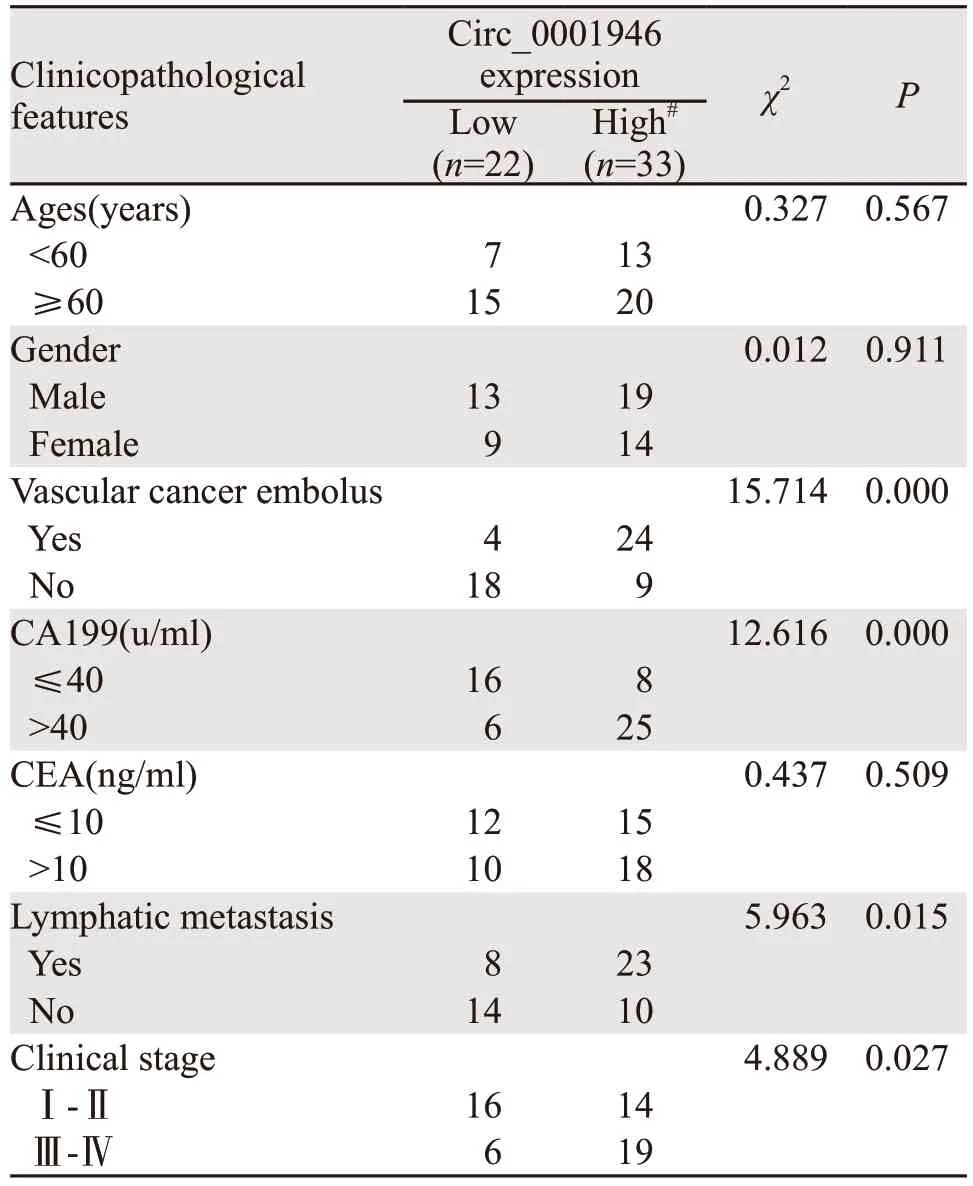
表1 胰腺癌患者血清Circ_0001946的表达与临床病理特征的关系Table 1 Correlation between Circ_0001946 expression and clinicopathological features of pancreatic cancer patients
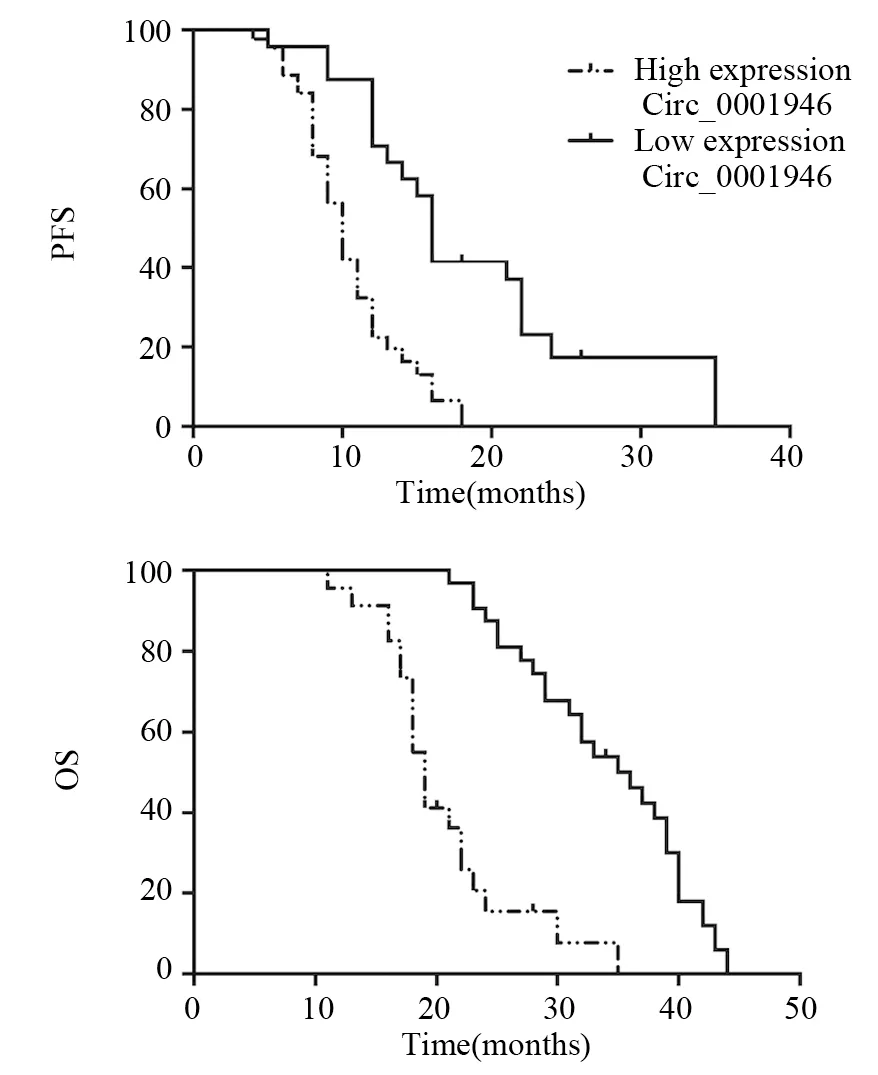
图2 Circ_0001946的表达与胰腺癌患者中位无进展生存时间及总生存时间的关系Figure 2 Relation of Circ_0001946 expression with median progression-free survival(PFS) and overall survival(OS) of pancreatic cancer patients
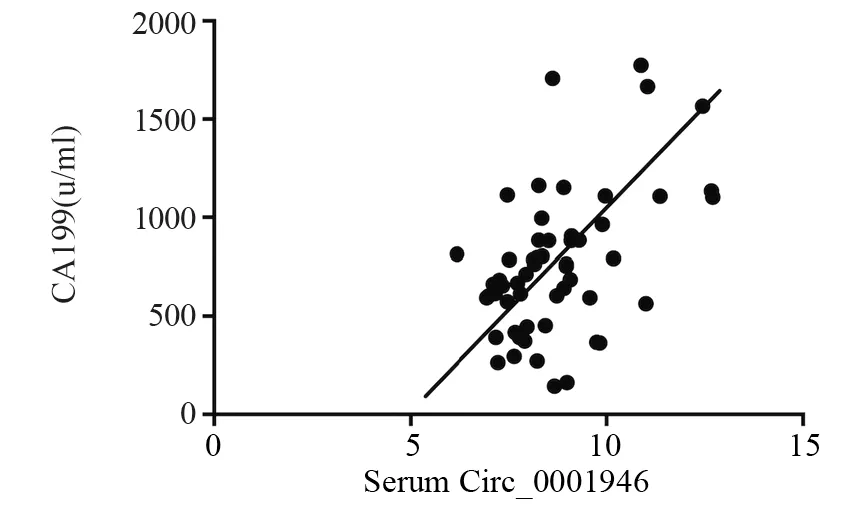
图3 血清Circ_0001946的表达与CA199的相关性Figure 3 Correlation between Circ_0001946 expression and CA199 in serum of pancreatic cancer patients
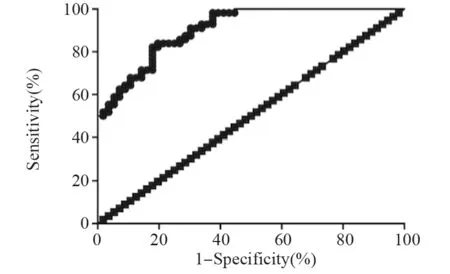
图4 ROC曲线分析血清Circ_0001946诊断胰腺癌的生物效能Figure 4 ROC curve analysis of biological potential of serum Circ_0001946 in diagnosis of pancreatic cancer
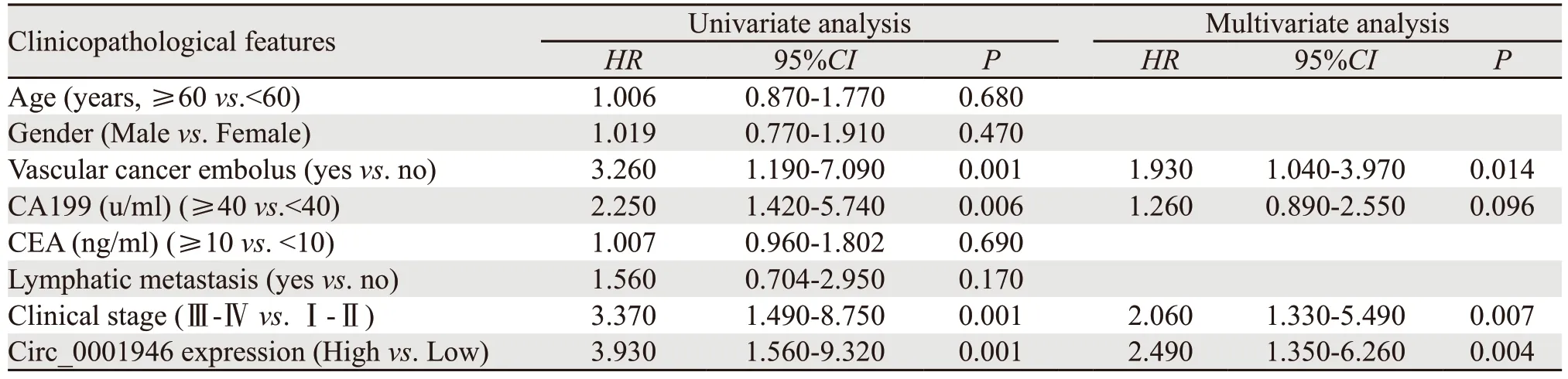
表2 Cox比例风险模型分析影响胰腺癌患者OS的临床病理因素Table 2 Univariate and multivariate analyses of clinicopathological features for OS of pancreatic carcinoma patients
环状RNA(circRNA)是一种不同于线性RNA的新型RNA,由于其表达具有组织特异性,表达量较大,在组织或体液中稳定存在,使circRNA成为较理想的疾病早期诊断和预后评估生物标志物[8]。研究发现环状RNA ciRS-7通过调控mir-7介导的EGFR/STAT3信号通路,促进胰腺癌的增殖和转移[9]。环状RNA circ_0030235高表达是胰腺导管腺癌的不良预后的预测因素,并通过海绵miR-1253和miR-1294促进细胞的进展[10]。circZMYM2与miR-335-5p竞争性结合,调控胰腺癌中的JMJD2C的表达,促进胰腺癌的进展[11]。环状RNA circRHOT1的上调可促进胰腺癌细胞增殖和侵袭[12]。环状RNA circ_0007534通过海绵吸附miR-625和miR-892b调控胰腺癌细胞增殖、凋亡和侵袭,是胰腺导管腺癌预后不良的影响因素[13]。环状RNA PDE8A通过miR-338/MACC1/MET通路促进胰腺癌的侵袭性生长[14]。通过激活miR-874-3p和抑制PLK1表达,从而下调环状RNA hsa_circ_0000977的表达,抑制胰腺导管腺癌的进展[15]。
本研究结果发现Circ_0001946在胰腺癌患者组织和血清中高表达;高表达Circ_0001946的患者总生存时间及无进展生存时间均较低表达者明显缩短;血清Circ_0001946作为诊断胰腺癌血清标志物的曲线下面积为0.805(95%CI:0.754~0.927)。Cox比例风险模型分析提示,Circ_0001946表达是胰腺癌患者预后的独立影响因素。以上研究结果提示Circ_0001946在胰腺癌患者组织中高表达,与患者的预后相关,可能是潜在的胰腺癌患者预后标志物和治疗靶点。
