SUMO特异性蛋白酶在原发性肝癌中的表达及意义*
2020-02-27孙雅静张立东张春艳刘晓智姜忠敏
孙雅静,张立东,张春艳,刘晓智,姜忠敏
天津市第五中心医院病理科(天津 300450)
肝细胞癌是严重威胁人类健康的恶性肿瘤之一。我国肝癌患病率位居世界第一,且每年仍有逐渐增加的趋势。手术及放化疗效果均不尽人意,病死率高,预后极差。随着分子生物学的发展及靶向治疗在肿瘤治疗中的应用,研究肝细胞癌发生、发展的分子机制及寻找相对应的有效的治疗靶点势在必行。蛋白质的翻译后修饰影响着蛋白质的正常生物学功能,调控着个体的生长发育和衰老,并与肿瘤的产生,发展、预后和治疗密切相关[1-2]。蛋白质的翻译后修饰包括甲基化、磷酸化和苏酰化等,SUMO化是蛋白质翻译后修饰的一种,通过对底物蛋白质上数个氨基酸残基进行共价修饰而改变其活性、稳定性及胞内定位,参与调控各种细胞过程。SUMO化与去SUMO化的动态平衡一旦被打破,将导致肿瘤的发生。SUMO化过程由E1、E2和E3酶催化,去SUMO化则由SUMO特异性蛋白酶(SENPs)来完成。SENPs是SUMO特异性蛋白酶,可以切断SUMO化过程中SUMO分子与靶蛋白形成的异肽键,将SUMO重新游离,再次参与到SUMO化过程。SENPs表达异常将导致SUMO的水平异常,从而促使肿瘤的发生[3]。关于SENPs在肝细胞癌中的表达,仅有个别报道,且报道的均为其中一种SENPs成员的表达情况。2018年3—8月,本实验选用免疫组化染色方法检测肝细胞癌和正常肝组织芯片中全部SENPs成员的表达情况,并分析其表达与肝细胞癌临床病理参数的关系,旨在探讨其在肝细胞癌发生、发展中的作用。
1 材料与方法
1.1 材料 组织芯片购自西安艾丽娜生物科技有限公司。包含肝细胞癌40例(肝细胞癌组)及正常肝组织30例(对照组)。其中肝细胞癌组男31例,女9例;>60岁8例,≤60岁32例,中位年龄48岁;肿瘤最大径≤3.5 cm 22例,>3.5 cm 18例;组织学分级1级5例,2级25例,3级10例;埃德蒙森分级低级别(Ⅰ和Ⅱ级)15例,高级别(Ⅲ和Ⅳ级)25例。其中对照组男14例,女16例;>60岁12例,≤60岁18例,中位年龄51.5岁。
1.2 方法 采用免疫组化染色SP法,步骤按试剂盒说明书操作。分别检测肝细胞癌组和对照组SENP1、2、3、5、6、7蛋白的表达情况。用已知阳性片 和PBS代替一抗分别作为阳性及阴性对照。
1.3 结果判断 SENPs 蛋白表达为胞核或胞浆内出现棕黄色颗粒。阳性结果判断采用两种计分结合的方法:(1)选染色均匀肿瘤区10个高倍视野,以阳性细胞所占的百分比计分(0~3分):切片中无阳性细胞记0分;阳性细胞率<25%记1分;阳性细胞率25%~50%记2分;阳性细胞率 >50% 记3分。(2)按染色强度来分(0~3分):不着色0分;黄色1分;棕黄色2分;黄褐色3分。(1)和(2)两项评分相加,0~1分为阴性(-),2分为弱阳性(+),3~4分为阳性(++),5~6分为强阳性 (+++)。
1.4 统计学方法 应用SPSS 21.0统计软件,计数资料采用2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 SENPs在肝细胞癌组和对照组中的表达 SENP1在正常肝组织的细胞核或胞浆表达;SENP2在正常肝组织的细胞浆中椒盐样表达;SENP3在肝细胞癌的细胞核或胞浆表达;SENP5在肝细胞癌的细胞浆中表达;SENP6在正常肝组织的细胞浆中表达;SENP7在肝细胞癌的细胞核中表达,见图1~6。经统计学分析SENP1、SENP2、SENP3蛋白阳性表达在两组间的差异有统计学意义(P<0.05),肝细胞癌组SENP1、SENP2、SENP3蛋白阳性表达率低于对照组。其他SENP蛋白表达两组之间差异无统计学意义(P>0.05)。见表1。

图1 SENP1在正常肝组织中的表达(SP,×200)

图2 SENP2在正常肝组织中的表达(SP,×400)
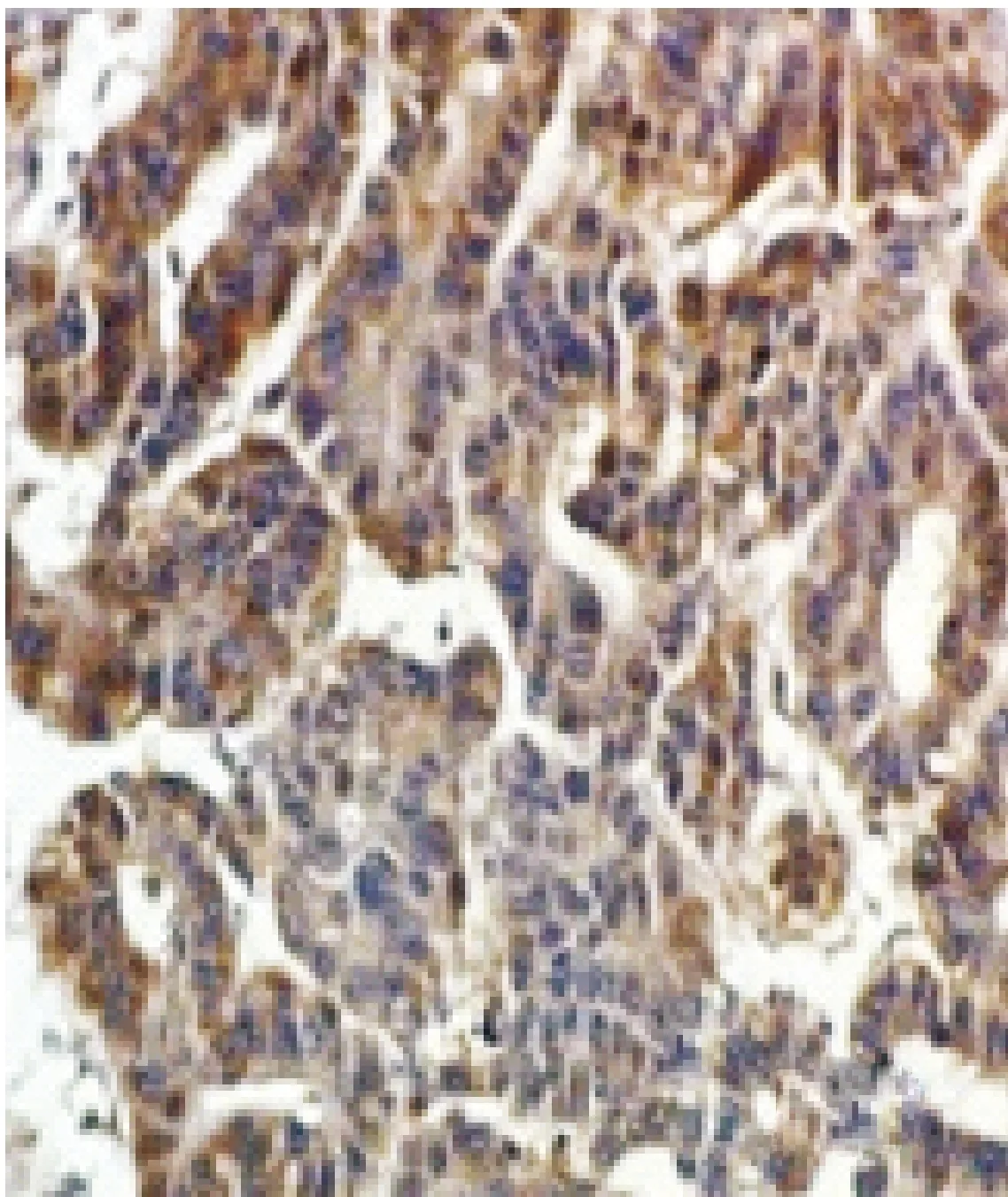
图3 SENP3在肝细胞癌中的表达(SP,×200)
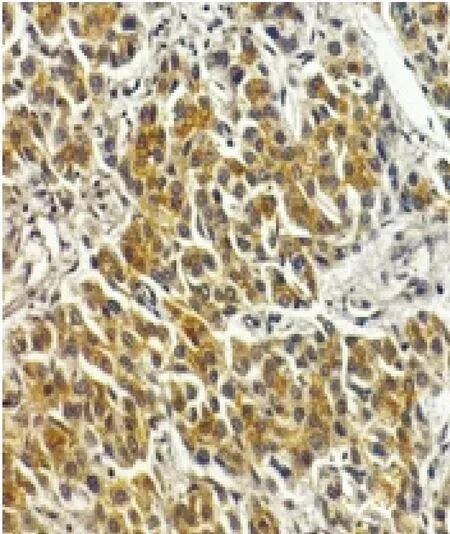
图4 SENP5在肝细胞癌中的表达(SP,×200)

图5 SENP6在正常肝组织中的表达(SP,×200)
2.2 肝细胞癌组SENPs蛋白阳性表达与患者临床病理参数的关系 SENP6在低级别和高级别(埃德蒙森分级)肝细胞癌中的表达率分别为7/15(46.7%)和21/25(84.0%),两者比较差异有统计学意义(P<0.05),随着级别的增高而增加。SENP7表达在低级别和高级别(埃德蒙森分级)肝细胞癌中的表达率分别为11/15(73.3%)和24/25(96.0%),两者比较差异有统计学意义(P<0.05),随着级别的增高而增加。SENP6、SENP7表达与患者性别、年龄、肿瘤大小和组织学分级均无关(P>0.05)。SENP1、SENP2、SENP3、SENP5表达在肝细胞癌患者不同性别、年龄、肿瘤大小、组织学分级和埃德蒙森分级组间比较差异均无统计学意义(P>0.05)。见表2。
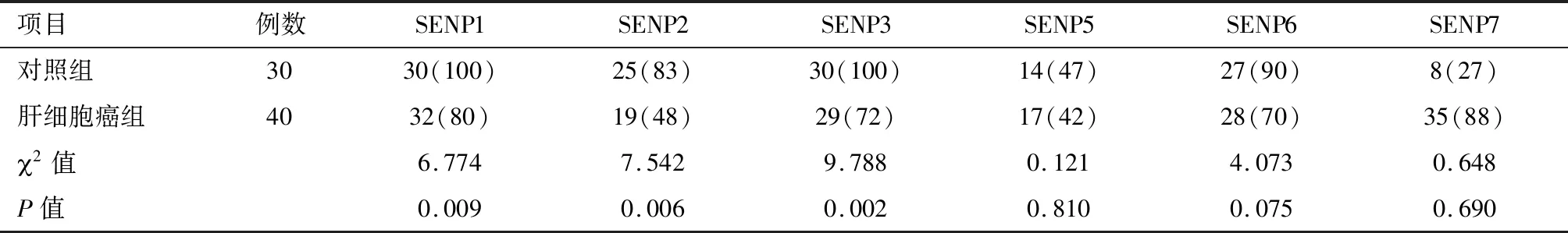
表1 SENPs在肝细胞癌组及对照组中的表达 例(%)
3 讨论
原发性肝细胞癌是最常见恶性肿瘤的之一,预后极差。很大原因是手术难以根治性切除,残留的肿瘤细胞对放化疗不敏感或耐药。因此,研究肝细胞癌的发病机制、疾病演进的过程,寻找治疗相关的靶点已成为目前研究的热点。
SUMO是一种类泛素的小蛋白,存在于大多数真核生物中。与泛素结构相似,但功能迥异。SUMO化是蛋白质翻译后修饰的一种,包含SUMO化和去SUMO化两个过程、是一个闭合的循环通路。这个动态平衡被打破,就会导致蛋白质功能的紊乱,并可能引起肿瘤的产生。
人类去SUMO化蛋白酶——SENPs,包含SENP1、SENP2、SENP3、SENP5、SENP6、SENP7共6种,在这个循环通路中起着关键作用,一是催化SUMO前体变成活性形式,二是切断SUMO分子与靶蛋白形成的异肽键,实现去SUMO化。SENP通过参与调控细胞周期、细胞增殖、氧化应激信号或者肿瘤基因的融合导致肿瘤的形成[2]。SENP家族成员的作用各不相同,扮演了不同的角色。
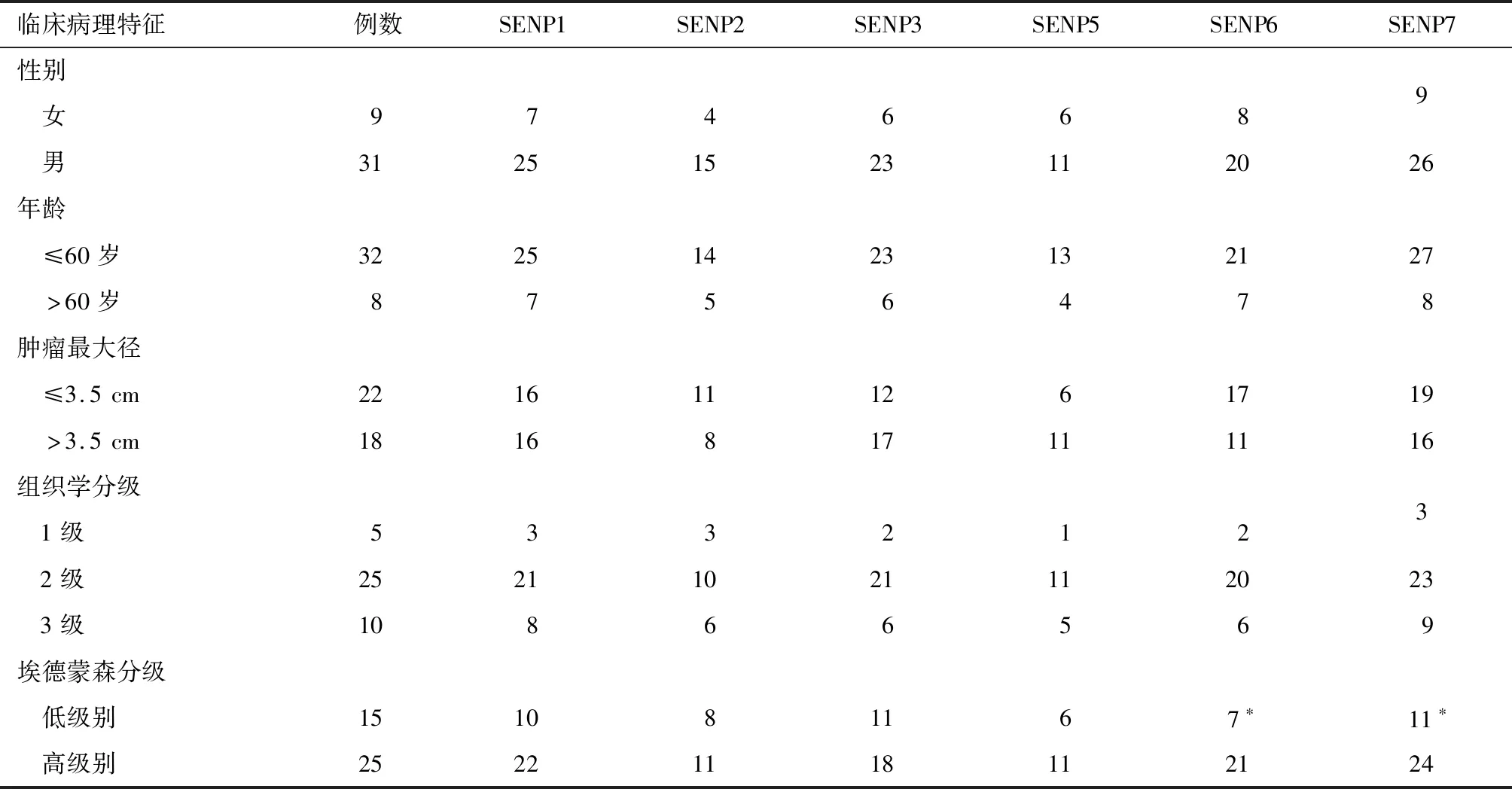
表2 SENPs表达与肝细胞癌临床病理的关系 例
注:*与高级别比较P<0.05
SENP1是一种细胞核蛋白,能催化SUMO1、SUMO2、SUMO3修饰的靶蛋白发生去SUMO化。研究表明,胰腺癌组织中SENP1过表达,与患者病理分期、血管侵犯有关,基因敲除后,胰腺癌细胞的增殖、迁移和侵袭均受到抑制[4-5]。在胶质细胞瘤中,SENP1表达量与肿瘤分级正相关[6]。在三阴性乳腺癌中SENP1高表达,与Her-2表达缺失有关。另外,在前列腺癌、甲状腺嗜酸细胞瘤等都发现了SENP1的高表达[7-9]。SENP2是一种核膜相连的蛋白酶。研究表明膀胱癌中SENP2表达减少,SENP2通过促进TBL1/TBLR1去SUMO化,从而抑制细胞外基质的降解,进而抑制癌细胞的转移,同时可以使转移生长因子β受体1(TGF-βR1)去SUMO化,抑制EMT[10-11]。骨肉瘤组织中SENP2表达含量明显下调,其异位表达可以抑制骨肉瘤的增殖、迁移和侵袭。另外,在肝癌、胃癌等肿瘤中SENP2表达含量也明显下调。本研究结果显示与正常肝组织比较,肝细胞癌中SENP2表达显著降低。SENP3和SENP5同源性较高,底物特异性也相似[12-14]。氧化应激状态时,SENP3含量快速增加,通过对底物蛋白去SUMO化,使细胞适应应激,同时使一些抑癌基因的抑癌功能丧失,促进细胞的无限增殖和肿瘤的发生。研究表明在前列腺癌、胃癌、肺癌、口腔鳞癌、卵巢癌中SENP3表达量较正常组织增加,在卵巢癌中其含量与肿瘤分级和淋巴结转移呈正相关。另有研究表明SENP5在肝癌和骨肉瘤细胞中表达增高[15-17]。SENP6、 SENP 7均定位于核质,对SUMO2、SUMO3具有优先的蛋白水解活性,相关研究较少。有研究显示SENP6在肝癌和胃癌中高表达,与肝细胞癌的放疗耐药有关[18-20]。SENP7作为SUMO2、SUMO3的特异性蛋白酶,参与调控染色质稳态和DNA的损伤修复。在正常细胞内高表达,当其低表达时,影响胚胎发育,并可激活c-Myc癌基因、cyclinD1,使细胞发生恶性转化[21]。
本研究结果显示,与正常肝组织比较,肝细胞癌中SENP1、SENP2和SENP3表达率显著降低,提示三者可能在原发性肝细胞癌发生过程中发挥关键作用。SENP6、SENP7蛋白随着肝细胞癌级别的升高表达显著增加,提示SENP6、SENP7蛋白可能在肝细胞癌演进过程中发挥重要作用。此研究结果为原发性肝细胞癌靶向治疗提供了新的潜在研究靶点。
