软糖类产品中虾青素的检测及稳定性研究
2020-02-27孔庆龙荆雯张晓南余汪平游燕
孔庆龙,荆雯,张晓南,余汪平,游燕*
1(云南省药物研究所, 云南 昆明, 650111) 2(云南白药集团创新研发中心, 云南 昆明,650111)3(云南省中药和民族药新药创制企业重点实验室, 云南 昆明,650111) 4(昆明理工大学, 云南 昆明,650500)
虾青素(astaxanthin)是一种重要的红色脂溶性类胡萝卜素,具有高效的生物学活性,是目前发现的最强的天然抗氧化剂之一,已有大量研究表明它能发挥强大的抗氧化作用,不仅可以有效地提高机体免疫力、增强细胞的再生能力、抗衰除皱、防晒美白、抑制肿瘤、治疗心血管疾病、预防过度训练引发的骨骼肌及脏器损伤,还是目前唯一能够通过血脑屏障、将各种抗氧化有益成分直接传送到大脑和中枢神经系统的一种非维生素A源性的天然类胡萝卜素,具有治疗眼疾、保护神经系统的功能[1-21]。因此虾青素在普通食品、保健食品、医药行业及化妆品行业均有广泛的应用。虾青素广泛地分布在海洋的细菌、藻类、甲壳类和鱼类中等,雨生红球藻(Haematococcuspluvialis)是天然虾青素含量最高的生物,其中虾青素的含量可高达细胞干重的1%~3%,被公认为自然界中天然虾青素最好的生物来源[22-25],同时是FDA唯一批准可用于保健及医疗行业的天然虾青素来源,也是我国批准的可用于食品行业的新资源食品。
雨生红球藻虽然被批准用于食品生产,但因其中虾青素的低水溶性和化学不稳定性等性质,使其不能满足某些特殊需求,导致目前市场上虾青素产品剂型不够丰富,难以满足多元化应用的需求。已经有研究指出,通过微囊包裹的方法,将雨生红球藻制成微囊粉,可以提高虾青素稳定性,并改善加工性能[26-31],但目前并没有针对雨生红球藻微囊粉在实际生产加工中的应用及其最终产品虾青素含量的研究。本文通过对比使用雨生红球藻粉和雨生红球藻微囊粉2种原料制成的糖果中虾青素在不同温度、光照、氧气条件下的含量,来研究雨生红球藻微囊粉中虾青素的加工稳定性问题,期望为雨生红球藻微囊粉在工业生产中的应用提供依据。
目前法定标准中没有针对软糖中的虾青素含量的测定方法,为保证检测结果可靠,根据GB/T 31520-2015《红球藻中虾青素的测定液相色谱法》制订了产品中虾青素的含量测定方法,并进行了方法适应性研究,以此方法对产品中虾青素含量进行检测对比。
1 材料与方法
1.1 材料与仪器
1.1.1 材料
雨生红球藻粉(虾青素含量为3%,以下简称藻粉)、雨生红球藻微囊粉(虾青素含量≥2.5%,以下简称微囊粉),云南艾尔发;全反式虾青素对照品(批号:160619001,纯度100%),江莱生物科技有限公司;13-顺虾青素对照品(批号:BCBQ2118,纯度≥90.0%),SIGMA;9-顺虾青素对照品(批号:BCBQ2518V,纯度≥90.0%),SIGMA。所用流动相水为超纯水,叔丁基甲基醚、甲醇为色谱纯,处理样品的磷酸、NaOH为优级纯,甲醇、二氯甲烷、丙酮、2,6-二叔丁基对甲酚为分析纯。
雨生红球藻软糖样品,晋江奇峰食品有限公司,为中试样品,包装形式为铝复袋独立包装,藻粉及微囊粉添加量均为1%。
1.1.2 仪器
Agilent 1100t型高效液相色谱仪,美国安捷伦科技有限公司;SK3200LH型超声波清洗仪,上海科导超声仪器有限公司;AG285型电子天平,梅特勒-托利多公司;Advantage A10型Milli-Q纯水机,德国Merck公司;LHS-500HC-Ⅰ恒温恒湿箱,上海一恒。
1.2 虾青素含量测定方法的建立
1.2.1 色谱条件选择
参照GB/T 31520—2015《红球藻中虾青素的测定液相色谱法》,选择C30色谱柱:YMC Caratenoid(5 μm,4.6×250 mm)。以甲醇为流动相A,以叔丁基甲基醚为流动相B,以体积分数1%磷酸溶液为流动相C,按表1进行梯度洗脱。柱温25 ℃;流速为1.0 mL/min;进样量为10 μL。

表1 梯度洗脱表Table 1 Gradient elution
1.2.2 检测波长的选择
对全反式虾青素对照品溶液进行全波长扫描,如图1所示,全反式虾青素在波长475 nm有一个最大吸收峰,因此选择在此波长进样测定。
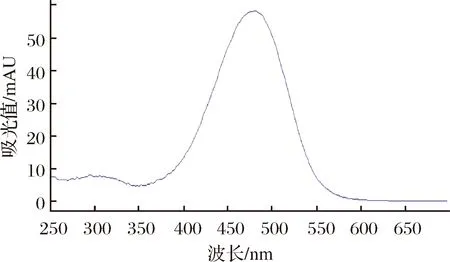
图1 全反式虾青素全波长扫描图Fig.1 Total trans-astaxanthin full wavelength scan
1.2.3 标准溶液制备
全反式虾青素标准储备液:精密称取全反式虾青素标准品36.7 mg,于500 mL容量瓶中加入丙酮溶解,定容。充氮密封,置-18 ℃的冰箱中避光保存,有效期1个月。
13-顺虾青素标准储备液:称取13-顺虾青素标准品约1 mg于50 mL容量瓶中,加入丙酮溶解,定容。充氮密封,置-18 ℃的冰箱中避光保存,有效期1个月。
9-顺虾青素标准储备液:称取9-顺虾青素标准品约1 mg于50 mL容量瓶中,加入丙酮溶解,定容。充氮密封,置-18 ℃的冰箱中避光保存,有效期1个月。
混合标准品液:取全反式虾青素标准储备液2 mL,13-顺虾青素标准储备液0.5 mL,9-顺虾青素标准储备液0.5 mL于同一个10 mL容量瓶中加入丙酮溶解,定容。-18 ℃的冰箱中避光保存。此溶液只用于定性。
全反式虾青素工作液:取全反式虾青素标准储备液1 mL于10 mL容量瓶中加入丙酮溶解,定容。临用现配。
1.2.4 样品制备
参照GB/T 31520—2015《红球藻中虾青素的测定液相色谱法》,并根据产品特性,对虾青素的提取和供试品溶液的保存方法进行了调整。
藻粉及微囊粉中虾青素提取:分别称取藻粉和微囊粉样品0.5 g,分5次加入二氯甲烷-甲醇(体积比25∶75)液,每次10 mL,提取出虾青素。提取液合并于50 mL容量瓶中,定容,待用。
软糖中虾青素提取:称取软糖样品约10 g,加水5 mL搅碎呈匀浆状,分5次加入二氯甲烷-甲醇(体积比25∶75)液,每次10 mL,提取出虾青素。提取液合并于50 mL容量瓶中,定容,待用。
皂化:准确移取提取液5 mL,于离心管中加入新配的0.1 mol/L的NaOH甲醇溶液1.0 mL,混匀,充氮气,密封,在5 ℃冰箱中避光反应过夜(12 h以上),再加入体积分数1%磷酸甲醇溶液0.5 mL中和剩余的碱,混匀,在氮气吹扫下定容至5 mL,用0.45 μm滤膜过滤,滤液作为供试品溶液。上述供试品溶液进样前须保存在-18 ℃的冰箱冷冻室内,并于进样前15~20 min取出,进行HPLC分析。
由于皂化后供试品溶液在常温中极易发生成分改变,形成众多杂质峰,因此规定供试品溶液进样前须保存在-18 ℃的冰箱冷冻室内,并于进样前15~20 min取出。各条件下色谱图如图2所示。
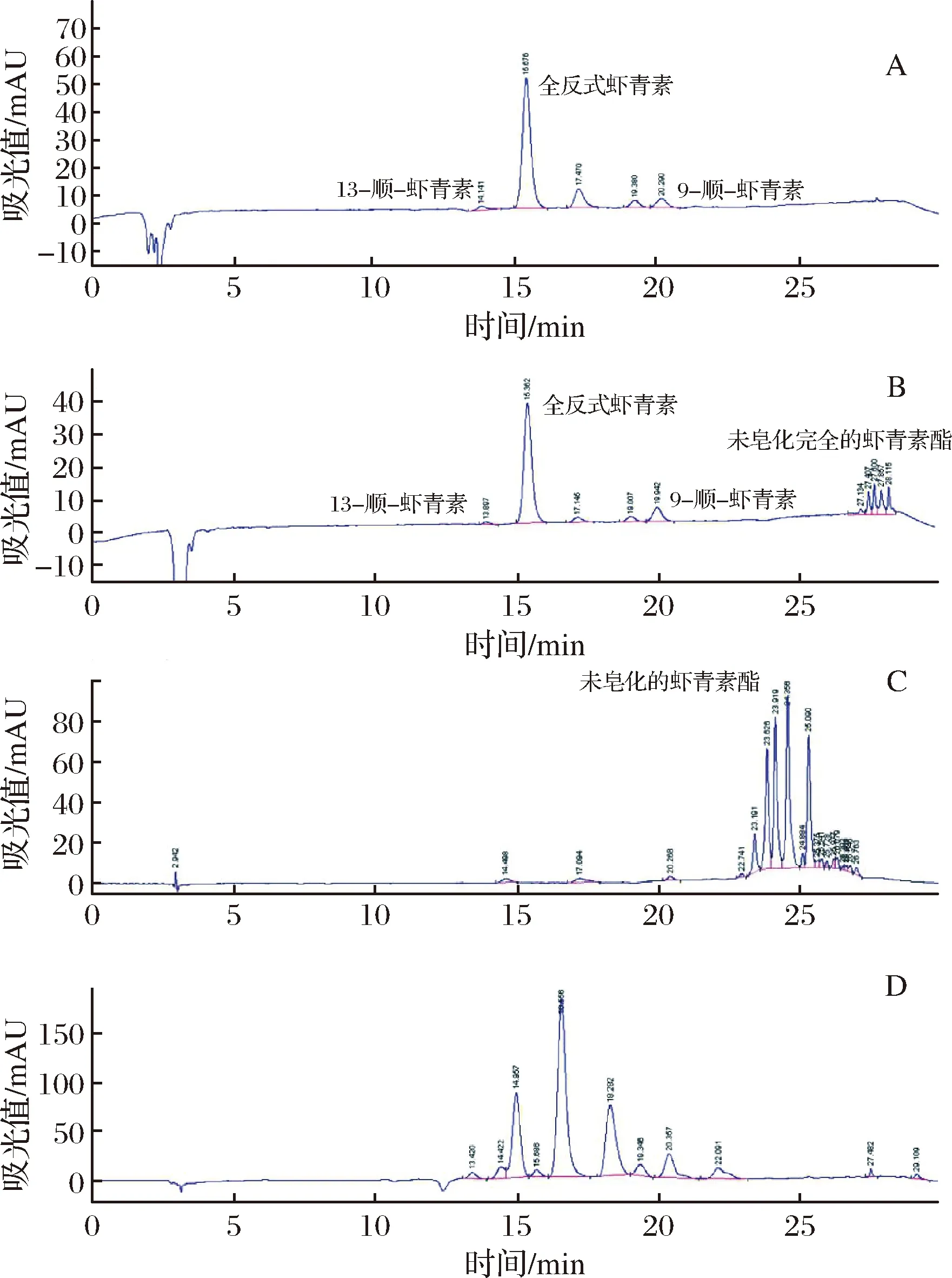
A-完全皂化供试品溶液(加入1.0 mL碱液);B-未完全皂化供试品溶液(加入0.7 mL碱液)C-未皂化供试品溶液;D-室温25 ℃放置5 h后供试品溶液图2 虾青素不同前处理条件色谱图Fig.2 Chromatogram of astaxanthin under differentpretreatment conditions
1.2.5 系统适应性试验
按上述色谱条件分别进样混合标准品溶液、供试品溶液、空白样品液各10 μL,柱温25 ℃。
1.2.6 线性关系考察
精密量取全反式虾青素标准储备液(质量浓度73.4 μg/mL)0.15、0.45、0.9、1.8、9 mL,置10 mL容量瓶中,加二氯甲烷-甲醇稀释至刻度,摇匀,按选定色谱条件进样,进样量10 μL,记录峰面积。
1.2.7 加样回收试验
全反式虾青素对照品液:精密称取全反式虾青素标准品41.2 mg于100 mL容量瓶中,加入丙酮溶解,定容。于-18 ℃的冰箱中避光保存。9-顺虾青素和13-顺虾青素为其标准储备液。
精密称取同一批号微囊粉软糖供试品9份,已测含虾青素0.167 2 mg/g,每份约10.35 g,分别加入以上全反式虾青素对照品液5 mL,9-顺虾青素和13-顺虾青素的标准储备液0.5 mL共3份;全反式虾青素对照品液10 mL,9-顺虾青素和13-顺虾青素的标准储备液1.0 mL共3份;全反式虾青素对照品液15 mL,9-顺虾青素和13-顺虾青素的标准储备液1.5 mL共3份。按供试品溶液处理方法同法处理,按照含量测定方法依法测定,记录峰面积,按GB/T31520—2015《红球藻中虾青素的测定液相色谱法》所载公式计算总峰面积,并按标准曲线计算虾青素含量。
1.2.8 重复性试验
精密称取同一批号的微囊粉软糖样品6份,按供试品溶液制备方法制备,按照含量测定方法依法测定,记录峰面积,按GB/T 31520—2015《红球藻中虾青素的测定液相色谱法》所载公式计算总峰面积,并按标准曲线计算虾青素含量。
1.3 产品稳定性试验
1.3.1 光照稳定性
将用藻粉和微囊粉制备的软糖样品分为2组,一组用透明袋包装,另一组用铝复袋包装,于温度20 ℃、湿度75%、光照强度6 000 lx条件下存放3个月,每隔30天取样检测。
1.3.2 热稳定性
将用藻粉和微囊粉制备的软糖样品用铝复袋包装,于温度40 ℃、湿度75%、避光条件下存放3个月,每隔30天取样检测。
1.3.3 氧气环境稳定性
将用藻粉和微囊粉制备的软糖样品分别分为2组,一组用铝复袋真空包装,另一组用铝复袋正常包装,于温度20 ℃、湿度75%、避光条件下存放3个月,每隔30天取样检测。
2 结果与分析
2.1 虾青素含量测定方法建立
2.1.1 系统适应性试验
由图2可以看出,供试品溶液色谱与标准品溶液色谱在全反式虾青素、13-顺虾青素及9-顺虾青素相应的位置上均有相同的色谱峰出现。样品空白溶液在全反式虾青素、13-顺虾青素及9-顺虾青素色谱峰对应位置上均无色谱峰,表明溶液中其他成分对样品的含量测定无干扰。
供试品色谱图中,理论板数达到5 000时,全反式虾青素、13-顺虾青素及9-顺虾青素的峰与前后色谱峰分离完全,被测成分色谱峰与其它相邻色谱峰分离度能达到要求。

A-混合对照品溶液;B-供试品溶液;C-全反式虾青素工作液;D-样品空白溶液图3 系统适应性图Fig.3 System adaptability
2.1.2 线性关系
如表2所示,在上述色谱条件下,全反式虾青素在0.011 0~0.660 6 μg范围内呈良好的线性关系,检测方法适用于虾青素检测。以含量(x)对峰面积(y)进行线性回归,得全反式虾青素回归方程:y=8 657.3x+33.397,相关系数r=0.999 9。
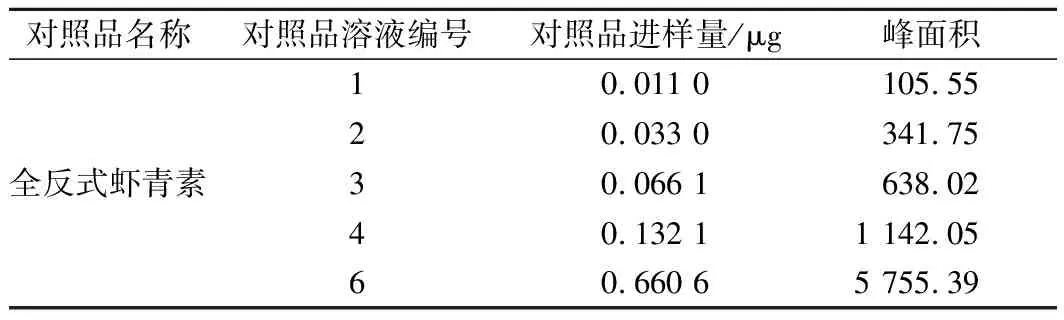
表2 线性关系测定结果Table 2 Linear relationship determination results
2.1.3 加样回收试验
如表3所示,总回收率平均值为100.64%,相对标准偏差(standard relative deviation, RSD)为2.25%,所用样品为微囊软糖。
2.1.4 重复性试验
计算得RSD小于2%,结果表明本法具有良好的重复性,见表4。所用样品为微囊粉软糖。

表3 加样回收率试验Table 3 Recovery of added samples test
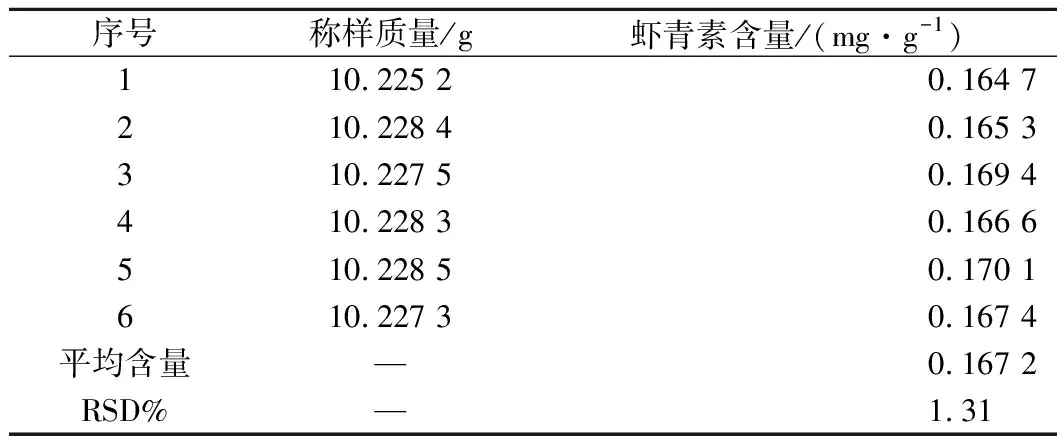
表4 重复性试验Table 4 Repeatability test
2.2 稳定性试验结果
因原料在储存过程中可能有虾青素损失,故对原料进行含量测定,结果如表5。
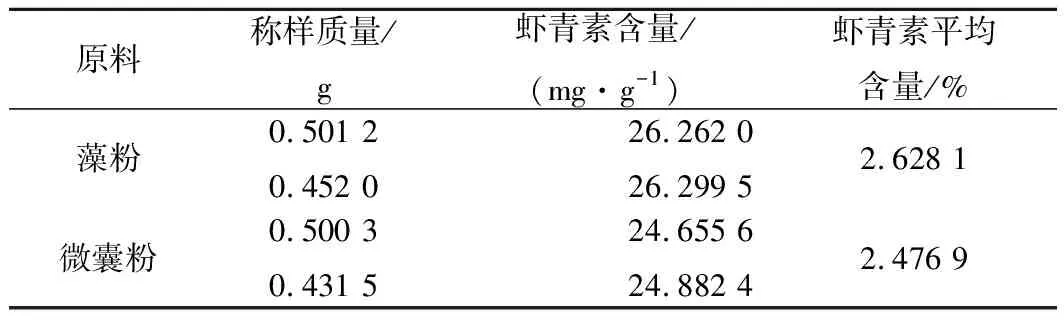
表5 原料虾青素含量表Table 5 Astaxanthin content in raw materials
测量结果与标示含量相比,原料由生产到使用中均有一定的损失。
2.2.1 光照稳定性
根据图4和图5的结果,在光照条件下,不论是采用藻粉还是微囊粉制备的软糖其虾青素保留率均有明显的下降,经过3个月存放虾青素减少量为7.5%和30.26%,最终保留率为1.02%和37.57%;而避光存放的样品虽然同样有下降现象,但经过3个月存放虾青素减少量为6.89%和12.68%,其减少量明显小于光照条件,最终保留率为1.82%和55.02%,以上结果说明在试验周期中,虾青素受光照的影响导致降解,这与虾青素本身在强光环境下稳定性极差的性质相符,由此可推断光照是引起虾青素分解的主要原因之一。同时我们可以看出,以微囊粉为原料的软糖其虾青素保留率明显好于以藻粉为原料制备的软糖,表面微囊粉囊壁可以对光照产生一定的隔离作用,能够很好的提高虾青素在光照条件下的稳定性,因此在实际应用中建议采用微囊粉为原料从而提高产品中虾青素含量,同时采用避光包装来保证产品中的虾青素稳定性。
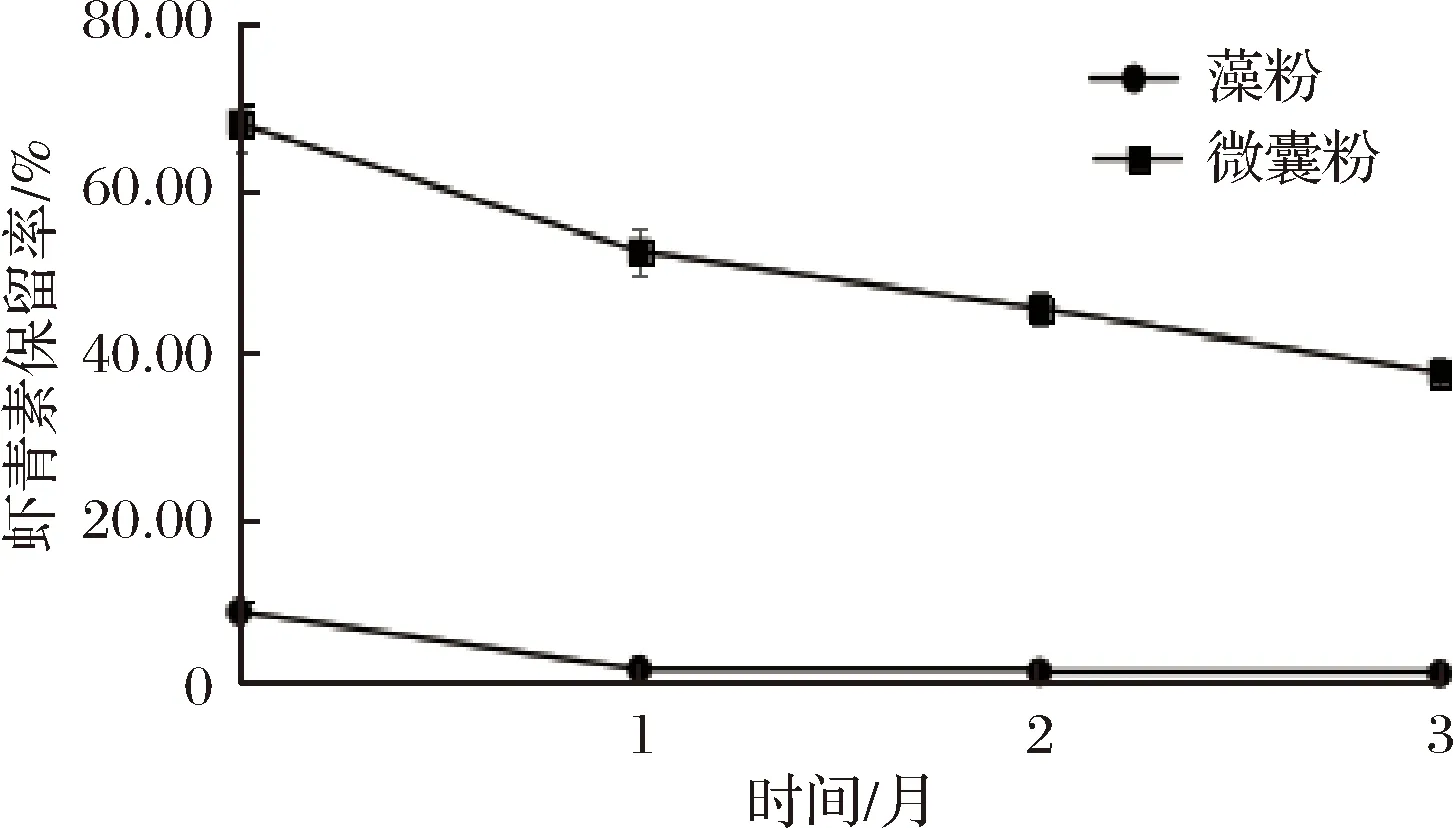
图4 光照条件下保留率Fig.4 The retention rate of illumination condition
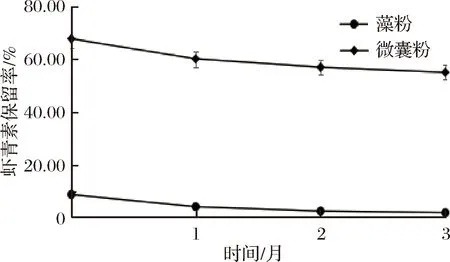
图5 避光条件下保留率Fig.5 The retention rate of darkness condition
2.2.2 热稳定性
由图6可以看出,在高温环境下不论是藻粉还是微囊粉制备的软糖其虾青素保留率均有明显的下降,经过3个月存放虾青素减少量为7.21%和35.8%,最终保留率为1.48%和31.95%,但微囊粉的稳定性依然好于藻粉,由结果可以看出,虾青素属于热敏感性物质,高温能导致其快速分解,与其热不稳定的性质相符,同时可以看出微囊壁能够对包裹在内的虾青素起到一定的保护作用。因此在实际生产中依然建议使用微囊粉为原料。可以看出在软糖类产品中,温度对虾青素保留率的影响要高于光照的影响,其原因可能是因为构成软糖的胶体能够阻挡部分光线对虾青素的影响,但胶体本身就对热的阻挡效果不佳导致虾青素分解更多。因此,对于软糖类产品建议在低温环境下进行仓储运输,以保证产品中虾青素的稳定性。
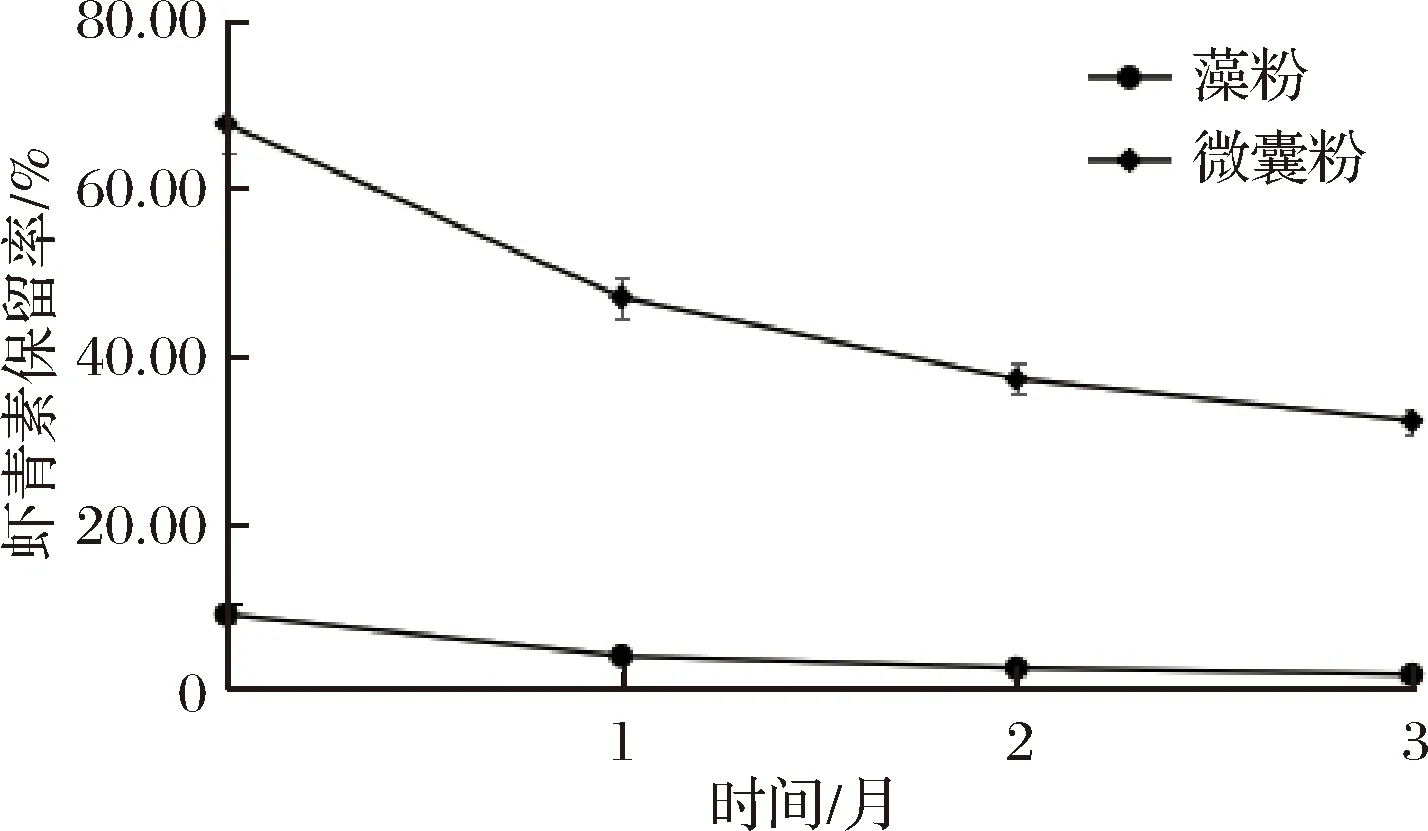
图6 40 ℃条件下保留率Fig.6 The retention rate of 40 ℃ condition
2.2.3 氧气环境稳定性
由图7、8可以看出,在有氧条件下,虾青素的保留率会有所减少,最终保留率为1.82%和55.02%,无氧环境下最终保留率为2.56%和60.68%,与有氧环境进行对比其变化量相差并不很多,其原因可能是因为软糖胶体对虾青素起到了包裹隔氧的作用,加之在软糖加工工程中氧气会被排出,因此在氧气环境对软糖中虾青素含量的影响远没有光照和温度的影响强烈。此外,在实际生产中,真空包装对软糖的形态保持不利,同时会增加生产成本和难度,综合以上因素,建议实际生产中采用微囊粉为原料,在避光、低温环境下保藏软糖产品即可,无需真空包装。
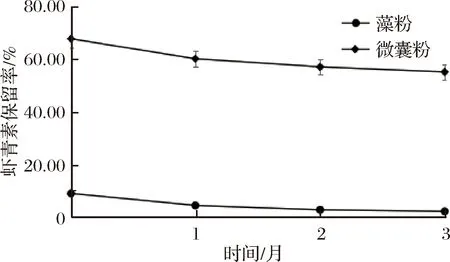
图7 有氧条件下保留率Fig.7 The retention rate of aerobic condition

图8 无氧条件下保留率Fig.8 The retention rate of anaerobic condition
3 结论
由结果可知,在产品完成加工后,其中的虾青素含量对于理论含量均有明显的减少,说明软糖加工工艺对虾青素具有较强的破坏性。且在产品完成生产以后的加速期内,虾青素的含量依然在持续的减少。从试验中可知,对于软糖类产品,温度对虾青素保留率的影响最大,其次是光照,最后是氧气,同时,相对于普通藻粉,微囊粉能够很好的提高虾青素在各种条件下的稳定性,选择微囊粉为原料不仅能够提供很好的最初虾青素含量,还能在后续的货架期内对虾青素提供持续的保护,是一种理想的加工原料。
综上,选择微囊粉为原料,采用避光的包装,同时在低温环境下对产品进行储运能够最大程度的提高产品中虾青素的保留率。
