聚L-瓜氨酸修饰电极电化学测定食品中曲酸
2020-02-29邵东旭马心英信明浩王瑞
邵东旭,马心英,信明浩,王瑞
(菏泽学院 化学化工学院,山东 菏泽,274015)
曲酸(kojic acid)于1907年由斋藤在米曲霉酿造酱油中发现,1912年被命名为曲酸,1924年首次确定曲酸的结构。其化学名称为5-羟基-2-羟甲基-4-吡喃酮, 为无色棱柱状晶体, 易溶于水、醇、丙酮, 微溶于醚、乙酸乙酯、三氯甲烷和吡啶, 不溶于苯[1]。
曲酸产生自微生物的发酵过程,是一种有机酸,常见于豆瓣酱、酒类、醋等酿造食品。由于曲酸具有酪氨酶的抑菌能力和抗氧化性,所以常在食品、药品、化妆品的加工中用作防腐剂、保鲜剂、抗氧化剂等,应用较为广泛[2-5]。曲酸安全性的相关研究也越来越受到研究人员的关注, 对其毒性进行研究表明,长期食用可损害人体甲状腺,甚至引发肿瘤[6-8]。2017年,世界卫生组织国际癌症研究机构已将曲酸列为3类致癌物。
目前检测曲酸成熟的方法主要有气相色谱法[9]、近红外光谱[10]、高效液相色谱法[6,11-13]、超高效液相色谱法[14]、电化学方法[15-16]等。与电化学检测方法相比,其他几种方法样品预处理繁琐,操作步骤复杂,检测环境要求严格,费用高,而氨基酸特有的官能团(如羧基和氨基)聚合在玻碳电极表面后,具有良好的电催化特性,可以改善电极的稳定性和重现性[17-19],因此利用氨基酸修饰电极检测食品中的曲酸有实际意义。笔者制备了L-瓜氨酸修饰电极,研究了曲酸在该电极上的电化学行为,并应用于食品中曲酸含量分析,方法简单、快速,准确度和灵敏度较高。
1 实验部分
1.1 仪器与试剂
CHI660D电化学工作站,上海辰华仪器有限公司;GCE玻碳电极, 上海仪电科学仪器股份有限公司;三电极体系:饱和甘汞电极电极(SCE)为参比电极,铂电极(上海仪电科学仪器股份有限公司)为对电极,聚L-瓜氨酸修饰电极(PLC/GCE,自制)为工作电极;SYZ-550型石英亚沸高纯水蒸馏器,金坛市晶玻实验仪器厂;KH-100DB型超声波清洗器,昆山禾创超声仪器有限公司;ESJ180-4电子天平,沈阳龙腾电子有限公司;85-1型恒温磁力搅拌器,深圳天南海北有限公司;微量进样器,上海高鸽工贸有限公司。
L-瓜氨酸(AR,上海阿拉丁生化科技股份有限公司),配制成标准溶液(1.0×10-3mol/L);曲酸(AR,上海阿拉丁生化科技股份有限公司),配制成标准溶液(1.0×10-3mol/L);PBS缓冲溶液(由磷酸氢二钠和柠檬酸配制而成,AR,天津市科密欧化学试剂有限公司);黄豆酱、味极鲜酱油、陈酿醋,购自超市;实验过程中用水均为二次蒸馏水。
1.2 聚L-瓜氨酸修饰电极的制备
在涂有Al2O3粉末的湿润麂皮上将玻碳电极(GCE)的表面打磨抛光后用二次蒸馏水冲洗干净,依次在超声波清洗器中用硝酸(1∶1,体积比)、无水乙醇、二次蒸馏水充分清洗30 s左右后,用二次蒸馏水冲洗干净。再将打磨好的GCE放入1.0×10-4mol/L的L-瓜氨酸(pH=7.0)溶液中,实验选择循环伏安法(CV)在-1.5~2.3 V电位范围内,以10 mV/s的扫描速率扫描6段,聚合完成后取出电极,用二次蒸馏水淋洗电极表面,即制得PLC/GCE。
1.3 实验方法
将三电极体系置于pH=4.0的PBS缓冲溶液中,在0.0~1.5 V电位范围内,以100 mV/s的扫描速率对一定浓度的曲酸溶液进行(CV)扫描,根据测得曲酸的氧化峰电流(ipa)与其浓度(c)所成的线性关系,实现样品中曲酸的定量分析。
1.4 样品预处理
黄豆酱:称取已在研钵中充分研磨过的黄豆酱9.5 g,加水稀释搅匀后,使用真空抽虑泵抽滤,并用二次水冲洗滤纸上的残渣2遍,将滤液转移至250 mL容量瓶中,定容后放置冰箱中冷藏,即制得黄豆酱样品溶液。取9.00 mL上述溶液,加入0.5 mL 0.03 mol/L EDTA 溶液掩蔽酱油样品中存在的金属离子,用0.5 mL质量分数为1%的Na2SO3还原溶液中的氧化性物质,10 mL pH=4.0的PBS缓冲溶液,制得样品待测液备用。
酱油:将酱油样品用真空抽滤泵抽滤,以过滤不溶性杂质,取0.5 mL酱油样品,加入10 mL pH=4.0的PBS缓冲溶液、0.5 mL 0.03 mol/L EDTA 溶液、0.5 mL质量分数为1%的Na2SO3和9.5 mL H2O,制得待测液。
醋:向1 mL醋中加入3 mL pH=4.0的PBS缓冲溶液、0.25 mL 0.03 mol/L EDTA 溶液、0.25 mL质量分数为1%的Na2SO3和2 mL H2O,制得待测液。
2 结果与讨论
2.1 聚L-瓜氨酸修饰电极的最佳聚合条件
2.1.1L-瓜氨酸溶液pH的选择
在-1.5~2.2 V的扫描电位范围、扫描速度为100 mV/s、扫描段数(n)=10的实验条件下,改变L-瓜氨酸溶液的pH分别为2.2、3.0、4.0、5.0、6.0、7.0、8.0进行聚合实验,分别用不同pH条件下制得的PLC/GCE测定相同浓度曲酸溶液。结果表明,当瓜氨酸溶液pH=7.0时,所制备的修饰电极测定曲酸的氧化峰电流最大,因此选择pH7.0的L-瓜氨酸溶液做为聚合底液。
2.1.2 聚合扫描段数(n)的选择
固定电位范围为-1.5~2.2 V,扫描速度为100 mV/s,L-瓜氨酸溶液pH=7.0,改变聚合扫描段数(n)进行实验。结果表明,当n=6时,所制备的修饰电极测定曲酸的氧化峰电流最大,这是因为随着n的增加氨基酸在电极上形成的膜趋于完整,对曲酸的响应电流逐渐增大;但随着n的持续增加,膜厚增加,电子在膜中阻力变大, 导致响应电流降低[20]。故本论文中n选择6。
2.1.3 聚合扫描速度(v)的选择
L-瓜氨酸在电极表面的聚合反应中,扫描速度会影响膜的平整性、致密性, 直接影响到测定效果[20]。在-1.5~2.2 V的扫描电位、溶液pH=7.0、扫描段数n=6的实验条件下,改变聚合电极时的扫描速率v进行实验,结果表明当v=10 mV/s时,曲酸在所制备的修饰电极上氧化峰电流最大。
2.1.4 聚合扫描电位的选择
在溶液pH=7.0、v=10 mV/s、n=6的条件下,分别改变聚合时的扫描高、低电位以确定电位范围,结果表明当电位范围在-1.5~2.3 V时,所制备的修饰电极对曲酸催化效果最好。
图1为在最佳条件下L-瓜氨酸聚合的伏安曲线,由图1可见,随着扫描段数的增加,氧化峰和还原峰电流增加的幅度减小,聚合结束后可观察到电极表面有深蓝色的膜存在。

图1 L-瓜氨酸在玻碳电极上聚合伏安曲线Fig.1 The voltammetry curve of L-citrulline polymeri-zation on glassy carbon electrode
2.2 曲酸在PLC/GCE上的电化学行为
利用PLC/GCE分别测定了空白溶液、曲酸溶液的CV行为以及GCE测定了曲酸溶液的CV图,所得循环伏安曲线如图2所示。可见PLC/GCE在空白溶液无峰电流响应(图2-a),说明空白溶液组分对测定无干扰,且聚L-瓜氨酸在空白溶液中不产生氧化还原峰;使用GCE对曲酸溶液进行测定时的ipa=1.67 μA,氧化峰电位(Epa)=1.08 V(图2-b);而PLC/GCE对同一浓度曲酸溶液进行测定时ipa=18.98 μA,Epa=1.07 V(图2-c),此时ipa较使用GCE时增加了约11倍,而且峰电位略微负移,说明聚合在电极表面的聚L-瓜氨酸膜对曲酸的氧化具有电催化作用。此外曲酸在反应过程中只产生1个氧化峰,说明曲酸在修饰电极上的反应是一不可逆过程。
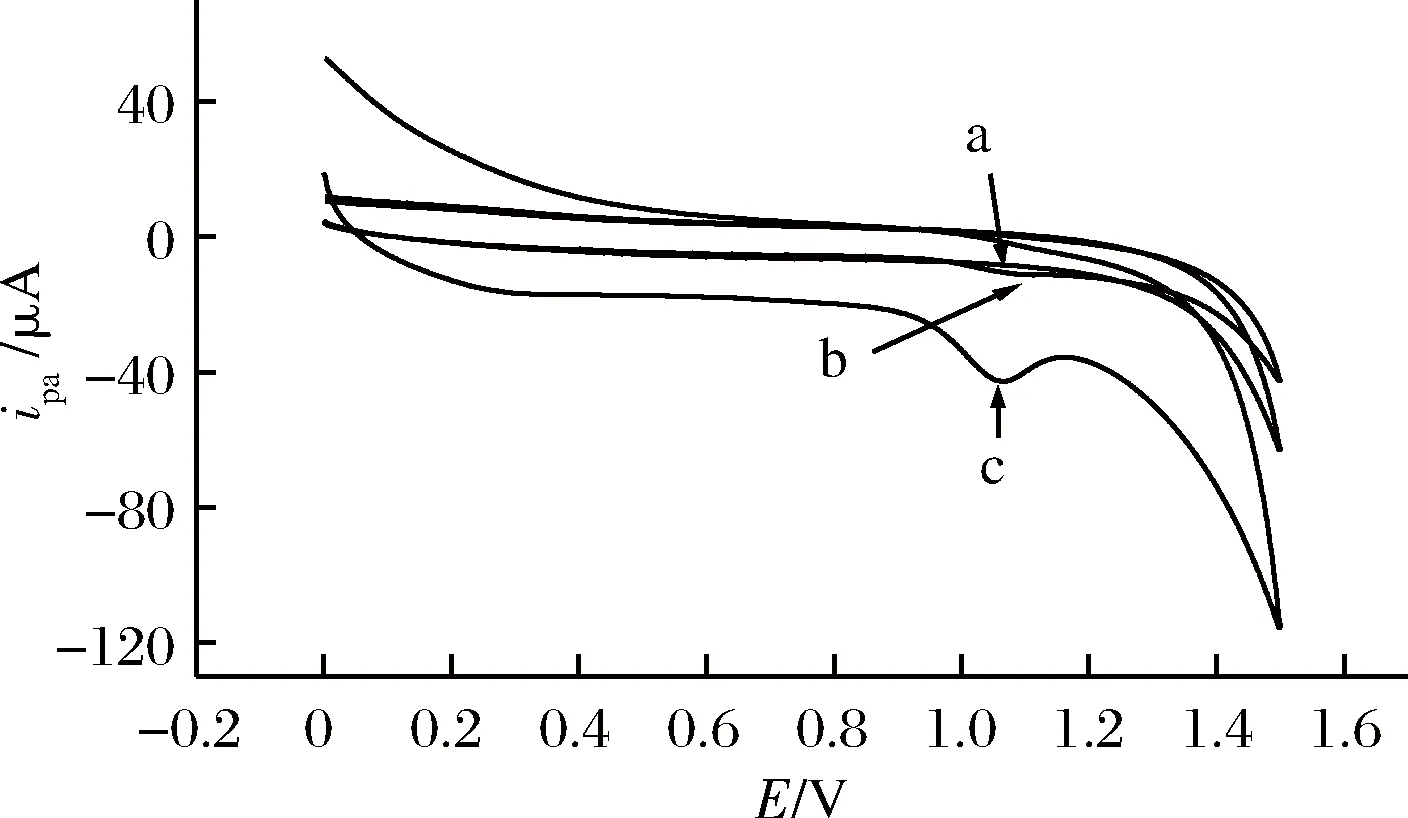
图2 PLC/GCE测定空白溶液(a)、GCE测定曲酸溶液(b)、PLC/GCE测定曲酸溶液(c)的循环伏安图Fig.2 Cyclic voltammograms of blank solution determinedby PLC/GCE(a), kojic acid solution determined by GCE(b),kojic acid solution determined by PLC/GCE(c)
2.3 测定曲酸的最佳实验条件
2.3.1 溶液酸度的影响
保持0~1.5 V的扫描电位、100 mV/s的扫描速度等实验参数不变,测定不同pH的曲酸溶液的ipa。由图3可见,当pH=4.0时,曲酸的ipa最大,故本论文中曲酸溶液的最佳测定pH为4.0。结果还表明,随着pH值的升高,曲酸的Epa逐渐负移,且Epa与pH呈线性关系(线性关系如图4所示),其方程为:Epa(V)=1.33~0.067 pH(相关系数R=0.998 5),线性方程的斜率为0.067 mV/pH,接近0.059,说明质子参与了曲酸在修饰电极表面上的氧化反应,且质子转移数等于电子转移数,其可能电极反应式如下式(1)所示。

自a到g的pH:2.2、3.0、4.0、5.0、 6.0、7.0、8.0图3 曲酸在PLC/GCE上随pH变化的循环伏安曲线Fig.3 Cyclic voltammograms of kojic acid on PLC/GCEwith change of pH

图4 Epa与pH的线性关系Fig.4 Linear relationship between Epa and pH
2.3.2 扫描速度(v)的选择
固定曲酸溶液pH=4.0,扫描电位范围为0.0~1.5 V,讨论扫描速度对曲酸ipa的影响。结果表明,曲酸氧化峰电流随扫描速度在20~300 mV/s范围内不断增大而增大,而且ipa与扫描速度呈线性关系(如图5所示),线性方程为:ipa(μA)=5.50+0.056v(mV/s),R=0.995 2。表明曲酸在聚L-瓜氨酸修饰电极上的电化学行为是由吸附控制过程的。由图6可知,当扫描速度v=100 mV/s时,氧化峰峰形较好,灵敏度较高,故本文中测定曲酸溶液时的扫描速度为100 mV/s。
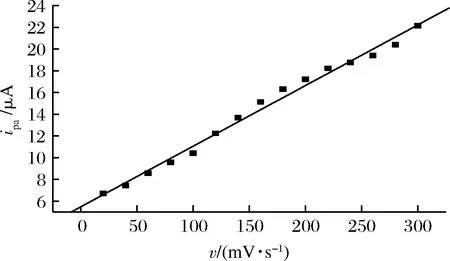
图5 曲酸在PLC/GCE上的ipa随扫描速度的变化关系Fig.5 The change of ipaon PLC/GCE with scan rate
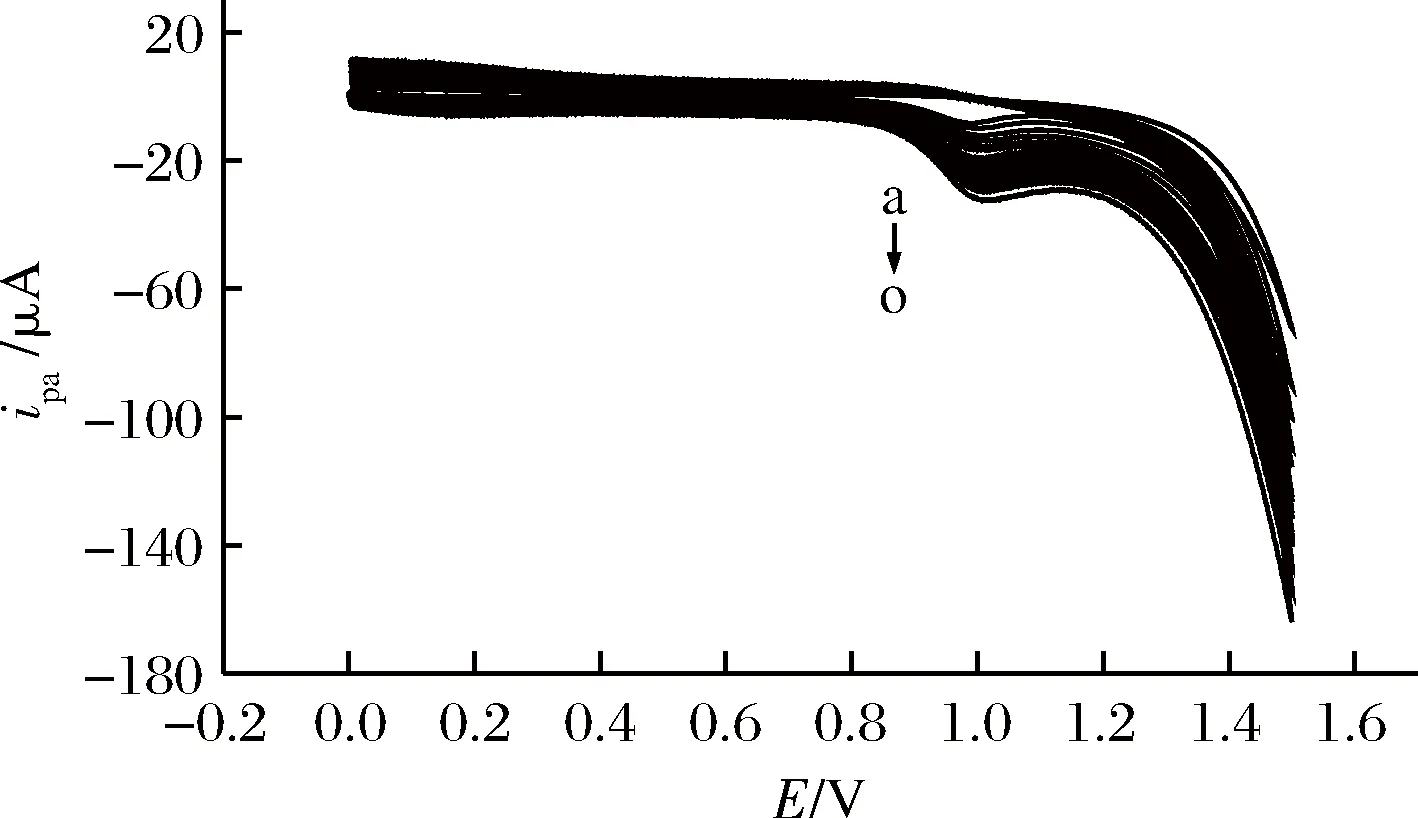
自a到o:20、40、60、80、100、120、140、160、180、200、220、240、260、280、300 mV/s图6 曲酸在PLC/GCE上随扫描速度变化的循环伏安图Fig.6 cyclic voltammograms of kojic acid with scan rateon PLC/GCE
2.3.3 测定电位范围的影响
保持曲酸溶液pH=4.0、扫描速度为100 mV/s,讨论测定时扫描电位对曲酸的氧化峰电流的影响。实验结果表明,当高电位为1.5 V,低电位0.0 V时所测得的曲酸氧化峰电流值最大,故本论文的最佳扫描电位范围为0.0~1.5 V。
2.4 工作曲线及方法重现性
在测定曲酸的最佳实验条件下,用PLC/GCE测定不同浓度曲酸的CV曲线示于图7。
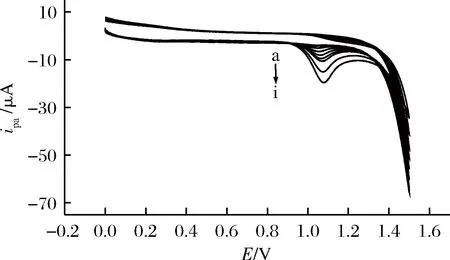
自a到i: 8、10、20、40、60、80、100、160、280 μmol/L图7 不同浓度的曲酸在PLC/GCE上的循环伏安曲线Fig.7 CV curves of kojic acid of different concentration onPLC/GCE
当曲酸浓度增加到4.00×10-6mol/L时出现第一个氧化峰,所以本论文中测定曲酸溶液的检出限为4.00×10-6mol/L。当浓度在8.00×10-6~2.80×10-4mol/L的范围内与ipa有良好的线性关系(如图8所示),线性方程为:ipa(A)=1.03×10-6+0.060c(mol/L),相关系数(R)为0.995 5。

c(曲酸)分别为8、10、20、40、60、80、100、160、280 μmol/L图8 曲酸的浓度与其在PLC/GCE上的氧化峰电流的关系曲线Fig.8 Curve of the concentration of kojic acid and itsoxidation peak current on PLC/GCE
2.5 干扰实验

2.6 样品中曲酸含量测定
用制备的PLC/GCE在测定曲酸溶液的最佳实验条件下对黄豆酱、醋和酱油样品待测液进行回收率实验,结果如表1所示。

表1 待测样品中曲酸的测定(n=3)Table 1 Determination of kojic acid in the sample tobe tested(n=3)
经计算黄豆酱中曲酸的含量为0.75 mg/g、醋中曲酸含量为0.029 mg/mL、酱油中曲酸的含量为0.58 mg/mL。
3 实验结论
本文制备了PLC/GCE,获得了修饰电极的最佳制备条件和测定曲酸溶液的最佳实验条件,用PLC/GCE在最佳实验条件下对曲酸含量进行CV测定。曲酸在8.00×10-6~2.80×10-4mol/L浓度范围内与其氧化峰电流呈较好的线性关系,样品回收率为98.9%~104.2%, 该方法重现性、稳定性良好,可用于黄豆酱、酱油和醋样品中曲酸的测定,建立了测定食品中曲酸含量的新方法。
