多维度关注生物类似药的管理与临床应用
2020-02-26梅丹都丽萍张钰宣
梅丹 都丽萍 张钰宣


中图分类号 R979.9
文献标志码A
文章编号1001-0408(2020)03-0373-06
DOI 10.6039/j.issn.1001-0408.2020.03.24
摘要 目的:为提高生物类似药的管理与临床应用水平提供参考。方法:检索国内外药品监管部门和世界卫生组织有关生物类似药审批和应用管理相关的政策法规,从药品全生命周期、通用名和处方、适应证外推、临床用药互换、药物警戒、医保支付体系、教育培训等多维度对生物类似药进行梳理。结果与结论:生物类似药是指在质量、安全性和有效性方面与已获准上市的参照药具有相似性的治疗性生物制品。在生物类似药的研发、生产、流通、使用、监管全生命周期系列环节中的管理在不同国家/地区/组织各有特点,其在研发阶段不需再独立验证安全性和有效性,只需用分析方法逐步从结构和功能上阐明其与参照药高度相似性即可;我国的生物类似药命名与原研药相同,采用通用名处方;美国FDA批准生物类似药的适应证外推需要基于其申请时的数据和信息、参照药的安全性和有效性信息及适应证相关科学要素的考量,需要经过评估,在监管下有条件地使用;美国FDA审批可替换生物类似物的标准严格,即实现互换的审批标准要高于生物相似的审批标准,但我国目前尚无这一概念;医药企业、监管机构、学术机构、医院药房之间需沟通交流,共同加强上市后风险控制和安全性监测;我国医疗保障部门需建立适宜的支付体系并通过支付制度鼓励生物类似药的使用;医务工作者要学习生物类似药的特点,才能在了解其技术审评的基础上,于实践中用好生物类似药。
关键词 生物类似药;药品管理;臨床应用
近年来,生物制品在治疗领域显现出临床优势,无论国内或国外,生物制品用作治疗性药品已呈飞速增长的态势。具有临床价值的新的生物药可通过绿色通道或优先审评审批程序研发上市[1,2],上市产品呈爆发式增加,但同时也带来医疗卫生费用的快速增长[1]。生物类似药是指在质量、安全性和有效性方面与已获准注册的原研药具有相似性的治疗用生物制品。以原研生物药质量、安全性和有效性为基础的生物类似药的研发,提高了生物药的可及性[3],并为临床治疗多提供了一个选择。在挽救生命、满足公众对生物治疗产品需求的同时,几种治疗等效的生物类似药有望因更大的市场竞争而使治疗费用降低。目前,生物类似药已列入2019年版世界卫生组织(WH0)《基本药物目录》[3],将会对卫生费用的预算带来重大影响。
2006年,欧盟批准了第一个生物类似药,在建立生物类似药的管理框架、审评体系、成型发展方面,为全球作H{了积极的引领作用[4]。从临床获得的证据表明,欧盟已批准的28种生物类似药用于所批的适应证是安全有效的[5]。2009年,美国国会通过的《生物制品价格竞争和创新法案》[6],创造性地简化了生物类似药的上市途径,替换FDA已批准的生物制品,在解决可及性问题的同时降低了费用。我国也在2015年发布了《生物类似药研发与评价技术指导原则(试行)》[7],旨在规范生物类似物的研发与评价,推动生物医药行业的健康发展。2019年2月22日,用于治疗非霍奇金淋巴瘤的首个国产生物类似药利妥昔单抗(商品名:汉利康)获批上市[8];同年11月7日,国内首个阿达木单抗生物类似药获批。本文通过梳理国内外相关审评审批制度和应用管理政策法规与文献,为提高生物类似药的药事管理和临床应用水平提供参考。
l 概述
从市场看,2018年全球销售额排名前10位的药物中,8个是生物制品,年销售额突破767.2亿美元[9],聚焦的疾病领域包括抗肿瘤、风湿免疫、眼部疾患、炎性肠病和血液疾病等,均是目前临床治疗需求活跃的领域。医院药事管理与药物治疗委员会对新药申请和遴选的总体原则一般是在满足临床患者需求的同时,体现学科发展方向,生物药和生物类似药正逐渐成为医院药事管理与药物治疗委员会遴选药品的重要组成部分。生物制品是以微生物、细胞、动物或人源组织和体液等为起始原材料,用生物学技术制成的用于诊防治疾病的制剂[10],具体包括治疗用蛋白(如非格司亭)、单克隆抗体(如阿达木单抗)和疫苗(如流感疫苗)等。因其特点不同于传统的化学药和化学仿制药,为确保临床用药的安全、有效和经济,更需要药师为医院药事管理与药物治疗委员会准备充足且不偏倚的材料,只有让医院相关管理部门和临床医师从概念、审批、差异等方面深刻理解生物类似药,才能让生物类似药进入处方集并在临床实践中发挥作用及提供理论基础。
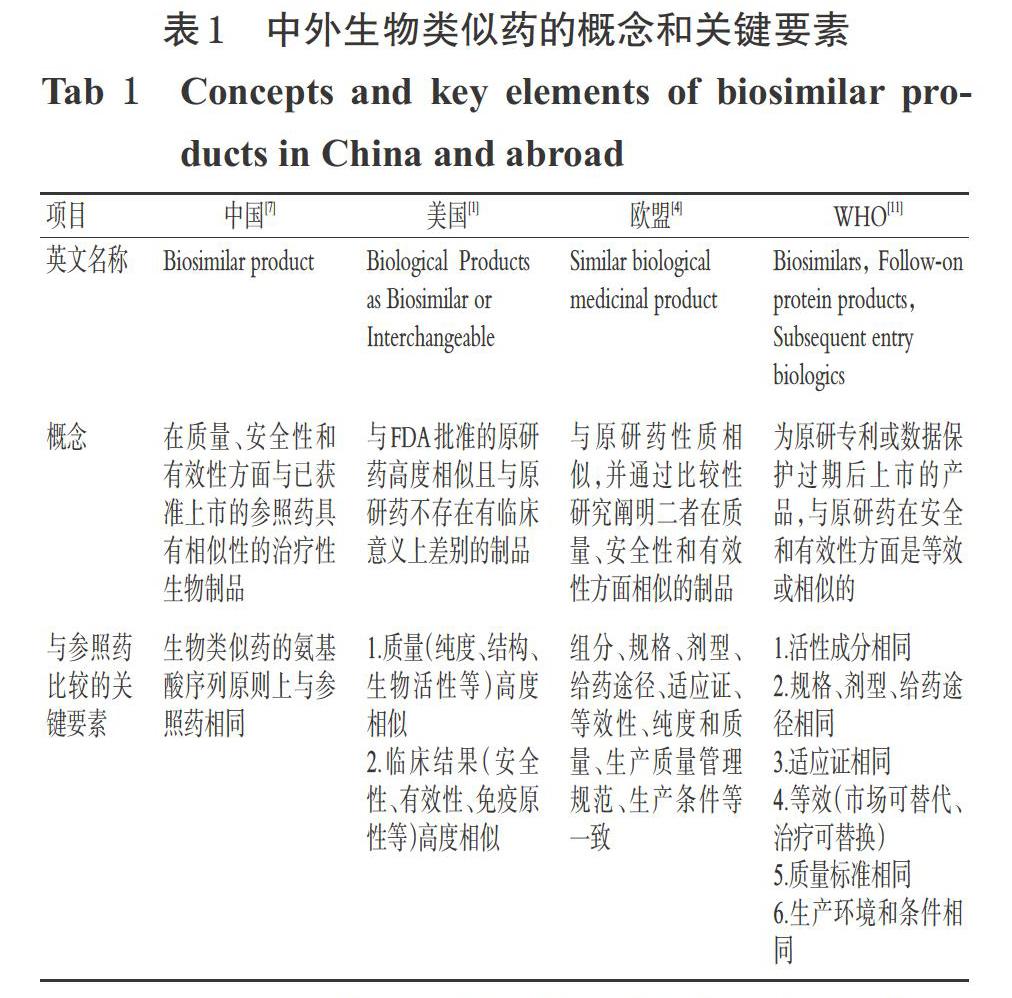
与生物类似药相对应的,市场上已有的按照新药研发和生产且已获准注册的生物制品被称为原研药(Ref-erence product),其具有完整安全性和有效性研究数据[1],是生物类似药开发的参照药。中外生物类似药的概念和关键要素见表1。
由表1可见,临床惯用的化学药和仿制药是结构和治疗学等效,而生物类似药与参照药比较是高度相似但更为复杂,除临床非活性成分的细小差别外,与参照药在安全性和有效性方面不存在有临床意义的差别。从临床应用的角度,生物类似药除了与参照药在品名、组分、规格、剂型、给药途径、适应证、纯度和质量、生产条件和质量管理等一致外,还应综合考虑包装的适用性、贮存条件和有效期等因素。
2 从药品全生命周期关注生物类似药
生物药的特点是分子量比化学药大成百上千倍,具有复杂的多级结构和理化性质,且生产工艺复杂,完全等同复制极为困难。因开发不易,申报难,生产罐的大小、产能、批量等受限因素多,临床研究费用高昂等,导致生物类似药应运而生。特别是在临床需求、医保控费及资本市场的推动下,全球生物类似药的研发异常火热,截至2019年5月29日,全球生物类似药研发处于活跃状态的有718个、上市121个、注册阶段31个、Ⅲ期临床试验阶段72个、Ⅱ期临床试验阶段8个、I期临床试验阶段75个,还有386个处于开发阶段[9]。我国在研生物类似药以251个的数量优势领先全球。
研发、生产、流通、使用、监管是药品全生命周期的系列环节,每个环节均有其需要注意的内容。
2.1 从研发的角度
原研产品要经过完整的非临床和临床试验系统评价来获批上市,而生物类似药不需再独立验证其安全性和有效性,只需用分析方法逐步从结构和功能上阐明其与参照药高度相似性,可避免重复、耗费很长周期且花费高昂的临床试验。
鉴于某一企业生产的产品很难被另一药企完全精细复制,生物类似药的研发是以药学、非临床和临床比对试验证明其与参照药的相似性[12],保障其安全、有效和质量可控[7]。我国生物类似药研发评价要素见表2。
2.2 从审批的角度
生产生物类似药的药企可依靠某些已发布的原研药的安全性和有效性数据来作为支撑[1]。美国FDA在考虑发证时,会全面评价数据和信息并结合公众对原研药的认知,如果原研品存在免疫原性等不良结果,则会要求提供更严格的生物类似药免疫应答数据[1]。即便是快速审评审批并不降低标准,所需的数据包要求依然非常全面。对可替换产品,还需提供针对特定患者与原研药相同的临床结果,证明不会增加安全性风险或降低有效性[1]。
2.3 从生产的角度
药企应用最先进的技术保证生物类似药的产品特性和生物活性与参照药高度相似,仔细监控生产过程的差异,因为源自生产过程的内在变异会给产品定性和生产过程带来挑战[1]。同一产品不同批次间的细微内差在制造过程中是正常可接受的,也是可预期的。美国FDA强调通过评价制造过程和制造商控制产品内变异的策略来确保生产出具有临床一致性的生物制品。
2,4 从临床的角度
临床无差异是指不同产品在安全性、纯度、效价方面没有差异,具体通过人体药动学(暴露量)和药效学(反应)研究、临床免疫原性评估,必要时还可能需要结合临床试验来证实[1]。当生物类似药被药监部门批准上市后,会在标签和说明书上体现。美国的紫皮书中收载了FDA已批准的生物类似药,其列表有生物制品许可证码、生物类似药通用名、参照药通用名和商品名、批准日期、参照药专利过期时间等[13]。同时在FDA网站的Drugs栏目下可查询评估概要信息,即批准信息和管理咨询信息。我国的上市药品目录集尚未收载相关信息。
3 从通用名和处方关注生物类似药
药品的名称是一切应用的基础,标准化至关重要,我国现在多已采用WHO的国际非专利名(INN名称)作为药品通用名。各国关于生物类似药的通用名规则见表3。
由表3可见,不同国家和地区制定的命名规则是有区别的。通用名即INN是基本组成,原研药和生物类似药都要用到。随着生物类似药的不断上市,需要通过命名区分不同产品:有直接采用通用名但要求处方时必须加注商品名的,有采用通用名加独立识别码(数字或字母)为名而不必要求用商品名的。有区别的通用名规则要求处方、收费、调配、发药及药品不良反应监测应具体到品种,如原研药与生物类似药采用相同的通用名,则需在应用环节加注厂牌、商品名和批号等可区分的项目。生物类似药与参照药的通用名有所区分,可降低处方或药房调剂差错的发生风险,并将药品不良事件与特定的产品准确关联,以实施有效监管。但我国的生物类似药命名与原研药相同,采取的是不区分原则,有关药物警戒和和替换建议在说明书中进一步明确[15],结合我国医院处方必须用通用名开方的要求,建议宜在开方、审方、收费、调剂、配发乃至药物警戒环节要有内部溯源手段,以保证患者健康和用药安全。
4 从适应证外推关注生物类似药
生物类似药获批的适应证与参照药是相同的,当获批了一个与参照药相同的适应证后,可以获批参照药其他适应证,被称为外推。但生物类似药厂家必须提供科学证据来支持外推。外推适应证是由药品审评部门批准的,例如美国FDA批准外推需基于以下信息:(1)生物类似药申请時的所有数据和信息;(2)审批参照药适应证已知的安全性和有效性信息;(3)每个适应证相关的不同科学要素的知识和考量[1]。所以要清楚参照药在所批适应证的作用机制、药动学、药效学、有效性、安全性和免疫原性,即便是作用机制及靶点相同的,FDA也要评估无差异后才能使类似物获得外推适应证。对合并用药人群、不同合并疾患者群及存在不同推荐剂量等情形,外推须很慎重[1]。为此,医务人员要仔细阅读说明书,为患者开具适宜的药品。当临床实践中出现说明书之外的用法时,建议经医院医疗委员会、医院药事管理与药物治疗委员会和专科评估后,在医务处备案监管下有条件地使用,以降低医院的医疗风险。
5 从临床用药互换关注生物类似药
医师的医疗目标是正确诊断并使患者获得健康结果;药师在为患者提供药物治疗的同时要保证药物的正确使用和贮存;患者在没有过度支付的情况下希望得到最有效并能负担得起的治疗;支付方确保在预算框架内的患者得到尽可能好的治疗;政策制定者则是创造或维持医疗保健系统,以满足需求、提高健康结果、保证公平性。为此,多方利益平衡的结果就是可能出现用药的互换,具体包括原研药与生物类似药的转换(Switch)或两种生物类似药间的替换(Substitution)。
转换一般是指在特定患者身上,当疾病得到稳定控制时,医师可能将患者使用的原研药转换为具有可互换性的生物类似药,期望产生临床等效并降低费用。这多是医师根据患者个体情况作出的临床决策,但往往需要额外的科学研究数据如交叉试验验证,并需要患者意愿上的支持。替换则是指同一生物类似药不同品牌的等效产品间的选择,国外一般不需医师参与,而由药师发起该行为。
针对可替换生物类似物的审批,FDA的标准更为严格,即实现互换的标准要高于生物相似性的审批,生物类似药生产企业需提供风险评估数据和信息,证实其类似物与参照药在任意患者身上都会产生相同的临床结局,即不增加不良反应、不降低药效。在单个患者多次交替使用中,生物类似药的安全性和疗效减少的风险应不高于持续使用参照药的风险。但须注意的是,FDA只是批准上市,在药房可否被替换不是其监管范畴内事务,而由各州药品法规决定。一旦生物类似药获批为可替换产品,依照所在州法律规定,可能由药师实现替换[16]。各国药监部门有关生物类似药互换的简要规定见表4。
美国已批准23款生物类似药[16],紫皮书中列表[13]标注出是否有可转换性(Interchangeable标记),该表实时更新,有一个产品已获批多个生物类似药的如英夫利昔单抗,但尚未见I标记。2019年4月3日,美国国会能源商务委员会通过《2019保护消费者对仿制药的获取法案》[17]禁止原研药企通过补偿仿制药企(包括生物类似药企)而推迟仿制药和生物类似药进入市场。2019年5月10日,美国FDA发布了生物类似药可互换性指南[18]。
转换用药的主要潜在风险因素是生物类似药免疫原性相关经验有限,相似并不意味着即可互换,而要有严格稳健的药物警戒系统跟踪和追溯。
6 从药物警戒关注生物类似药
药物警戒是生物类似药全生命周期安全性评价的重要手段,WHO早在十余年前就意识到生物类似药相关药物警戒问题,启动制定全球规则,并于2009年发布了关注生物类似药警戒风险一用药安全的新挑战[11]。2017年欧盟更新了生物类似药指导原则[5]。美国在2015年3月6日批準第一个生物类似药Zarxio时要求在医院处方/给药,从采购、电子处方等追踪安全性并设立了疗效相关生物标志物——中性粒计数——进行用药后监测评价。
随着生物制剂的广泛应用,慢病用生物制剂安全性问题备受关注,特别是免疫原性的风险评估。为此,企业、监管机构、学术机构、医院药房间的沟通交流与信息分享非常重要[6]。国家法律法规、配套政策、指南的完善、利益相关方教育是解决患者对生物类似药可及性和安全使用的重要基础和保障。
7 从医保支付体系关注生物类似药
生物类似药为医师和患者提供了更多的选择,将有效缓解患者与医保系统的经济压力。艾昆纬调查数据显示,未来5年内,生物类似药有望为欧盟和美国市场的医疗卫生体系节约超过500亿欧元的费用。《美联邦食品、药品和化妆品法案》在2019年修订了生物类似药使用费用法案(BsUFAⅡ),授权FDA收集2017年10月一2022年9月生物类似药的费用[19]。FDA还颁布了生物类似药使用计划(Biosimilars action plan,BAP)[20]和生物类似药可互换性指南[18],旨在鼓励开发创新和竞争,同时也促成生物类似药和可替换产品的批准,以表明其支持生物类似药在拯救生命或改善生活质量、使公众健康获益的同时降低病患费用方面的态度。我国的医疗保障涵盖了药品的保险目录遴选、采购、高价值药品谈判,更具挑战的是建立适宜的支付体系并通过支付制度鼓励生物类似药的使用。
8 从教育培训关注生物类似药
药师作为生物类似药教育培训的重要参与者、主导者,首先,要告知医务人员和患者,在说明书批准的适应证上,生物类似物和参照药是没有差别的,同样安全有效[3]。向医师解释清楚生物类似药的一致性信息会比简单呈递新药批件和行政命令要求、广告更为让他们信服。2017年欧盟发布了新指南[5],旨在从科学和法规两方面提升医务人员对生物类似药的理解。跟踪更新的药物治疗方案,协助医师开展患者用药的教育和干预,在生物类似药成为慢病治疗药的一部分时提供专业技术的支持是药师处理复杂用药的工作之一。FDA下属药品审评中心的小型工商业支持项目( Small business&industry assistance,SBIA)[21]从2013年8月开始在其网站提供多媒体学习资源,药师和药学技术员可通过文字资料、更新的数据库、录制的幻灯片和社交媒体信息学习理解生物类似药。网站还为咨询委员会和政府雇员更好地理解相关法条的管理框架和关键要点提供了课件,都是药师可以深入学习借鉴并在药师继续教育平台实践的手段。
9 结语
总体而言,生物类似药的研发、商业化和临床应用都进入了蓬勃发展的时期,我国在解决国内患者生物制品药物可及性的同时,要遵循生物类似药研发规律,夯实生物制品民族产业基础。利好的政策(监管、审批、法规、医保支付等)极大地推动了生物类似药的商业化进程,但极度激烈的竞争可能会导致市场无序甚至存在突破底线的潜在风险,医师和药师等医务工作者在加深理解生物类似药的同时,应关注其在上市后真实世界数据、有效性和安全性评价,充分发挥生物类似药的优势。
参考文献
[1]FDA. Biosimilars are safe,effective treahnent options[EB/01]. (2018-09-06) [2019-08-26]. https://www.FDAgov/drug s/therapeutic-biologic s-applications-bla/biosimi-lars.
[2] 国家药品监督管理局.国家药品监督管理局药品审评中心关于鼓励药品创新实行优先审评审批的意见[EB/OL].(2017-12-21) [2019-09-02].http://www.cde.org.cn/poli-cy.do?method=view& id=418
[3]WHO. World health organization model list of'essentialmedicines 21st list 2019[EB/OL]. (2019-07-09) [2019-09-06] .https: //apps.who.int/iris/bitstream/handle/10665/325771/WHO-MVP-EMP-IAU-2019.06-eng.pdf?ua=l
[4]EMA. Guideline on similar biologicalmedicinal products[EB/OL].(2005-10-30) [2019-09-05]. https://www.emaeuropa.eu/en/doc uments/scientific-guideline/guideline-similar-biological-medicinal-products_en.pdf.
[5]EMA. New guide 0n biosimilar medicines.for healthcarepro fessionals increasing understanding o[biosimilar medi-cine.s'[EB/OL]. (2017-05-05) [2019-09-04].https://wwwema.europa.eu/e n/documents/press-releas e/new-guide-bi-O similar-medicines-healthcare-pro fe ssionals-increa sing-understanding-biosimilar_en.pdf
[6]U.S. Department of Health and Human Services,FDA,CDER, et a1.BiosimilaritV biosimilars: additional ques-tions and answers regarding implementationD,'the biolog-ics piice competition and innovation act of'2009 guidance.for industry[EB/OL]. (2015-05)[2019-09-16].http://pharma-bio.com/wp-content/uploads/2015/06/FDA_Biosi-milars_Q&A.pdf.
[7]国家食品药品监督管理总局,生物类似药研发与评价技术指导原则:试行[EB/OL].(2015-02-28) [2019-08-12]http://www.nmpa.gov.c n/WS04/CL2138/300003.html
[8]国家药品监督管理局首个国产生物类似药利妥昔单抗获批上市[EB/OL].(2019-02-25)[2019-08-12]. http://www.nmpa.gov.cn/W S04/CL2056/335194.html
[9] 肖恩2019全球生物类似物研发报告[EB/OL].( 2019-08-06) [2019-10-3l].http://www.360doc.com/content/19/0806/19/52645714 853361880.shtml
[10]国家药典委员会中华人民共和国药典:三部[S]. 2015年版北京:中国医药科技出版社,2015:XTX.
[1 1]WHO. Pharmacovigilance .focus-biosimilar medicinesand sa fety:newcha Henges.for pharmacovigilance[EB/OL][2019-09-05].https://www.who.int/medicine s/publica-tions/druginformation/issues/Druglnf009v23-2.pdf.
[12]國家药品监督管理局,国家药监局药品审评中心生物类似药研发相关问题问与答[EB/OL].(2019-07-31)[2019-09-02].http: //www.cde.org.c n/news.do?method=viewln-foCommon&id=314906.
[13]FDA. Background information:lists of Iicensed biologicalproducts with reference product exclusivity and biosimilar-ity or interchangeability evaluations (puiple book) [EB/01]. (2019-07-02) [2019-09-16]. https://www.FDAgov/drugs/biOsimilars/background-information-lists-li-censed-biological-products-reference-product-exclusivity-and
[14] 国家药典委员会生物制品通用名命名原则规程[EB/OL].(2017-02-12)[2019-09-16]. http://www.chp.orgcn/upload/userfiles/20170301/97081488335137530.pdf.
[15] 国家药品监督管理局关于生物类似药临床研究用原研参照药进口有关事宜的公告[EB/OL].(2019-05-27)[2019-08-12].http://www.nmpa.gov.cn/WS04/CL2138/338047.html.
[16] FDA. Biosimilar product information[EB/OL].(2019-07-23) [2019-09-1 6]. https: Uwww.FDA.gov/drugs/biosimi-lars/biosimilar-product-info rmation
[17]House Committee on Energy&Conuuerce. EC chairmanpallone on pa.s'.s'age of'12 b///.s to lower health care andprescription drug costs .for consumers[EB/OL]. (2019-04-04) [2019-09-16]. https://energycommerce.house.gov/newsroom/press-releases/ec-chairman-pallone-on-passage-of-12-bills-to-lower-health-care-and.
[18] Center for Drug Evaluation and Research, Center for Bio-Iogics Evaluation and Research of FDA. Considerationsin demonstrating interchangeability with a reference prod-uct guidance .for /ndushy[EB/OL]. ( 2019-05-10 ) [2019-09-16] .https : //www.FDA.gov/regulatory-information/se-arch-FDA-guidance-documents/considerations-demonstra-ting-interchangeability-re ference-product-guidance-indus- try.
[19]FDA. Biosimilar user .fee amendments[EB/OL]. (2019-08-16) [2019-09-16].https ://www.FDA.gov/industry/FDA-user-fee-programs/biosunilar-user-fee-amendments.
[20] FDA. Bio.s-imilar action p/an[EB/OL].(2018-07-18)[2019-09-16].https : //www.centerforbiosimilars.com/news/FDA-releases-biosimilar-action-plan.
[21] FDA. Patient and prescriber outreach materials[EB/OL].(2018-05-22) [2019-09-16].https://www.FDA.gov/drugs/biosimilars/patient-and-prescriber-outreach-materials.
(收稿日期 :2019-10-04 修期:2019-11-25)
(编辑:刘明伟 )