伊贝母多糖的提取工艺优化及结构表征
2020-02-26阿衣吐逊·阿布都外力帕尔哈提·柔孜高彦华排合尔丁·木台力甫热合巴提·努尔夏提宁慧霞阿布力米提·伊力
阿衣吐逊·阿布都外力 帕尔哈提·柔孜 高彦华 排合尔丁·木台力甫 热合巴提·努尔夏提 宁慧霞 阿布力米提·伊力
中图分类号 R943;R629.12
文献标志码A
文章编号 1001-0408(2020)03-0276-06
DOI 10.6039/j.issn.1001-0408.2020.03.05
摘要 目的:优化伊贝母多糖(FPSP)的提取工艺,并对其结构进行研究。方法:采用Box-Behnken设计一响应面法,以FPSP产率为响应值,对FPSP提取工艺中的料液比、提取温度、提取时间进行优化。通过紫外吸收光谱法、傅里叶红外光谱(FTIR)法、气相色谱一质谱联用(GC-MS)法、刚果红染色法、扫描电子显微镜(SEM)观察、X射线衍射(XRD)法及热化学分析等表征手段对FPSP进行结构初探。结果:FPSP提取的最优工艺参数为料液比1:28(g/mL),提取温度94℃、提取时间2.5h,产率为16.25%(n=3),与理论产率(16.58%)的误差为0.33%。FPSP是由物质的量之比为1:58.02:0.73的木糖、葡萄糖、半乳糖及微量甘露糖组成,在280 nm波长附近有弱吸收峰,属于a-构型的吡喃多糖,存在三螺旋结构,其表面呈显不规则颗粒堆积而成的网状结构,同时存在晶体与非晶体结构,具有较好的热稳定性。结论:优化后的FPSP提取工艺合理、产率较高,可为伊贝母资源的进一步开发利用提供参考。关键词伊贝母多糖;Box-Behnken设计;响应面法;结构表征;提取工艺
伊贝母(Fritillaria pallidiflora Schrenk)是多年生草本植物,属于百合科(Liliaceae)贝母属(Fritillaria)植物的干燥鳞茎,已收载于2015年版《中国药典》[1]及《新疆药用植物志》[2]等。伊贝母中主要化学成分为生物碱[3]、甾体皂苷[4]、蛋白[5]、多糖[6]等。有研究表明,伊贝母具有清热、润肺、止咳、化痰、解毒等功效;能够治疗支气管炎、肺结核、咳喘、痰喘、胃溃疡、十二指肠溃疡、黄疸、痈肿及疮毒等疾病[7-9]。
大量研究表明,天然药用植物来源的多糖具有多种生物活性,包括抗氧化[10]、抗肿瘤[11]、降血糖[12]、抑菌[13]、改善机体免疫功能[14]、调控肠道菌群[15]等。长期以来,植物多糖以其广泛的药效作用和极低的细胞毒性,在食品、医药、化妆品和环境等领域具有广阔的应用范围。
前期有关伊贝母的研究主要集中在其生物碱类成分的分析上[3],而有关其多糖成分的提取分离和结构鉴定及其相关生物活性的研究报道较少。已有研究表明,多糖的生物活性与其化學结构密切相关[6]。因此,探究伊贝母中具有生物活性的多糖成分具有实际意义。本研究采用Box-Behnken设计一响应面法优化伊贝母多糖(FPSP)的提取工艺,利用紫外吸收光谱(UV)法、傅里叶红外光谱(FTIR)法、气相色谱一质谱联用(GC-MS)法、刚果红染色法、扫描电子显微镜(SEM)观察、X射线衍射(XRD)法及热化学分析等表征手段对FPSP进行结构初探,为其多糖类生物大分子化合物的进一步开发提供理论依据。
l 材料
1.1 仪器
FDU-2100型冷冻干燥机(日本Eyela公司);2550型紫外分光光度计(日本Shimadzu公司);CR22N型高速冷冻离心机(日本Hitachi公司);F-305型旋转蒸发仪(瑞上Buchi公司);7890A-5975C型GC-MS仪(美国Agilent公司);NICOLET 6700型IR仪(美国Thermo Fisher Sci-entific公司);SUPRA 55VP型SEM仪(德国Zeiss公司);STA449F3型热分析仪(德国Netzsch公司);D8 Advance型XRD仪(德国Bruker公司)。
1.2 药品与试剂
伊贝母于2016年6月采集于新疆伊犁,经新疆药物研究所何江研究员鉴定为百合科贝母属植物伊贝母(Fritillaria pallidiflora Schrenk)的干燥鳞茎(标本保存在新疆药物研究所标本室,标本号为81013);蛋门测量试剂盒(美国Thermo Fisher Scientific公司,批号:TH269579);葡萄糖标准品(上海阿拉丁生化科技股份有限公司,批号:L1431014,分析纯);半乳糖醛酸标准品(上海纯优生物科技有限公司,批号:RT19U1015,纯度:≥98%);间羟基联苯(上海源叶生物科技有限公司,批号:M23M8E32272,纯度:>97%);阿拉伯糖、木糖、鼠李糖、半乳糖、甘露糖、蒽酮、硫酸、石油醚、氢氧化钠、乙酸酐、吡啶、盐酸羟胺、刚果红、甲醇、磷酸氢二钠、磷酸二氢钠及铁氰化钾等试剂均为国产分析纯或实验室常用规格;水为蒸馏水。
2 方法
2.1 FPSP的提取
伊贝母干燥鳞茎经粉碎、过筛(40目)后,用石油醚脱脂3次,得到的脱脂粉以水为溶剂在一定的料液比、提取温度及提取时间条件下进行提取;过滤提取液,以6462xg离心10min(以下条件同),用旋转蒸发仪浓缩上清液,再次离心;取滤液,加4倍体积的冰乙醇沉淀,4℃放置12h,离心,冻于,得到FPSP。以FPSP干质量/药材质量Xl00%计算产率(%)。
2.2 指标测定
2.2.1 多糖含量测定按照标准DB12/T 884_2019[16],采用蒽酮一硫酸法,以葡萄糖标准品为标准物质,测定FPSP中多糖含量。
2.2.2 糖醛酸含量测定按照标准NY/T 2016_2011[17],采用间羟基联苯法,以半乳糖醛酸标准品为标准物质,测定FPSP中糖醛酸含量。
2.2.3 蛋门含量测定采用二喹啉甲酸(BCA)法,按照蛋门测量试剂盒说明书进行操作,测定FPSP中蛋门含量。
2,3 提取工艺优化
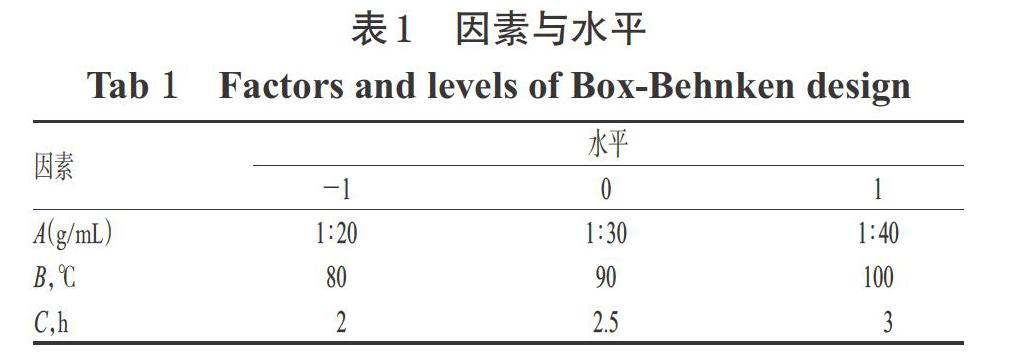
根据Box-Behnken原理设计试验,选取料液比(A)、提取温度(B)、提取时间(C)3个因素为自变量,以FPSP产率为响应值(Y),进行3因素3水平的响应面试验分析,得到FPSP提取的适宜工艺参数,并利用Design-Ex-pert 8.0.6软件对试验数据进行回归分析,拟合响应值与各因素的数学回归模型。因素与水平见表1。
2.4 FPSP的结构表征
2.4.1 UV法 配制质量浓度为1mg/mL的FPSP水溶液,用紫外分光光度计在200~400nm波长范围内进行全波长扫描。
2.4.2 FTIR法 取适量FPSP,采用KBr压片法,用IR仪在4000~400cm-1波数范围内进行分析。
2.4.3 GC-MS法 参考文献[6]所述方法,称取5.0mgFPSP,溶解于4mL的2mol/L三氟乙酸中,置于GC頂空进样瓶中,在鼓风干燥箱中以110℃条件密闭水解反应6h。反应结束后,在酸水解的样品中加入5mL甲醇,旋蒸蒸干,重复3次,除掉剩余的三氟乙酸。在各单糖标准品和酸水解完全的FPSP中分别加入8mg盐酸羟胺及0.5mL吡啶,搅拌溶解后置于90℃水浴中,反应30min。取出冷却至室温,再加入0.5mL乙酸酐,置于90℃水浴中反应30min后,氮吹仪吹干,加入1.OmL氯仿,产物用于GC-MS分析。GC-MS条件:毛细管色谱柱为OV-1701(30cmX0.32mm, 0.25μm).检测器为火焰离子化检测器(FID),检测器温度为270℃,进样口温度为250℃,程序升温(起始温度为160℃.以5℃/min升至190℃,保持5min,同样速度升温至230℃),载气为氮气,进样体积为1μL。
2.4.4 刚果红染色参考文献[6]所述方法,配制质量浓度为2mg/mL的FPSP水溶液和0.2mmol/L的刚果红试剂。分别量取6份1mL的FPSP水溶液于离心管中,加入不同体积的1mol/L的氢氧化钠溶液和水,摇匀,添加1mL刚果红试剂,使溶液中氢氧化钠的最终浓度分别为0.5、0.4、0.3、0.2、0.1、0.05mol/L。用紫外分光光度计在400~700nm波长范围内进行扫描,记录最大吸收波长(λmax)。以水代替氢氧化钠溶液作为空门组,以刚果红试剂与不同浓度的氢氧化钠溶液为对照组,同法操作。
2.4.5 SEM观察取适量干燥FPSP,采用离子溅射镀膜工艺镀一层铂金导电膜,用SEM镜观察样品表面形态。
2.4.6 XRD参考文献[18]所述方法,采用XRD仪对FPSP的晶体结构进行测定,设20为5°~60°,步长为0.01°,步速为0.1s。
2.4.7 热化学分析参考文献[19]所述方法,称取FPSP5mg,在氮气气氛下,以流量为50mL/min、升温速度为10℃/min、25~600℃温度范围内对FPSP进行热重分析法(TG)、微分热重分析法(DTG)和差示扫描量热法(DSC)分析。
2.5 统计学分析
试验均平均操作3次,数据以 ±s表示。使用Ori-gin 8.0.6软件进行单因素方差分析。P<0.05表示差异有统计学意义。
3 结果
3.1 FPSP提取工艺
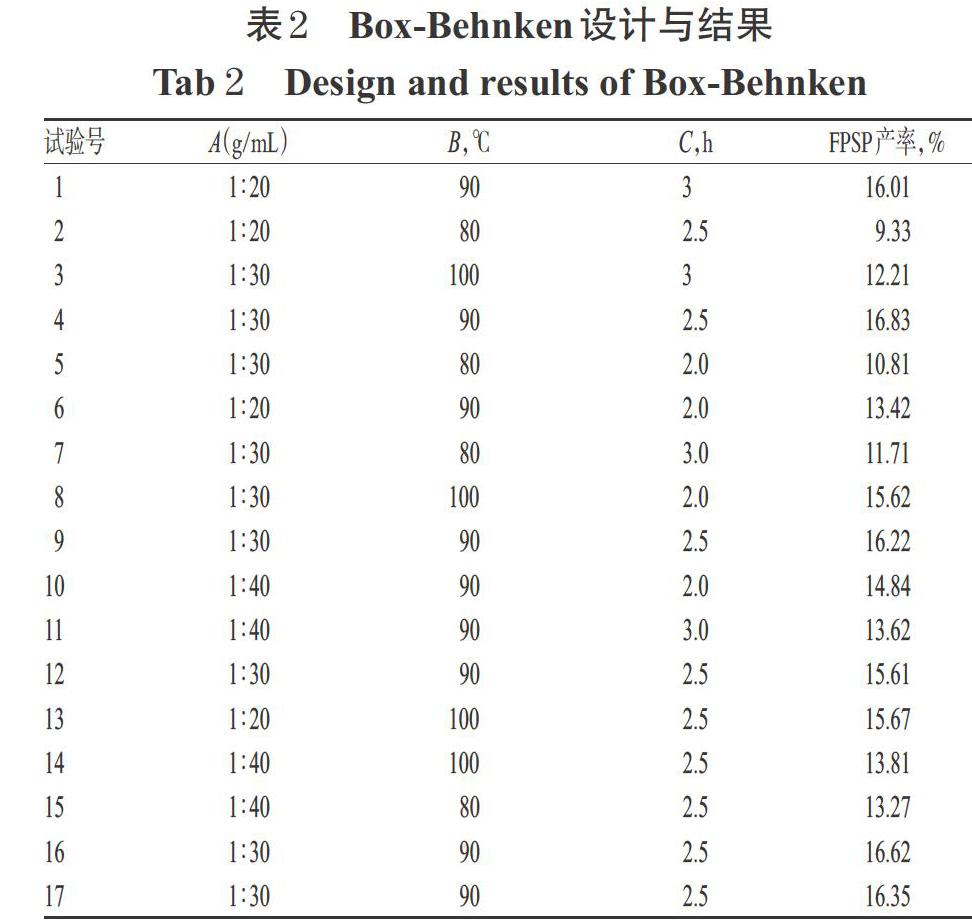
3.1.1 Box-Behnken设计与结果 Box-Behnken设计与结果见表2。
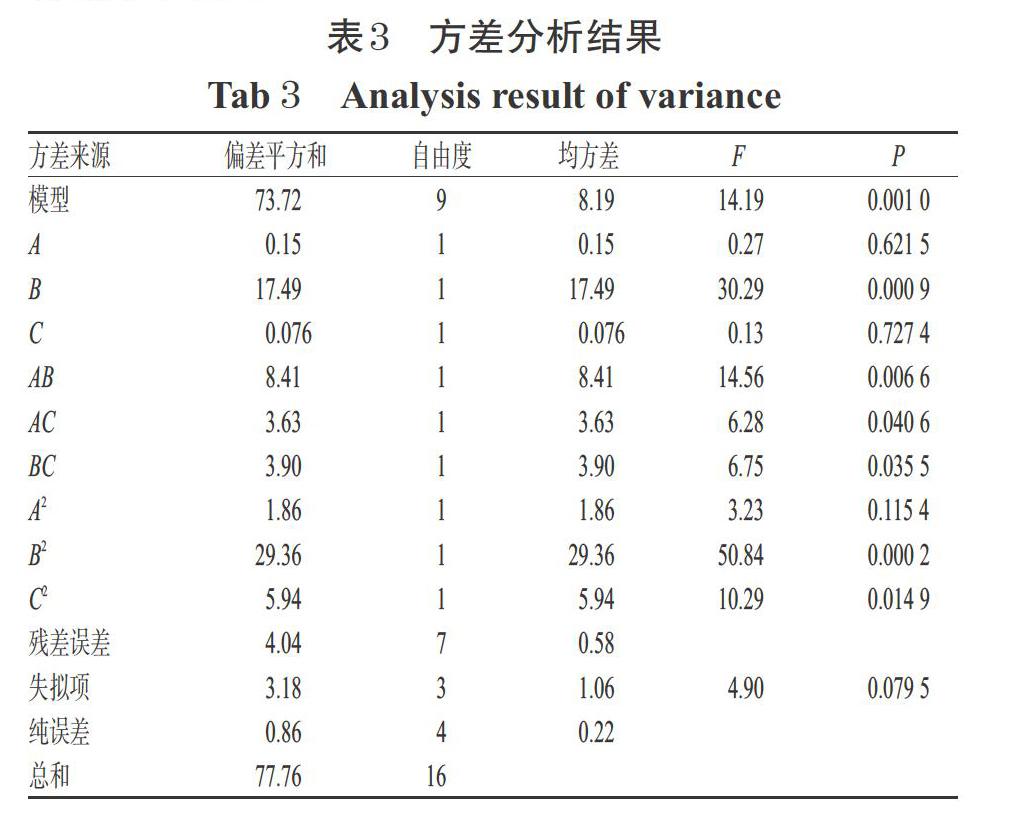
3.1.2 回归模型拟合结果与方差分析结果FPSP产率与各因素的数学回归模型拟合结果为:Y=16.33+0.14A+1.48B-0.097C-1.45AB-0.95AC-0.99BC-0.67A2-2.64B2-1.19C2。方差分析结果显示,该模型回归极显著(P<0.01),失拟项不显著(P>0.05),R2=0.948 0,提示该模型与试验拟合较好,试验方法可靠,可准确预测试验响应值。该模型中,B、AB及B2的P值均小于0.01,AC、BC及C2的P值均小于0.05,表明上述因素对响应值有显著影响。在试验范围内对所选因素影响大小排序为B>A>C,即提取温度>料液比>提取时间。方差分析结果见表3。
3.1.3 响应面优化结果 采用Design-Expert 8.0.6软件参考回归模型得出FPSP提取的最优工艺参数为料液比1:27.90(g/mL)、提取温度93.58℃、提取时间2.45h。在此条件下,FPSP产率的预测值为16.58%。为了验证响应面法的可行性,参考模型给出的最优条件,结合实际生产可操作性等因素,将最优提取工艺参数调整为料液比1:28(gmL)、提取温度94℃、提取时间2.5h。在此条件下进行3组平行试验,结果FPSP产率的平均值为16.25%(n=3),与预测值的相对误差为0.33%,表明该工艺参数准确可靠。各因素交互作用对FPSP产率的响应面等高线图见图1。
按优化后的工艺提取FPSP,对其进行质量评价。按“2.2”项下方法进行检测。结果,FPSP多糖含量为( 50.70±0.23)%、糖醛酸含量为(6.85±0.15)%、蛋白含量为(3.05±0.12)%(n=3)。
3.2 结构表征
3.2.1 UV检测结果FPSP在280 nm波长附近有弱吸收峰,说明其可能含有蛋白质。
3.2.2 FTIR检测结果FTIR图谱显示,FPSP在3423cm-1左右的吸收峰是羟基O-H伸缩振动峰,在2923cm-1左有的吸收峰是C-H伸缩振动峰,在1629 cm-1左右的吸收峰是多糖水合振动峰[20],在1384cm-1左有的吸收峰是C-H面内弯曲振动信号峰[21],在1200~1 000cm-1之间的3个吸收峰是C-O键伸缩振动吸收峰,可推测FPSP有吡喃糖环结构[22];在850cm-1附近的吸收峰是a-糖苷的特征峰[23],可推测FPSP是属于a-构型的吡喃多糖。FPSP的FTIR图谱见图2。
3.2.3 GC-MS检测结果通过峰面积归一化确定FPSP由物质的量之比为1:58.02:0.73的木糖、葡萄糖及半乳糖组成,还含有微量的甘露糖,主要成分是葡萄糖。
3.2.4 刚果红染色结果分子中含有三螺旋结构的多糖在碱性条件下能够与刚果红试剂反应形成络合物,且该络合物的λmax会发生红移[24]。本试验结果显示,当氢氧化钠浓度为0~0.5mol/L时,与对照组(刚果红)的λmax比较,试验组(FPSP-刚果红络合物)的λmax发生了明显的红移现象,提示FPSP中存在三螺旋结构。不同氢氧化钠浓度下的刚果红和FPSP-刚果红络合物的λmax曲线图见图3。
3.2.5 SEM观察结果放大200~10000倍的SEM图显示,FPSP大多数表面呈显不规则颗粒堆积而成的网状结构,且颗粒表面基本光滑,颗粒间几乎无空隙,说明FPSP分子间聚合较为完全,相互排斥力较弱,吸引力较强。FPSP的SEM图见图4。
3.2.6 XRD分析结果在20°左右,FPSP有一个强度较大的衍射峰,说明FPSP中同时存在晶体与非晶体结构。FPSP的XRD图见图5。
3.2.7 热化学分析结果TG分析结果显示,在25~600℃温度范围内,FPSP存在2个失重区,第一个失重区出现在100℃左右,FPSP质量损失了4.55%,分析可能是由于失去结合水而引起;第二个失重区出现在250~600℃温度范围内,分析可能是因糖苷键断裂而发生化学裂解导致的[25-26],在这一阶段失去大部分质量。DTG分析结果显示,当温度为263.2℃时,FPSP开始发生化学裂解反应;当温度为288.4℃时,FPSP裂解速度达到最大值(9.32%/min);当温度达到661.4℃时,FPSP剩余质量为原来的24.78%。DSC分析结果显示,FPSP分别在295.2、580.4℃时有2个放热峰,说明FPSP有较好的热化学稳定性。FPSP的热化学分析图见图6。
4 讨论
有研究报道,植物来源多糖的提取率受料液比、提取温度及提取时间等因素的影响较大[27],因此需经过相关参数的优化来确定最优提取工艺。本研究采用Box-Behnken设计一响应面法对FPSP的提取工艺进行了优化,结果,当提取温度为94℃、提取时间为2.45h、料液比为1:28(g/mL)时,FPSP产率为16.25%,显著高于姜峻等[28]优化的浙贝母多糖提取工艺产率5.97%和陈林等[29]优化的太门贝母多糖提取工艺产率1.267%。
通过GC-MS分析得出,FPSP是由物质的量之比为1:58.02:0.73的木糖、葡萄糖及半乳糖及微量甘露糖等组成的杂多糖。Rozi P等[6]研究得出,以水、酸及碱为溶剂提取所得的FPSP由不同比例的鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖及半乳糖组成。Abuduwaili A等[30]用超声、酶法及超声加酶法提取所得的伊贝母多糖单糖组成分析同样得出其主要成分为葡萄糖。刘春红等[22]报道,平贝母多糖主要由木糖、葡萄糖、半乳糖组成,各单糖物质的量之比为5:1:1。Pan F等[31]研究得出,瓦布贝母多糖由物质的量之比为2.62:5.59:10.00:0.76:9.38的甘露糖、半乳糖酸、半乳糖、木糖、阿拉伯糖组成。由此得出,同为贝母属的植物在单糖组成方面存在一定的差异。通过TG分析得出,从263.2℃开始FPSP的质量损失幅度较大,说明此温度后FPSP开始发生化學裂解反应;与酸碱提取的伊贝母多糖[6]相比,本研究所得FPSP具有较好的热稳定性。
综上所述,本研究利用Box-Behnken设计一响应面法优化得到FPSP最优提取工艺。通过UV法、FTIR法、GC-MS法、刚果红染色法、SEM观察、XRD法及热化学分析表征得出,FPSP是由物质的量之比为1:58.02:0.73的木糖、葡萄糖、半乳糖及微量甘露糖等组成的杂多糖,属于典型的a-构型的吡喃多糖,表面结构呈显不规则颗粒堆积而成的网状结构,同时具有较好的热稳定性。本研究旨在为伊贝母资源的充分利用和科学应用提供技术支撑,为将伊贝母作为原料开发成药物或保健品提供物质基础参考。
参考文献
[1]国家药典委员会中华人民共和国药典:一部[S]. 2015年版北京:中国医药科技出版社,2015:141-142.
[2]中国科学院新疆生物土壤沙漠研究所.新疆药用植物志[M].乌鲁木齐:新疆人民出版社,1984:184-185.
[3]LI Y,YILIA, LIJ,et al.New isosteroidal alkaloids withtracheal relaxant effect from the bulbs of Fritillaria pallidi-flora Schrenk[J]. Biooig Med Chem Lett, 2016, 26 (8):1983-1987
[4]SHEN S,LI GY,HUANG J,et al.Chemical constituentsfrom Fritillaria pallidiflora Schrenk[J]. Biochem Syst Ecol,2012.DOI: 10.1016/j .bse.2012.07.034
[5]MIJITI Y, ROZI P,WAILI A, et al Isolation of antimicro-bial peptides from Fritillaria pallidiflora[J]. Chem NatComp,2017,53(6):1144-1147
[6]ROZI P,ABUDUWAILIA,MUTAILIFU P,et al.Sequen-tial extraction, characterization and antioxidant activity ofpolysaccharides from Fritillaria pallidiflora Schrenk[J]Int,Biol Macromol, 2019.DOI: 10.1016/j.ijbiomac.201903.029.
[7]刘勇民,维吾尔药志[M]乌鲁木齐:新疆科技卫生出版社,1999:59-66.
[8]刘筱虹,王佛华.贝母研究概况[J].河北中医药学报,1997,12(4):35-37
[9]HAO DC,GU XJ,XIAO PG,et al Phytochemical and bi-ological research of Fritillaria medicinal resources[J].ChinL,Nat Med, 2014, 11(4):330-344
[10]赵幻希,修洋,焦丽丽,等生晒参、红参中中性多糖的分级及体外抗氧化活性研究[J]中国药房,2017,28(7):943-947
[11]刘燕琳,刘海燕,常金,等桑黄多糖对肉瘤S180细胞体内外的抑瘤作用[J]中国药房,2017,28(22):3069-3072.
[12]WU GJ,LIU D,WAN YJ,et al.Comparison ofhypoglyce-mic effects of polysaccharides from four Iegume species[J]. Food Hydrocolloid, 2019.DOI: 10.1016/j.foodhyd.2018 12 035
[13]翟婭菲,张星稀,相启森,等南瓜多糖的体外抑菌活性[J].食品研究与开发,2019,40(10):70-74
[14]CAO J,TANG D,WANG Y,et al.Characteristics and im-mune-enhancing activity of pectic polysaccharides fromsweet cherry (Prunus avium) [J]. Food Chem, 2018.DOI:10.10 16/j.foodchem.2018.01.145.
[15]YIN HM, WANG SN, NIE SP, et al Coix polysaccha-rides: gut microbiota regulation and immunomodulatory[J]. Bioact Carbohydr Dietar Fibre,2018.DOI:10. 1016/j.bcdf.2018.04.002.
[16]天津市市场监督管理委员会百合磷茎中多糖的含量测定紫外/可见分光光度法DB12/T884-2019[S]. 2019-05-01
[17]中华人民共和同农业部.水果及其制品中果胶含量的测定分光光度法NY/T2016-2011[S]. 2011-12-01.
[18]PATEL MK,TANNA B,MISHRA A,et al.Physicochemi-cal characterization, antioxidant and anti-proliferative ac-tivities of a polysaccharide extracted from psyllium(Povata) Ieaves[J]. Int L, Biol Macromol, 2018.DOI: 10.1016/j.ijbiomac.2018.06.139.
[19]ZHANG WJ, HUANG J, WANG W, et al Extraction, pu-rification, characterization and antioxidant activities ofpolysaccharides from Cistanche tubulosa[J]. Int J BiolMacromol, 2016.DOI:1 0.1 01 6/j.ijbiomac.2016.08.079.
[20]刘春红,马宇,何忠梅,等平贝母多糖的分离纯化及抗氧化活性研究[J]食品科学,2011,32(21):29-33
[21]陈树俊,李佳益,王翠连,等黄梨渣多糖的提取、分离纯化和结构鉴定[J]食品科学,2018,39(20):278-286.
[22]GONG GP,ZHAO JX,WANG CJ,et al.Structural charac-terization and antioxidant activities of the degradationproducts from Porphyra haitanensis polysaccharides[J]Proces.s Biochem, 2018.DOI: 10.1016/j.procbio.2018.05.022
[23]XU WT, ZHANG FF, LUO YB, et al Antioxidant activityof a water-soluble polysaccharide purified from Pteridiumaquilinum[J]. Carbohydr Res, 2009, 344(2):217-222.
[24]CAO JJ,LV QQ,ZHANG B,et al.Structural characteriza-tion and hepatoprotective activities of polysaccharidesfrom the leaves ofToona sinensis (A.Juss) Roem[J]. Car-bohydr Polym,2019.DOI: 10.1016/j.carbp01.2019.02.031
[25]SHEN DK,GU S,BRIDGWATER AV Study on the pyro-lytic behaviour of xylan-based hemicellulose using TG-FTIR and Py-GC-FTIR[J].L,Anal Appl Pyrol, 2010, 87(2):199-206
[26]景永帅,张丹参,吴兰芳,等远志多糖的分离纯化、结构特征及生物活性[J]食品科学,2017,38(17):126-131
[27]宋佳敏,王鸿飞,孙朦,等,响应面法优化金蝉花多糖提取工艺及抗氧化活性分析[J]食品科学,2018, 39 (4):275-281
[28]姜峻,陈蕾俊,王晓梅,等正交试验优化浙贝母多糖的提取工艺[J]现代食品科技,2011,27(7):823-825
[29]陈林,唐华丽,韩林,等响应面法优化水浴提取太白贝母粗多糖工艺[J]湖北农业科学,2016,55(3):720-724.
[30]ABUDUWAILI A,ROZI P,MUTAILIFU P,et al Effectsof different extraction techniques on physicochemicalproperties and biological activities of polysaccharidesfrom Fritillaria pallidiflora Schrenk[J]. Process Biochem,2019.DOI: 10.1016/j .procblo.2019.05.020.
[31]PAN F,SU TJ, LIU Y, et al.Extraction, purification andantioxidation of a polysaccharide from Fritillaria unibrac-teata var. wabuensis[J]. Int J,Biol Macromol, 2018.DOI:10.1016/j.ijbiomac.2 018.02.070.
【收稿日期:2019-10-16修回日期:2019-12-12)
(编辑:邹丽娟)