肿瘤细胞减灭术联合腹腔热灌注化疗对结肠癌与直肠癌腹膜转移的远期疗效比较
2020-02-26刘帛岩李松岩张红亮杨宇滕达刘逸尘许晓蕾李宇轩邢晓伟何长征王玉峰杜晓辉
刘帛岩,李松岩,张红亮,杨宇,滕达,刘逸尘,许晓蕾,李宇轩,邢晓伟,何长征,王玉峰,杜晓辉★
1解放军总医院第一医学中心普通外科,北京 100853;2南开大学医学院,天津 300071;3解放军总医院第一医学中心住院管理科,北京 100853
结直肠癌是全世界发病率最高的恶性肿瘤之一。在我国,结直肠癌的发病率及死亡率均位居恶性肿瘤的前五位[1]。据报道,10%~15%的结直肠癌患者在发现时已经出现腹膜转移,其中有20%~25%的患者会发展为腹膜癌,从而使腹膜成为肝脏之后的第二大常见转移位置[2-4]。发生腹膜转移的癌症患者预后极差,如未进行有效治疗,其平均生存时间仅为6个月[5]。结直肠癌腹膜转移通常被认为是终末期病变,是不可治愈的,且治疗策略主要集中于姑息性全身化疗,必要时结合姑息性手术[6-7]。有研究认为,奥沙利铂联合氟尿嘧啶、亚叶酸钙(FOLFOX)等化疗方案并不能明显延长患者的生存时间[8]。此外,有研究发现,肿瘤细胞减灭术(cytoreduction surgical procedures,CRS)联合腹腔热灌注体腔化疗(hyperthermic intraperitoneal chemotherapy,HIPEC)可用于治疗结直肠癌腹膜转移及局限肝脏受累的患者[9-10]。CRS联合HIPEC被认为是一种可能治愈结直肠癌腹膜转移的治疗手段[11-13]。大多数学者认为原发于结肠或直肠的腹膜转移癌是同一种疾病,无需特异区分腹膜癌的起源。但也有研究认为,结肠癌腹膜转移与直肠癌腹膜转移具有不同的生物学行为及预后[14]。本研究旨在比较CRS联合HIPEC治疗起源于结肠与直肠的腹膜转移癌患者的远期疗效差异。
1 资料与方法
1.1 一般资料 收集2012年1月1日-2013年5月31日于解放军总医院第一医学中心普通外科行CRS联合HIPEC的103例结直肠癌腹膜转移患者的临床资料并进行回顾性分析。其中男68例,女35例,年龄35~74(62.3±7.8)岁。临床分期依据美国癌症联合委员会(AJCC)第8版标准[15]。根据肿瘤起源位置,将患者分为结肠来源组(结肠组,n=60)与直肠来源组(直肠组,n=43)。纳入标准:①无严重的心、肺、肝、肾等功能障碍,全身情况能够耐受手术治疗及化疗;②手术方式为腹腔镜辅助手术,术后均经病理诊断为结直肠腺癌;③可切除的腹膜转移癌;④预计生存时间≥3个月;⑤近3个月内未接受其他化疗。排除标准:①急诊手术(梗阻、穿孔等原因);②年龄>75岁或<20岁;③术前常规检查发现远处器官(肝脏、肺、脑或全身骨)多处转移或腹膜后淋巴结转移;④急性或慢性感染;⑤免疫系统疾病;⑥围术期死亡。
1.2 治疗方法 两组患者术前1 d饮食均为流食,并口服复方聚乙二醇电解质散164.4 g(京舒泰神)进行肠道准备,术前0.5 h常规预防性使用抗菌药物氟氯西林钠1 g(晋泰盛)或硫酸依替米星0.3 g(常州方圆)。麻醉方法为气管插管全麻。采用腹腔镜辅助手术,由具有丰富腹腔镜结直肠手术经验的主任医师完成。手术行最大程度CRS,对壁层腹膜行区域性整片剥脱术,对脏层腹膜及肠道器官行病变肠管切除术。肿瘤与重要器官粘连而不能切除者,采用球形电刀气化、碳化肿瘤组织,然后进行肿瘤细胞减灭完全性(completeness of cytoreduction,CC)评级,达到完全性CRS(CC0或CC1)[16]。手术完成关腹前,将4根专用一次性热灌注管置于腹盆腔中,位置分别为脾窝、肝顶左右各1根,盆腔内左右各1根,且管上下交叉。术后第1、3、5天分别进行1次HIPEC。选取化疗药物第1次为顺铂(济南齐鲁制药),剂量为60 mg;第2、3次均为氟尿嘧啶(天津金耀氨基酸有限公司),剂量为1.0 g。每次均将化疗药物溶解于4500 ml生理盐水中,调整循环水温为43 ℃,流量为400 ml/min,每次治疗有效循环时间均为1 h。
1.3 观察指标 收集并分析患者癌症相关数据如临床分期、腹膜癌发生时间、腹膜种植指数(peritoneal carcinomatosis index,PCI)等,外科手术相关资料如是否联合其他脏器切除、吻合口数量、CC评级、是否输血等,以及患者近期并发症和远期生存指标等。PCI:将腹腔划分成13个区,评价每个区的肿瘤负荷评分,无可见肿瘤为0分,肿瘤直径<0.5 cm为1分,肿瘤直径0.5~5 cm为2分,肿瘤直径>5 cm或融合为3分,PCI为各区肿瘤负荷评分的总和。CC评级:无肿瘤残留(R0切除)为0级,残留肿瘤组织<0.25 cm为1级,残留肿瘤组织0.25~2.50 cm为2级,残留肿瘤组织>2.5 cm为3级。
1.4 随访 每6个月采用电话或门诊等方式对患者进行一次随访,记录患者肿瘤复发或转移的时间、后续治疗情况以及生存情况。
1.5 统计学处理 采用SPSS 20.0软件进行统计分析。符合正态分布的计量资料以表示,两组间比较采用独立样本t检验;计数资料组间比较采用χ2检验或Fisher确切概率法。采用Kaplan-Meier法绘制患者生存曲线,并用log-rank法比较两组的生存差异。P<0.05为差异有统计学意义。
2 结 果
2.1 两组患者基线资料比较 两组患者性别、年龄、体重指数(BMI)、美国麻醉医师协会(ASA)分级等基本资料差异均无统计学意义(P>0.05,表1)。
2.2 两组患者手术情况比较 两组PCI、CC评级、接受肝脏联合切除、吻合口数及术中输血比例差异均无统计学意义(P>0.05,表2)。
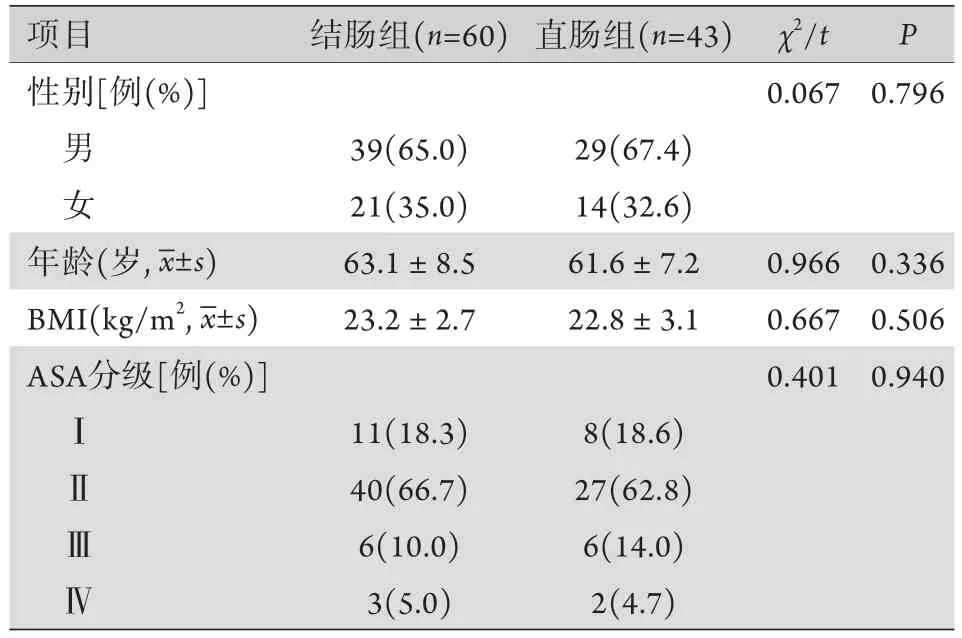
表1 两组患者基线资料比较Tab.1 Comparison of basic data between colonic group and rectal group

表2 结肠组与直肠组患者手术情况比较[例(%)]Tab.2 Surgical status in colonic group and rectal group [n(%)]
2.3 两组患者术后近期并发症及远期复发情况比较 103例患者中有8例(7.8%)出现严重并发症(Ⅲ级或Ⅳ级),其中结肠组4例,直肠组4例,两组严重并发症分布差异无统计学意义(P>0.05)。两组患者行CRS联合HIPEC后的复发率差异无统计学意义(P>0.05),且复发患者中接受全身化疗、二次减瘤手术联合HIPEC、肝切除手术以及其他治疗方法的比例差异亦无统计学意义(P>0.05,表3)。
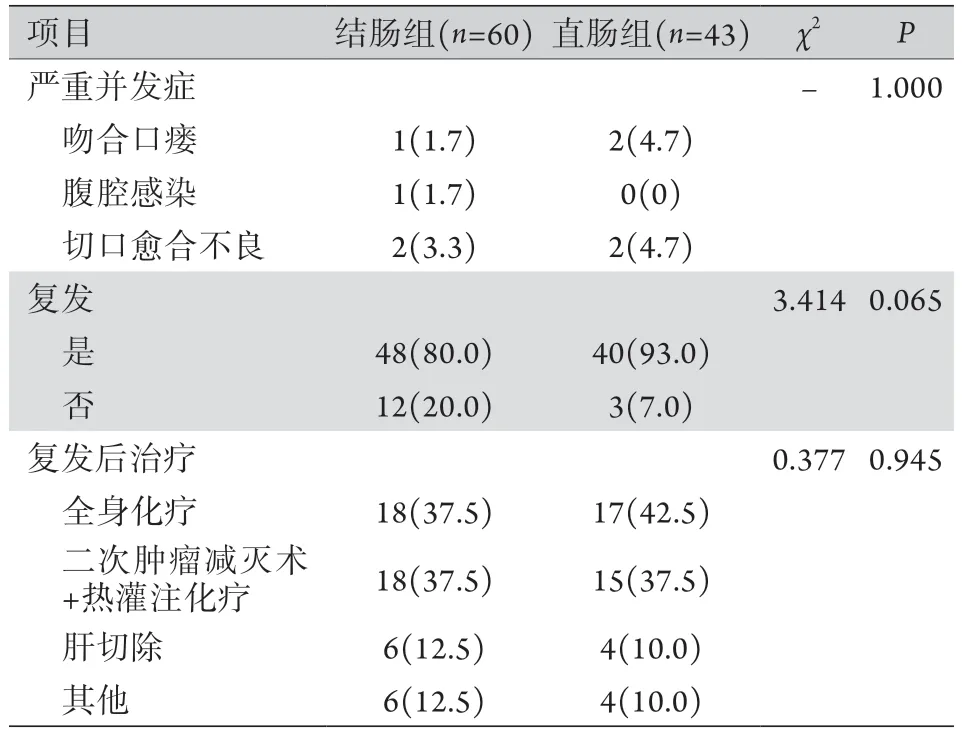
表3 两组患者术后近期并发症及远期复发情况比较[例(%)]Tab.3 Short-term complications and long-term recurrent status in colonic group and rectal group treated with CRS and HIPEC [n(%)]
2.4 两组患者生存情况比较 103例患者均获随访,随访时间为(28.43±15.65)个月。两组患者的总生存和无病生存曲线见图1、2。结肠组患者的中位总生存时间(OS)、中位无病生存时间(DFS)、复发到死亡时间(TTD)、3年和5年生存率均明显优于直肠组(P<0.05,表4)。
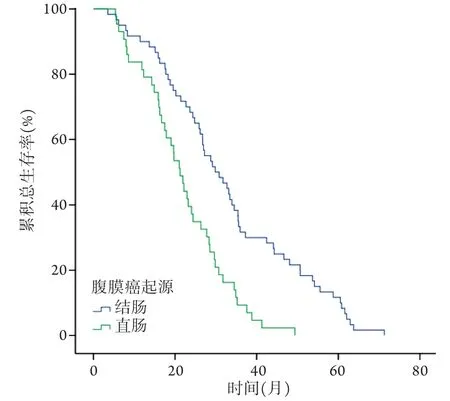
图1 两组患者行肿瘤细胞减灭术联合腹腔热灌注化疗后的总生存曲线Fig.1 OS curve of patients in colonic group and rectal group treated with CRS and HIPEC
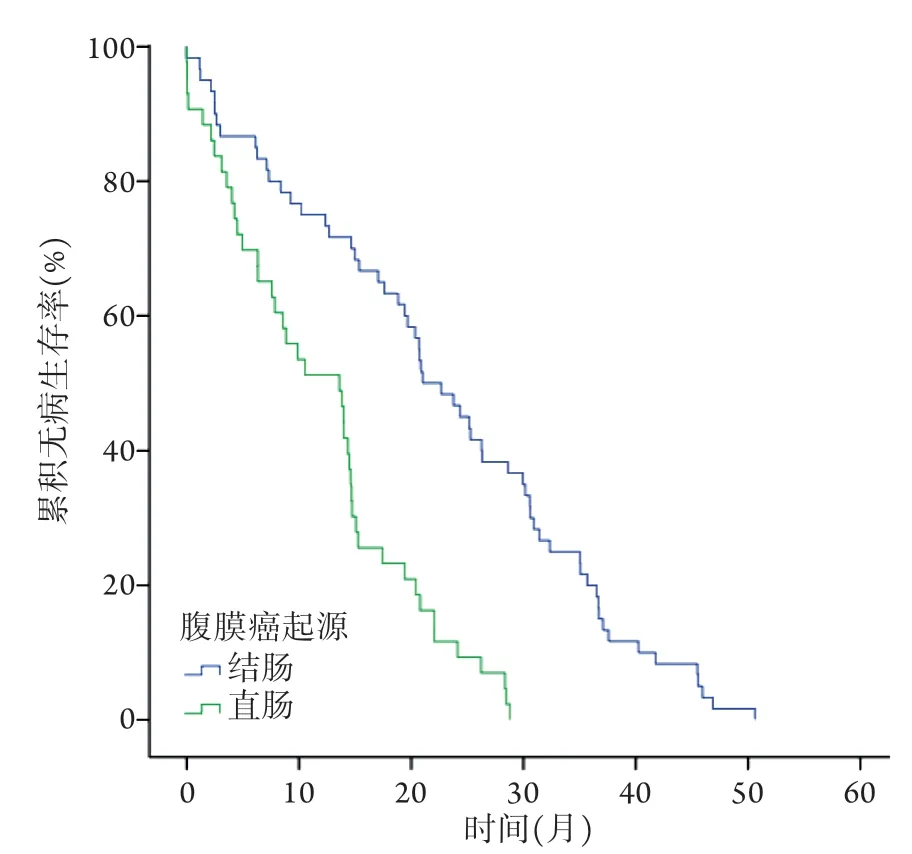
图2 两组患者行肿瘤细胞减灭术联合腹腔热灌注化疗后的无病生存曲线Fig.2 DFS curve of patients in colonic group and rectal group treated with CRS and HIPEC

表4 两组患者生存情况比较Tab.4 Survival status of patients in colonic and rectal group treated with CRS and HIPEC
3 讨 论
HIPEC治疗腹膜癌的主要机制在于:①腹膜-血浆屏障限制了腹膜对于大分子药物的吸收,从而使化疗药物在腹腔内能够维持较高浓度,而外周血药浓度较低,既增加了药物对肿瘤细胞的直接杀伤作用,又减轻了全身毒副作用。②热疗效应能够在组织水平引起癌组织内微血管栓塞,引起肿瘤组织缺血性坏死;在细胞水平打破细胞的稳态,直接引起肿瘤细胞死亡;在分子水平能够使癌细胞膜蛋白变性,并干扰蛋白质及核酸的合成。③化疗药物与热疗效应具有协同作用,对肿瘤细胞能起到“1+1>2”的杀伤效果。CRS后立即行HIPEC,能在无腹腔粘连的情况下,使药物在腹腔内充分分布,也能最大程度减少残余肿瘤负荷。
2003年,Verwaal等[17]采用CRS联合HIPEC治疗结直肠癌腹膜转移患者,结果显示,直肠起源的腹膜转移癌患者的中位生存时间较结肠起源者短(16个月vs.21.6个月)。2006年da Silva等[14]的研究显示,64例结肠癌腹膜转移患者接受减瘤手术治疗的中位生存时间明显长于6例直肠癌腹膜转移患者(35个月vs.17个月)。本研究结果显示,结肠来源的腹膜转移癌患者接受CRS联合HIPEC治疗的近期并发症发生率与直肠来源者无明显差异;而在远期疗效上,结肠癌患者的中位生存时间则高于直肠癌患者。本研究结果与以上研究结果一致,提示起源于结肠的腹膜转移癌患者的远期预后优于起源于直肠者。
而2013年Votanopoulos等[18]则得出了相反的结论:该研究纳入204例结肠来源的腹膜转移癌患者和13例直肠来源的腹膜转移癌患者,经CRS联合HIPEC治疗后,不同起源的腹膜转移癌患者的中位生存时间(17个月vs.14.3个月)无明显差异,两组患者的中位生存时间均较短,其可能原因是患者未行彻底的CRS,其中49%的结肠组患者和46%的直肠组患者仅接受了R2切除。
有研究认为,由于直肠位于狭窄的盆腔内,其解剖部位的特殊性使原发肿瘤及盆腔腹膜的切除更加困难,并增大了癌细胞在盆壁中残留的可能性,从而导致直肠癌的预后较差[19]。另有研究认为,发生腹膜转移的直肠癌细胞能够穿透较结肠壁更厚的直肠壁,其在生物学上更具有侵略性[14]。
既往研究结果显示,CRS联合HIPEC可提高生存率,改善患者预后[20]。对于晚期患者,HIPEC也能够缓解结直肠癌引起的恶性腹水,提高患者的生活质量[21]。然而,一项发布于2018年的研究指出,CRS后加用HIPEC并不能延长患者的中位无复发生存期及中位总生存期[22]。但由于外科手术及HIPEC涉及多项混杂因素,且该研究中的亚组分析显示PCI评分为11~15分的亚组可以从HIPEC中获益,因此并不能否定其在结直肠癌腹膜转移治疗中的价值。所以,在临床应用中,应该更加严格其适应证,并在未来的研究中建立更好的预测模型来判断何种程度的患者能够从CRS联合HIPEC中获益更多。
综上所述,本研究结果显示,CRS联合HIPEC治疗直肠癌与结肠癌腹膜转移,二者近期并发症发生率相当;在远期疗效上,结肠癌患者的预后优于直肠癌患者。建议临床医师在报告病例时应区分腹膜癌起源于结肠或直肠,在对直肠癌腹膜转移患者进行HIPEC治疗时,应更严格地把握治疗指征,以确保患者能从治疗中获益。
