单核-巨噬细胞TREM-1对重症中暑大鼠急性肺损伤的作用及机制
2020-02-26陈怿邱嘉玲丁程佳陈加弟刘志峰童华生江东新
陈怿,邱嘉玲,丁程佳,陈加弟,刘志峰,童华生★,江东新★
1东莞市滨海湾中心医院重症医学科,广东东莞 523900;2暨南大学医学部,广州 510632;3南部战区总医院重症医学科/解放军热区创伤救治与组织修复重点实验室,广州 510010
中暑是由高温诱发的全身炎症反应 (systemic inflammatory response syndrome,SIRS)及以中枢神经系统功能异常为突出表现的多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)[1],在我国南方地区夏秋季节极为常见,严重危害人民群众的健康与安全[2]。重症中暑是中暑的极危重类型,临床上往往采取积极的全身降温和脏器支持等救治措施,但其病死率仍居高不下[3]。随着全球气候变暖及热浪袭击强度和频率的增加,重症中暑病死率呈逐年升高的趋势,即使在华北和东北等高纬度地区亦频发重症中暑致死事件[4]。呼吸系统是中暑常见的首发打击器官,常表现为以呼吸功能障碍为主的急性肺损伤[5],加之血管通透性增加、液体复苏不当等因素的作用,约45%的中暑患者会出现肺水肿、肺损伤,甚至进展为急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)[6]。有研究发现,炎性损伤和氧化应激是重症中暑启动并加剧急性肺损伤的主要病理机制[7-8],且可能与全身或局部的巨噬细胞活性过度强化及其表面的髓样细胞触发受体-1(triggering receptor expressed on myeloid cells-1,TREM-1)过度表达有关[9-10]。目前研究认为,在固有免疫系统中起核心作用的单核-巨噬细胞与全身炎症及外周组织器官损伤密切相关[11]。有循证证据显示,单核-巨噬细胞活性功能异常与肺组织炎性损伤程度密切相关[12],提示重症中暑后单核细胞TREM-1活性功能异常可能是急性肺损伤的重要细胞分子机制,但目前国内外尚未见相关报道。本研究建立中暑大鼠模型并给予TREM-1抑制剂预处理,以期探讨特异性抑制TREM-1活性对调控重症中暑大鼠急性肺损伤的作用及其可能机制。
1 材料与方法
1.1 试剂及仪器 TREM-1抑制剂LP-17购自美国Sigma公司;大鼠肿瘤坏死因子-α(TNF-α)、白细胞介素(IL)-6和IL-1β酶联免疫吸附分析(ELISA)试剂盒均购自武汉基因美生物科技有限公司;大鼠CD14流式抗体、诱导型一氧化氮合酶(iNOS)免疫组化抗体、TREM-1流式抗体和单核细胞趋化蛋白-1(MCP-1) Western blotting抗体均购自美国R&D公司;TREM-1 Western blotting抗体购自英国Abcam公司。LSRFortessa流式细胞仪购自美国BD公司。
1.2 实验动物及分组 SPF级健康成年雄性Wistar大鼠40只,体重200~250 g,由南方医科大学动物实验中心提供,喂养于温度(22±1) ℃和湿度50%±5%的环境中。实验前禁食2 h、禁水6 h。本实验动物处置流程获得东莞市滨海湾中心医院伦理委员会审核批准,符合单位及国家有关实验动物管理和使用规定。按随机数字表法将大鼠分为对照组(Con组)、中暑组(HS组)、低剂量抑制剂组(LD组)和高剂量抑制剂组(HD组),每组10只。
1.3 模型建立及药物处理 LD组、HD组大鼠分别于造模前2 h经尾静脉注射50 mg/kg、100 mg/kg LP-17试剂。Con组大鼠置于室温24 ℃环境下观察100 min,HS组、LD组和HD组大鼠置于人工气候舱内[温度(40±2) ℃、湿度65%±5%]接受高温高湿打击60 min,制备经典中暑模型。根据本课题组的前期研究结果,非麻醉状态下生活型中暑大鼠造模成功时间为85~90 min[13],故本实验在热应激后80 min颈椎脱臼处死大鼠,采集下腔静脉血8 ml行ELISA和流式细胞术检测,取左肺行组织学观察和免疫组化分析,右肺经低温充分研磨后获得组织匀浆上清行ELISA和Western blotting检测。
1.4 方法
1.4.1 ELISA法测定炎性因子的表达水平 采用ELISA法测定血清和肺组织匀浆上清中TNF-α、IL-1β和IL-6的表达水平,实验步骤参见试剂盒说明书。以空白孔调零,反应终止后于450 nm波长处测定吸光度(OD)值,根据标准曲线方程计算炎性因子的表达水平。
1.4.2 流式细胞术检测单核细胞TREM-1的表达采用CD14流式抗体(2.5 μg/106个细胞)标记全血中的单核细胞,加入TREM-1流式抗体(0.25 μg/106个细胞)标记目的表面分子,在488 nm激发波长、525 nm发射波长条件下,进行流式细胞检测,计算细胞计数和百分数。
1.4.3 肺组织病理学观察 肺组织切片行HE染色,随机编码,由病理学医师于光学显微镜下行盲法病理损伤评分,具体标准参照文献[14],根据肺泡炎性浸润、血管周围炎性浸润、间质炎性浸润、肺水肿和肺泡出血等5类病理损伤程度分别给予0~3分(轻度、中度、重度)赋值,每个玻片观察10个视野,记录平均值。
1.4.4 免疫组化法检测iNOS蛋白的表达 肺组织切片经抗体(1:50)孵育、显色、复染、脱水、透明和封固等处理,利用光学显微镜观察和Image Pro Plus 6.3软件进行分析,测定免疫阳性产物的OD值,免疫反应产物的OD值除以背景OD值得到校正的相对OD(COD)值,即为iNOS免疫阳性产物的实际OD值。
1.4.5 Western blotting检测TREM-1和MCP-1蛋白的表达 肺组织经细胞裂解、转膜、TREM-1抗体(1:1000)和MCP-1抗体(1:500)孵育、洗膜和定影等流程,利用凝胶成像分析仪分析,以目标条带和内参条带的灰度值比值作为蛋白的相对表达量。
1.5 统计学处理 采用SPSS 17.0软件进行分析。计量资料以表示,多组间比较采用方差分析,两两比较若方差齐则采用LSD-t检验,若方差不齐则采用Dunnett T3非参数检验。P<0.05为差异有统计学意义。
2 结 果
2.1 抑制TREM-1可抑制中暑后体循环血和肺组织中炎性介质的释放 ELISA检测结果显示,与Con组比较,接受热应激的HS组、LD组和HD组大鼠体循环血和肺组织中TNF-α、IL-1β和IL-6的表达水平均明显升高(P<0.01)。经TREM-1抑制剂预处理的LD组、HD组大鼠体循环血和肺组织中TNF-α、IL-1β和IL-6的表达水平均低于HS组,且HD组低于LD组,差异均有统计学意义(P<0.05或P<0.01,图1)。
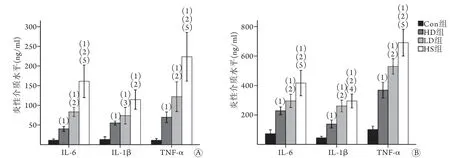
图1 各组大鼠体循环血和肺组织中炎性介质水平比较Fig.1 Comparison of the levels of inflammatory mediators in the circulating blood and lung tissues of rats in each group
2.2 抑制TREM-1可抑制中暑后体循环血中单核细胞TREM-1的异常表达 流式细胞术检测结果显示,与Con组比较,接受热应激的HS组、HD组和LD组大鼠体循环血单核细胞中TREM-1的表达均明显增加(P<0.01)。经TREM-1抑制剂预处理的HD组和LD组大鼠体循环血单核细胞中TREM-1的表达少于HS组,且HD组少于LD组,差异均有统计学意义(P<0.05或P<0.01,图2)。
2.3 抑制TREM-1可减轻中暑后肺组织损伤 HE染色显示,Con组大鼠可见正常肺泡和毛细血管等结构,肺泡无渗出或出血,肺间质无充血、水肿或炎症浸润;HS组大鼠肺组织可见弥漫性肺泡渗出和出血,肺间质肿胀增厚伴大量炎性细胞浸润,大量肺泡毛细血管淤血伴局部血栓形成;LD组大鼠肺泡出血和毛细血管淤血仍较显著,但肺间质渗出较HS组有明显减轻;HD组大鼠肺组织可见肺间质渗出和炎性浸润,肺泡出血和血管淤血等病理性改变较少。光镜下肺组织病理损伤评分结果显示,热应激后HS组、HD组和LD组大鼠肺组织损伤评分均明显高于Con组(P<0.01),HS组高于LD组(P<0.05)和HD组(P<0.01),LD组高于HD组(P<0.01,图3)。
2.4 抑制TREM-1可缓解中暑后肺组织的氧化应激 免疫组化染色结果显示,Con组大鼠肺组织未见明显的iNOS表达;HS组可见多处大面积iNOS表达,呈棕褐色,多见于肺间质和肺泡上皮细胞等,伴肺泡结构大量破坏;LD组和HD组iNOS表达较HS组明显减少。统计结果显示,热应激后各组大鼠肺组织iNOS的COD值均高于Con组(P<0.01),HS组高于LD组(P<0.01)和HD组(P<0.01),LD组高于HD组(P<0.01,图4)。
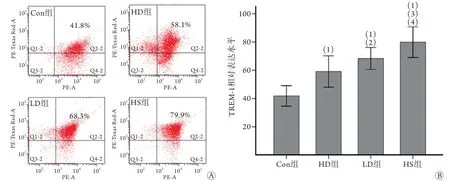
图2 各组大鼠体循环血单核细胞中TREM-1的表达水平比较Fig.2 Comparison of expression for TREM-1 on the monocytes in the systemic circulation of the rats in each group

图3 各组大鼠肺组织病理学变化和损伤评分情况(HE ×200)Fig.3 The histological investigation and scores for the rats' lung in each group (HE ×200)
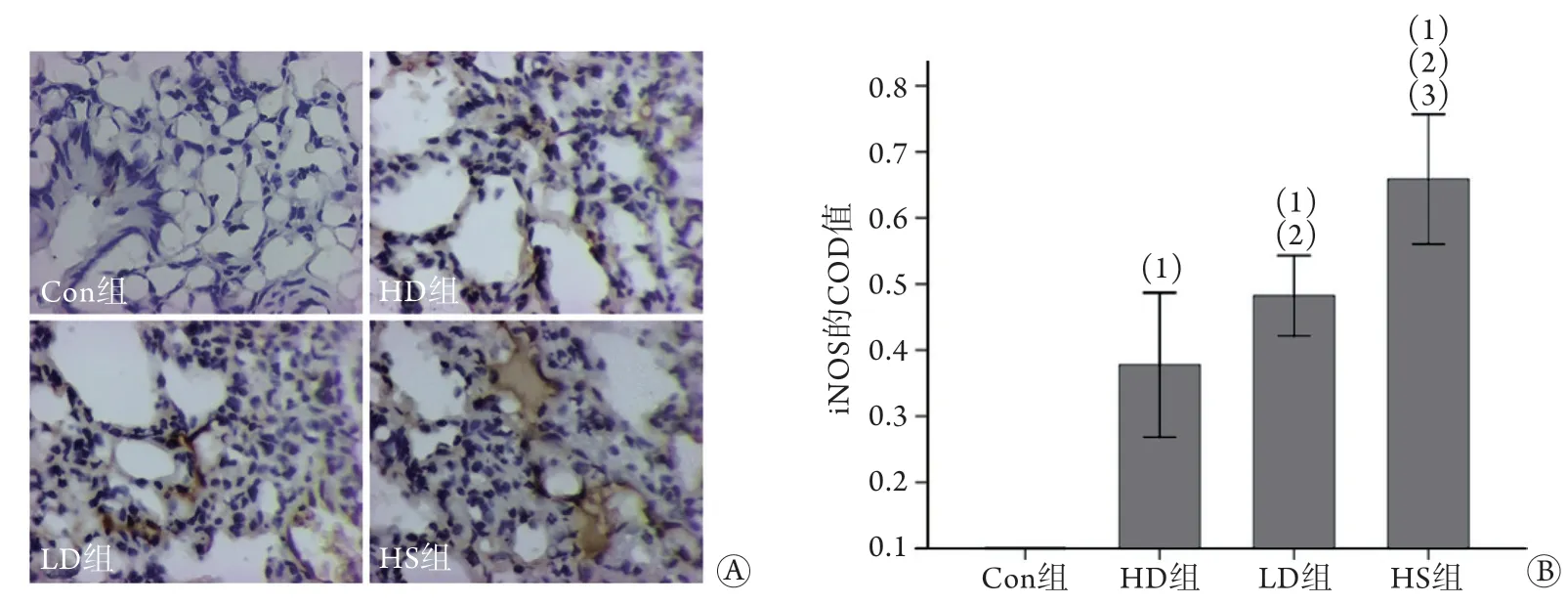
图4 各组大鼠肺组织iNOS表达比较Fig.4 Comparison of expression of iNOS in lung tissue of rats in each group
2.5 抑制TREM-1可抑制中暑后肺组织中TREM-1和MCP-1的异常表达 Western blotting检测结果显示,与Con组比较,中暑可导致大鼠(HS组)肺组织中TREM-1和MCP-1蛋白表达水平异常升高(P<0.01)。给予TREM-1抑制剂预处理后,HD组和LD组大鼠肺组织中TREM-1和MCP-1蛋白表达水平均降低(P<0.05),其中HD组2种蛋白表达水平均低于LD组(P<0.01,图5)。
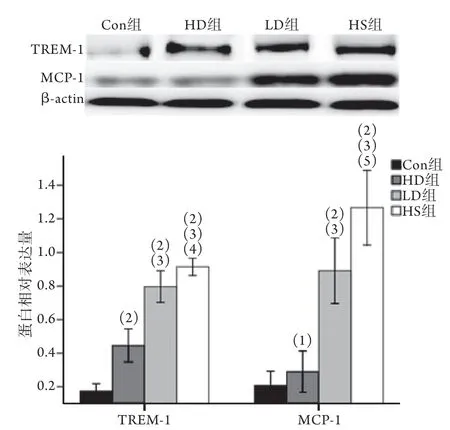
图5 各组大鼠肺组织中TREM-1和MCP-1表达比较Fig.5 Comparison of expression of TREM-1 and MCP-1 protein in lung tissue of rats in each group
3 讨 论
近年来,我国夏季常出现严重的极端高温天气,使重症中暑成为高温气候环境威胁群众健康与生命的常见疾病。目前普遍认为,重症中暑是由高温高湿气候因素诱发的、以炎症失控与凝血紊乱为突出表现的MODS,以其发病机制为基础、以防治多器官功能损伤为目的的中暑诊治策略成为继快速降温后重症中暑救治的“第二关键点”[15]。中暑极易并发肺损伤,且重症中暑并发ARDS的发病率高达23%,一旦发生ARDS,病死率可达75%。炎性损伤与凝血障碍是中暑向ARDS进展的关键的病理生理基础[16]。非临床研究发现,调控SIRS的广度和严重程度可缓解重症中暑引起的急性肺损伤[17-19],但在临床研究中却未达到改善主要临床结局的目的[9],原因可能与未对启动肺损伤的上游机制或核心环节进行干预有关。鉴于有循证依据显示单核-巨噬细胞在启动并加重脓毒症急性肺损伤中起重要作用[20],同时体外研究发现TREM-1表达异常可能是重症中暑单核细胞活性功能异常的关键蛋白分子基础[21],笔者推测特异性调控单核-巨噬细胞TREM-1的活性可减轻重症中暑急性肺损伤。本研究从全身和局部炎性介质水平、组织学观察、氧化损伤程度及趋化因子表达等方面探讨调控单核-巨噬细胞TREM-1活性减轻重症中暑急性肺损伤的效果。
LP-17多肽是高选择性的TREM-1抑制剂,主要用于调控单核-巨噬细胞功能活性的相关研究[22]。本研究在大鼠中暑造模前给予不同剂量的LP-17预处理,梯度式抑制单核-巨噬细胞TREM-1的活性,结果显示,不同剂量的TREM-1抑制剂均可下调中暑后单核-巨噬细胞TREM-1的表达水平;抑制TREM-1活性均可有效抑制重症中暑体循环血及肺组织中TNF-α、IL-1β和IL-6表达水平的异常升高。本课题组的前期研究发现,TNF-α、IL-1β和IL-6等经典炎性介质水平的变化与重症中暑肺损伤严重程度具有相关性,抑制上述炎性介质的生成有利于减轻中暑引起的急性肺损伤[7]。结合本研究结果,提示调控单核-巨噬细胞TREM-1活性减轻重症中暑急性肺损伤的潜在机制之一是抑制全身和局部的炎症反应。
为了更直观地观察调控TREM-1活性对重症中暑急性肺损伤的作用效果,本研究对肺组织切片行HE染色观察和病理损伤评分,发现TREM-1抑制剂浓度越高,缓解中暑后肺损伤的效果越明显。为了进一步了解其肺保护作用的机制,本研究对肺组织切片行免疫组化检测,发现抑制TREM-1活性减少了中暑后肺组织iNOS的表达。iNOS是中暑导致组织器官炎症和氧化损伤的重要介质[23],其局部组织表达水平与氧化损伤程度直接相关,下调其在肺组织中的表达有利于缓解急性肺损伤[24]。因此,本研究结果证实调控单核-巨噬细胞TREM-1活性减轻重症中暑急性肺损伤的潜在机制之一是缓解肺组织的氧化损伤。
MCP-1具有诱导单核细胞向巨噬细胞分化、增强单核-巨噬细胞活性并促进其黏附游走的作用[25]。本研究采用Western blotting检测发现,中暑后肺组织MCP-1表达明显上调,而抑制TREM-1活性可下调其表达水平,提示调控单核-巨噬细胞TREM-1的活性减轻重症中暑急性肺损伤的潜在机制之一是下调MCP-1的过表达。
综上所述,本研究结果提示单核-巨噬细胞表面的TREM-1在重症中暑所致器官功能损伤中具有重要作用,为深入探讨并完善重症中暑向MODS发生发展的机制提供了理论依据,即调控单核-巨噬细胞TREM-1活性可通过下调循环血和肺组织中TREM-1的表达,进而减轻炎性损伤、缓解氧化应激和抑制趋化因子的释放等机制减轻重症中暑的急性肺损伤。此外,本研究仅使用了TREM-1活性抑制剂,为了更全面地阐释单核-巨噬细胞TREM-1在重症中暑器官损伤病理机制中的作用,后续可利用基因敲除或基因沉默的方法进一步深入研究。
